血清VEGF、IGF-1水平与脑胶质瘤患者手术治疗预后的相关性
2022-12-29奚再兴何小姣
奚再兴,何小姣
(南阳市第一人民医院 神经外科,河南 南阳 473000)
手术是治疗脑胶质瘤常用且最有效的方法,手术切除病灶后可降低颅内压,减轻临床症状,延长患者生命[1]。但部分患者瘤体过大,肿瘤与脑组织之间界限不清,手术仍难以彻底切除全部病灶,术后极易出现病灶复发,加重患者病情,进而增加病死率[2]。现阶段在针对脑胶质瘤的预后评估中,发现诸多细胞因子参与其发病机制,血管内皮生长因子(vascular endothelial growth factor,VEGF)能够促进内皮增生和肿瘤血管生长,影响肿瘤血供和生长,参与肿瘤病情进展[3]。胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)是一种多功能细胞调控因子,在机体糖代谢异常时则异常表达,参与调控细胞增殖和转移[4]。已有部分研究发现,IGF-1与乳腺癌、结肠癌发展程度有关[5-6]。基于上述背景,本研究将分析血清VEGF、IGF-1与脑胶质瘤患者预后的关系,探讨VEGF、IGF-1在脑胶质瘤预后评估中的应用价值。
1 资料与方法
1.1 一般资料研究数据来源于医院神经外科2016年8月至2018年8月收治的96例脑胶质瘤患者,患者及家属均签署知情同意书。(1)纳入标准:①脑胶质瘤符合《中国中枢神经系统胶质瘤诊断与治疗指南(2015)》[7]中相关诊断;②由同一医生进行胶质瘤切除术;③术前检查感觉、运动神经基本正常;④术后颅内压稳定,神经功能恢复良好。(2)排除标准:①合并脑卒中;②合并其他系统恶性肿瘤;③合并脑实质病变;④合并偏瘫、失语、失明;⑤合并血管性痴呆;⑥肿瘤远处转移;⑦近期发生颅脑外伤。96例患者男60例,女36例;年龄23~48岁,平均(35.62±2.15)岁;疾病类型为星形细胞瘤38例、少突胶质细胞瘤26例、髓母细胞瘤32例;肿瘤直径3.2~5.2 cm,平均(4.24±0.18)cm;恶性程度为低级别58例、高级别38例;肿瘤位置为幕上胶质瘤32例、幕下胶质瘤64例。本研究经过医院医学伦理委员会审核并通过。
1.2 方法
1.2.1预后评估方法 患者入院后择期行开颅胶质瘤切除术,术后均接受为期3 a随访,随访方式为电话随访和家庭随访,参考欧阳一彬等[8]研究,根据随访期间患者生存情况定义患者预后,分为预后不良(随访期间病死)和预后良好(随访结束仍存活),以随访期间患者病死视为随访终点事件。
1.2.2检测方法 术前采集患者空腹外周静脉血5 mL,使用TD5K-Ⅲ离心机(上海舜制仪器制造有限公司),以3 500 r·min-1速率,10 cm离心半径,离心10 min获取血清,检测血清VEFG、IGF-1、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)125、CA153。其中血清VEFG、IGF-1采用酶联免疫吸附法检测;血清CEA、CA125、CA153采用化学发光法检测,试剂盒均购自上海晶抗生物工程有限公司。

2 结果
2.1 脑胶质瘤患者手术治疗预后共收录96例脑胶质瘤患者,术后共随访6~36个月,中位随访时间21个月;随访期间病死45例,存活51例;预后不良占46.88%(45/96),预后良好占53.12%(51/96)。生存曲线见图1。

图1 脑胶质瘤患者手术治疗后随访期间的生存曲线
2.2 脑胶质瘤患者一般资料统计结果两组在年龄、性别、疾病类型等方面相比较,差异无统计学意义(P>0.05)。见表1。
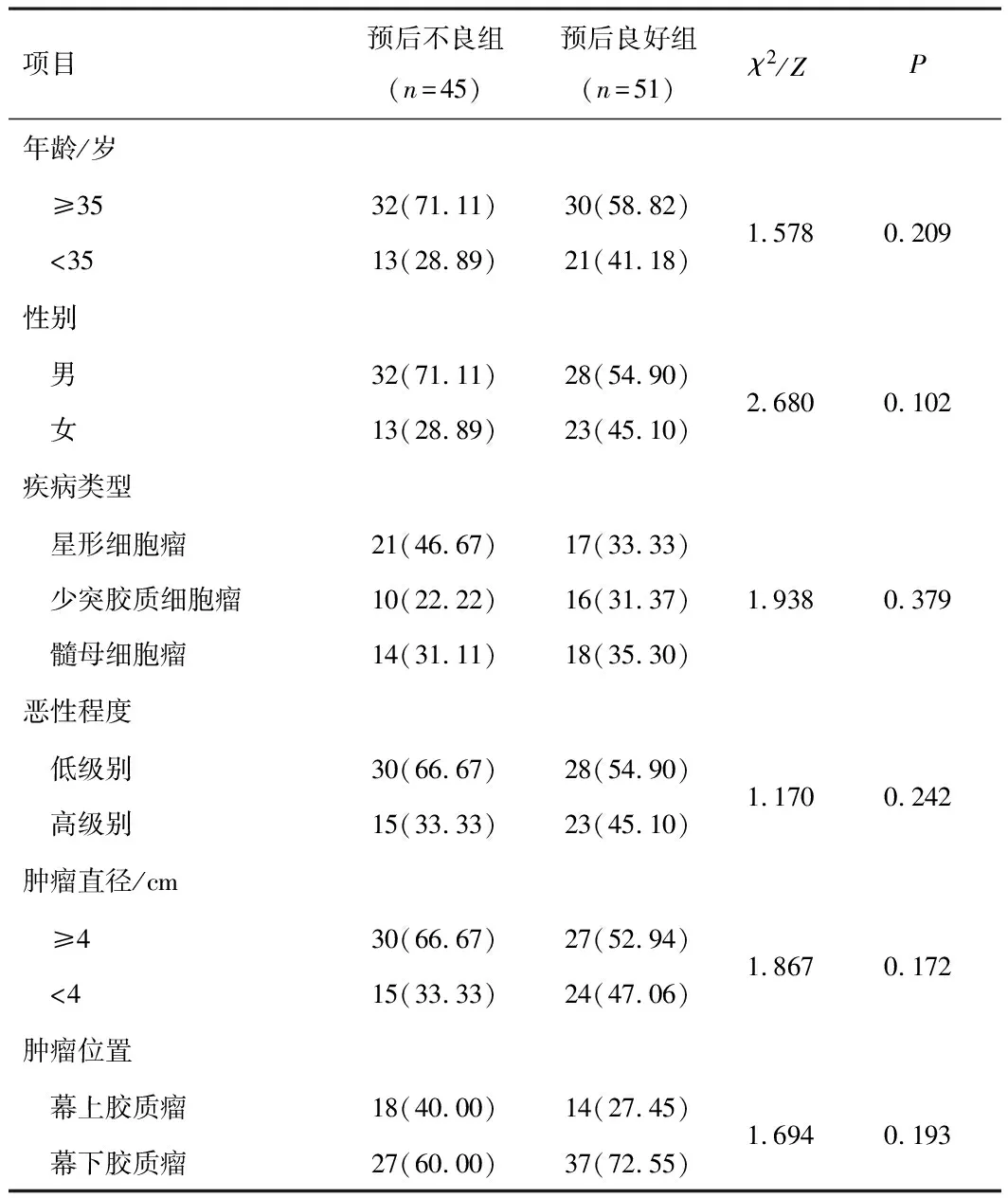
表1 预后不良组、预后良好组一般资料比较
2.3 预后不良组、预后良好组实验室指标比较预后不良组血清VEGF、IGF-1、CEA、CA153、CA125水平均高于预后良好组(P<0.05)。见表2。
2.4 Cox风险模型分析构建Cox风险模型,以脑胶质瘤患者预后作为因变量,将表2中各指标作为自变量,结果显示,脑胶质瘤患者预后不良与血清VEGF、IGF-1、CA125过表达均有关(HR>1,P<0.05)。见表3。
表2 预后不良组、预后良好组实验室指标比较
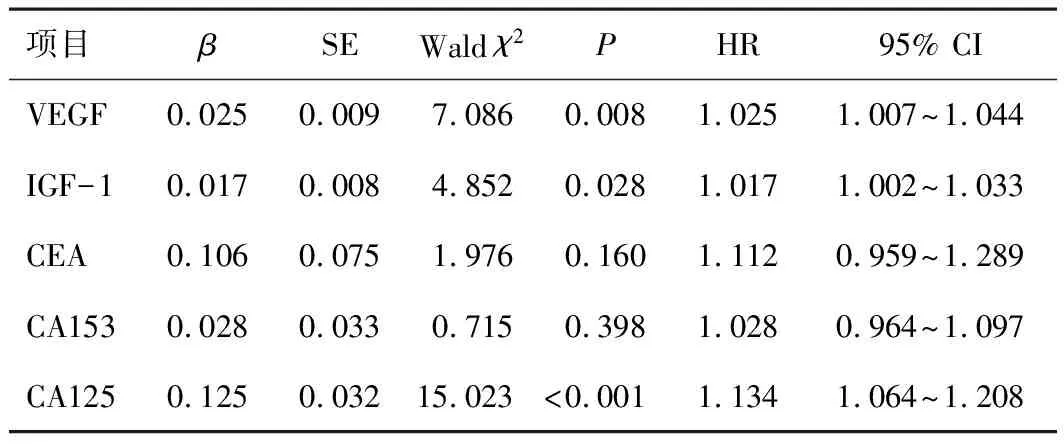
表3 各指标与脑胶质瘤患者手术治疗预后的关系的Cox风险模型分析
2.5 血清VEGF、IGF-1预测脑胶质瘤患者手术治疗预后不良的ROC曲线绘制ROC曲线,以脑胶质瘤预后作为状态变量,以血清VEGF、IGF-1作为检验变量,血清VEGF、IGF-1单独及联合均能够预测脑胶质瘤预后不良风险,AUC分别为0.829、0.826、0.895。见表4、图2。

表4 血清VEGF、IGF-1水平对脑胶质瘤患者手术治疗预后不良的预测价值
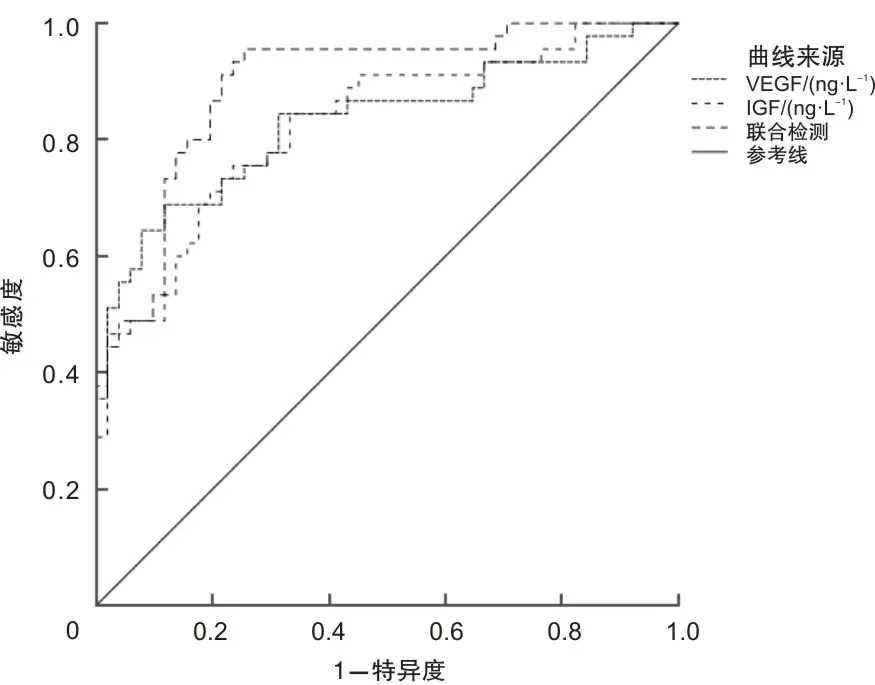
图2 血清VEGF、IGF-1预测脑胶质瘤患者手术治疗预后不良的ROC曲线图
3 讨论
手术在脑胶质瘤的综合治疗中占据主导地位,手术切除后能够降低瘤体压迫脑组织导致的颅内高压,减轻神经功能损伤,有助于改善患者生存质量,然而部分患者术后仍因病灶复发导致病情加重,最终影响预后[9]。欧阳一彬等[8]在对130例脑胶质瘤患者的调查中发现,43.08%患者在随访3 a内病死。本研究也发现,在随访3 a内96例患者预后不良高达46.88%。可见,脑胶质瘤患者预后仍需积极改善,探索与其预后有关的指标十分必要。
肿瘤标志物(CEA、CA153、CA125等)是反映肿瘤患病风险、病情程度的重要指标,在评估部分恶性肿瘤中敏感度较高,其水平升高常反映肿瘤患病风险升高,但在预测肿瘤治疗预后中仍缺乏一定有效证据,临床应用具有一定局限性。VEGF可促血管生成,影响组织供血,直接影响肿瘤组织血运,进而影响肿瘤生长[10];IGF-1与胰岛素具有类似作用,在恶性肿瘤发病机制中,可作为细胞增殖、分化的调节剂,与恶性肿瘤预后具有一定关系[11]。本研究通过观察血清VEGF、IGF-1脑胶质瘤中的表达发现,预后不良组血清VEGF、IGF-1表达相对更高,进一步分析提示,脑胶质瘤患者预后不良与血清VEGF、IGF-1过表达与有关。
目前认为血清VEGF、IGF-1通过以下机制参与恶性肿瘤病情进展:VEGF主要通过促进血管内皮细胞增生和血管生成,增加瘤体的血流灌注,有助于肿瘤细胞生长和分裂,导致肿瘤病情进展[12];若手术未能彻底切除全部组织,VEGF可促进残留组织血管内皮增生,再次为肿瘤提供供血渠道,导致病情复发,进而影响手术治疗效果,增加病死风险[13]。此外,VEGF过表达还可增加血管通透性,利于肿瘤细胞侵袭和迁移,进而增加肿瘤转移风险,增加病死率[14]。有研究显示,VEGF为低氧诱导因子(hypoxia inducible factor-1α,HIF-1α)的下游靶向基因,HIF-1α可在低氧环境下诱导多种基因表达,促进肿瘤细胞浸润和转移;VEGF在转录过程中受HIF-1α调控,可促进低氧环境下肿瘤新生血管生长,加快肿瘤生长[15]。可见,血清VEGF过表达可加快肿瘤生长,增加肿瘤转移风险,进而增加预后不良风险。IGF-1与其受体IGF-1R结合后可促使层黏蛋白组织纤维分离,使得肿瘤细胞脱离原发病灶,导致肿瘤细胞转移,加重患者病情,进而增加病死风险[16]。相关研究显示,IGF-1过表达可增强肿瘤细胞信号通路的激活速度,利于肿瘤细胞繁殖、扩散[17]。另有研究指出,IGF-1可增加肿瘤细胞内VEGF水平,利于改善肿瘤血运,加快肿瘤生长[18]。总结上述研究认为,血清IGF-1对于脑胶质瘤生长和转移发挥促进作用,对患者预后造成影响。
为进一步明确血清VEGF、IGF-1在脑胶质瘤中的应用价值,本次研究最后绘制ROC曲线,证实血清VEGF、IGF-1能够预测脑胶质瘤患者预后不良风险。对此,建议临床可于术前检测血清VEGF、IGF-1水平,根据二者水平变化评估患者预后,同时以VEGF、IGF-1为治疗靶点之一,抑制肿瘤生长、转移,以降低病死率,改善患者预后。
综上所述,血清VEGF、IGF-1过表达与脑胶质瘤患者手术治疗预后不良有关,术前检验血清VEGF、IGF-1水平可预测脑胶质瘤患者预后不良风险,临床可定期检测VEGF、IGF-1水平变化,并行对应治疗措施改善二者血清表达量,利于延缓肿瘤生长,改善患者预后。
