荧光PCR熔解曲线法检测结核分枝杆菌对利福平和异烟肼耐药性的价值
2022-12-28胡琴琴张金花宋克玉肖圆圆陈芳芳施旭东
胡琴琴,张金花,宋克玉,许 坦,肖圆圆,陈芳芳,施旭东
利福平(RFP)和异烟肼(INH)是治疗结核病的一线药物,然而近年来,结核分枝杆菌(MTB)对这些药物的耐药现象较为严重[1]。因此,针对RFP和INH的耐药性检测已成为制定结核病临床治疗方案中不可或缺的依据。由于MTB生长缓慢,基于培养和药物敏感性试验(简称“药敏试验”)的传统耐药性检测方法至少需要6~8周才能得到结果,极易延误诊断和病情。分子药敏试验技术的发展克服了传统表型药敏试验耗时较长的缺点[2]。其中,荧光PCR熔解曲线法是通过监测针对特定耐药基因设计的荧光标记探针在PCR扩增完成后的熔解曲线分析过程中是否发生熔点变化来判断探针覆盖区域是否发生基因突变,是目前快速检测MTB耐药性的新型分子生物学方法之一[3]。本研究对2018年1月至2021年3月在南京市公共卫生医疗中心经绝对浓度法药敏试验和荧光PCR熔解曲线法两种方法确诊的结核病患者进行分析,探讨荧光PCR熔解曲线法检测MTB对RFP和INH耐药性的临床价值,分析RFP和INH耐药相关基因突变分布情况。
1 材料与方法
1.1 样本来源 本研究纳入的780株结核分枝杆菌分离自2018年1月至2021年3月南京市公共卫生医疗中心就诊的培养阳性的结核病患者,收集其基本资料,其中男性543例,女性237例,年龄5~92岁,平均(48.0±19.1)岁。
1.2 方 法
1.2.1 标本前处理 痰标本用4% NaOH消化液处理,15 min后加入磷酸盐缓冲液(PBS)至40 mL并混匀,4 ℃离心20 min,弃上清液,沉淀物加入0.5 mL PBS振荡重悬。
1.2.2 结核分枝杆菌培养 参照《结核病实验室检验规程》[4]吸取消化后的痰液约0.5 mL悬浮液加到MGIT培养管中,充分混匀后放入BACTEC MGIT 960液体培养系统,仪器报阳后取菌液进行萋-尼抗酸染色,以确定是否为抗酸杆菌。TCH培养基上生长、PNB培养基上不生长确认为初筛结核分枝杆菌。
1.2.3 药敏试验 根据《结核病实验室检验规程》对结核分枝杆菌菌株进行RFP、INH耐药性检测,用结核分枝杆菌H37 Rv作为敏感对照进行质量控制。以不含药对照管生长,含药高、低浓度管均不生长为敏感;低浓度管生长、高浓度管不生长为低度耐药;高、低浓度管均生长为高度耐药。本研究中“耐药”包括低度和高度耐药。RFP药敏培养基的浓度为50 μg/mL(低浓度)和250 μg/mL(高浓度),INH药敏培养基的浓度为1 μg/mL(低浓度)和10 μg/mL(高浓度)。
1.2.4 熔解曲线法耐药基因检测 经鉴定为MTB的菌株采用荧光PCR熔解曲线法进行耐药基因突变检测。检测RFP耐药性决定区rpoB基因和INH耐药相关基因katG315密码子、inhA启动子区(-17~-8位点)、ahpC启动子区(-44~-30以及-15~3位点)、inhA94密码子是否含有突变来确定耐药性。检测试剂盒由厦门致善生物科技股份有限公司提供,实验操作步骤严格按照试剂盒说明书进行。
1.3 统计学分析 采用SPSS 19.0软件对数据进行统计分析。以绝对浓度法为标准,计算荧光PCR熔解曲线法检测结核分枝杆菌耐药性的灵敏度、特异度、符合率,并进行一致性分析(Kappa检验)。Kappa值在0~0.20为极低一致,Kappa值在0.21~0.40为一般一致,Kappa值在0.41~0.60为中等一致,Kappa值在0.61~0.80为基本一致,Kappa值在0.81~1.00为几乎完全一致。
2 结 果
2.1 结核分枝杆菌耐药特征 780株结核分枝杆菌临床分离菌株的表型耐药结果为:耐药菌株227株,总耐药率29.10%(227/780),其中RFP总耐药率21.15%(165/780),RFP单耐药率2.82%(22/780);INH总耐药率26.28%(205/780),INH单耐药率7.95%(62/780);耐多药(利福平和异烟肼同时耐药)结核菌143株,耐多药率18.33%(143/780);分子耐药结果为:耐药菌株235株,总耐药率30.13%(235/780),其中RFP总耐药率24.49%(191/780),RFP单耐药率5.64%(44/780);INH总耐药率24.49%(191/780),INH单耐药率5.64%(44/780);耐多药结核菌147株,耐多药率18.85%(147/780),见表1。54株结核分枝杆菌的表型药敏结果为RFP中度耐药,其中3株RFP分子药敏结果敏感;178株结核分枝杆菌的表型药敏结果为INH中度耐药,其中26株INH分子药敏结果敏感。
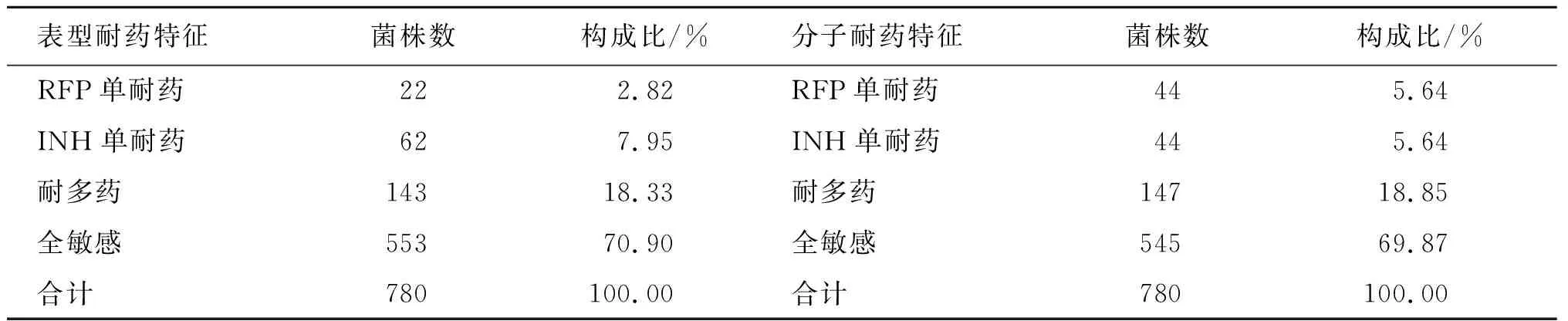
表1 结核分枝杆菌的耐药特征Tab.1 Resistance characteristics of Mycobacterium tuberculosis
2.2 熔解曲线法的检测效能 以绝对浓度法药敏试验检测结果为参考标准,熔解曲线法检测RFP耐药性的敏感度、特异度和符合率分别为98.18%、95.28%和95.90%,一致性分析为几乎完全一致(Kappa=0.88);检测INH耐药性的敏感度、特异度和符合率分别为85.85%、97.39%和94.36%,一致性分析为几乎完全一致(Kappa=0.85),见表2。

表2 熔解曲线法检测MTB对INH、RFP耐药性的效能Tab.2 Effectiveness of the melting curve method in detecting the resistance of Mycobacterium tuberculosis to rifampicin and isoniazid
灵敏度(%)=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度(%)=真阴性例数/(真阴性例数+假阳性例数)×100%;符合率 (%)=(真阳性例数+真阴性例数)/(真阳性例数+假阳性例数+真阴性例数+假阴性例数)×100%
2.3 结核分枝杆菌耐药相关基因突变分布
2.3.1 RFP耐药相关基因突变分布 191株RFP分子耐药菌株中全部检测出rpoB基因耐药相关位点突变,耐药突变以单位点突变为主(90.58%,173/191),其中rpoB529~533位点为最常见的突变(63.87%,122/191),其次是rpoB507~512位点(10.47,20/191);rpoB基因双位点突变出现的频率为9.42(18/191)。单位点突变的173株菌株中有144株表型耐药,其中突变位点为rpoB507~512的20株菌株中只有7株表型耐药,rpoB基因双位点突变的18株菌株全部表型耐药,见表3。
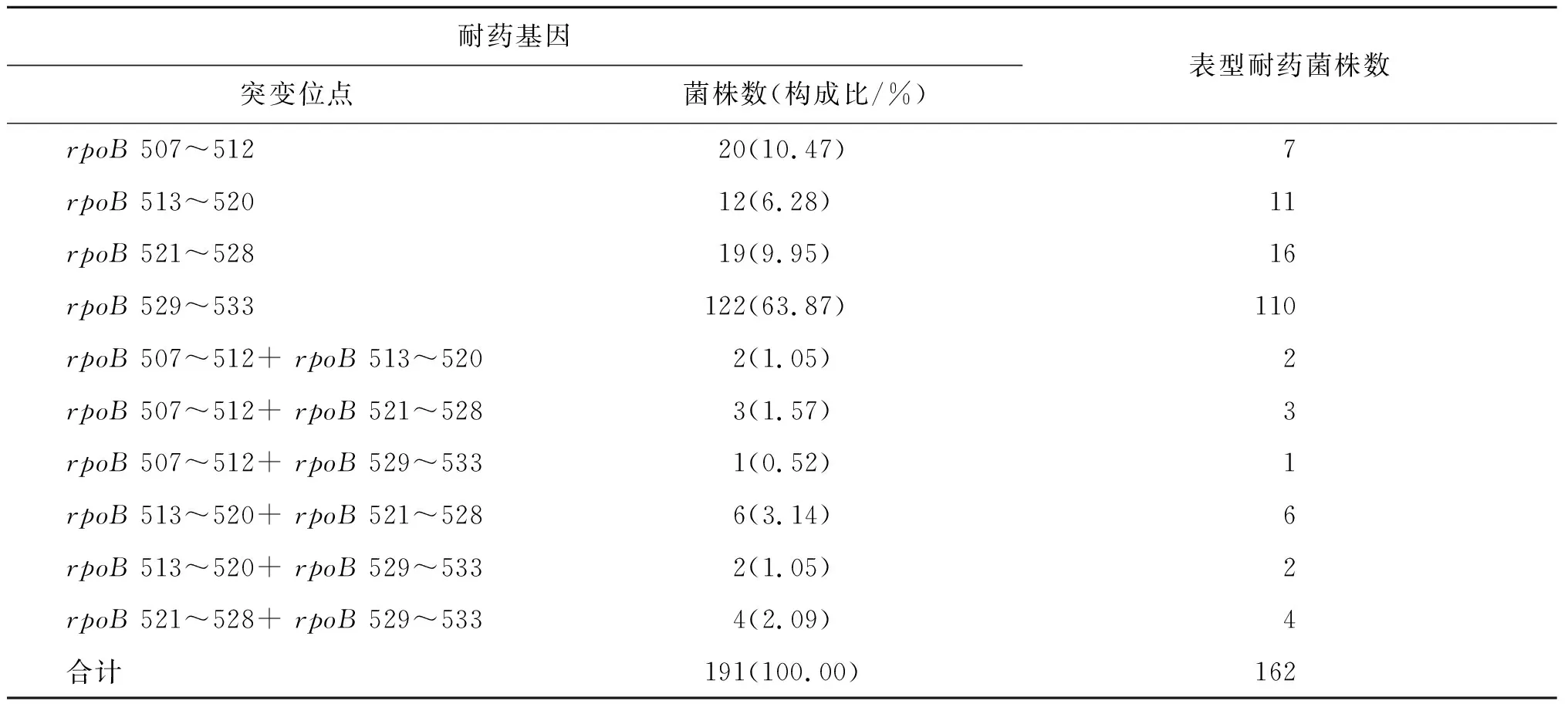
表3 RFP耐药相关基因突变分布情况Tab.3 Distribution of RFP drug resistance associated gene mutations
2.3.2 INH耐药相关基因突变分布 单位INH分子耐药菌株中,以单位点突变为主(96.34%,184/191),其中katG315位点为最常见的突变(66.49%,127/191),其次是inhA启动子区(17.80%,34/191);双位点突变出现的频率为3.66%(7/191)。单位点突变的184株菌株中有171株(92.93%)表型耐药,双位点突变的7株菌株中有6株表型耐药,见表4。
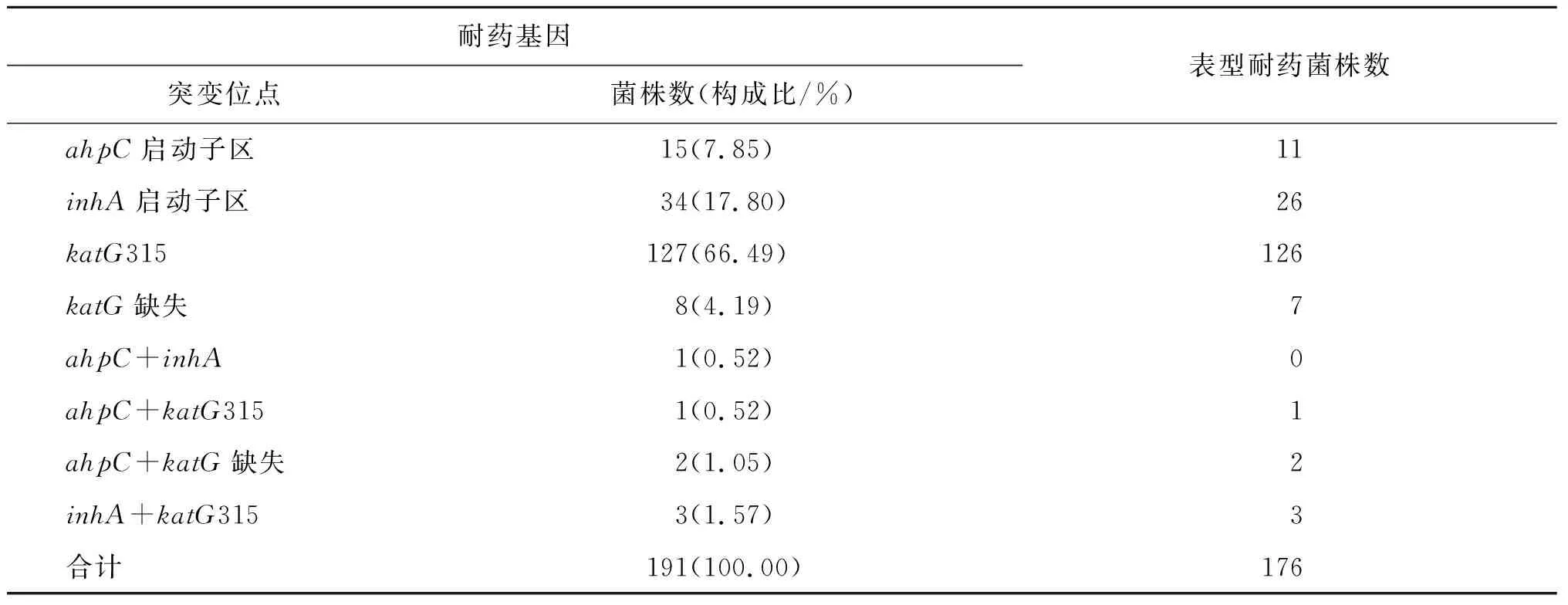
表4 INH耐药相关基因突变分布情况Tab.4 Distribution of INH drug resistance associated gene mutations
2.3.3 两种方法检测耐药性不一致的结果分析 在780株结核分枝杆菌中,32例药敏试验与熔解曲线法检测MTB对利福平的耐药性结果不一致。其中29例药敏试验检测结果为敏感而熔解曲线法检测到突变,具体为rpoB507~512位密码子突变13例,rpoB513~520位密码子突变1例,rpoB521~528位密码子突变3例,rpoB529~533位密码子突变12例;3例药敏试验检测结果为耐药而熔解曲线法检测结果为敏感。在780株结核分枝杆菌中,44例药敏试验与熔解曲线法检测INH对利福平的耐药性结果不一致。其中15例药敏试验检测结果为敏感而熔解曲线法检测到突变,具体为katG缺失1例,katG315突变1例,inhA启动子区突变8例,ahpC启动子区突变4例,inhA启动子区和ahpC启动子区均突变1例;29例药敏试验检测结果为耐药而熔解曲线法检测结果为敏感。
3 讨 论
目前,耐药结核病仍然是全球结核病控制工作所面临的严峻问题,我国也是耐药结核病高负担国家之一[5]。基于培养和药敏试验的传统耐药性检测方法,周期往往达到6~8周,不利于结核病的早期治疗和防控;荧光PCR熔解曲线法作为一种分子药敏试验技术,能够同时检测4种一线抗结核药物(包括利福平、异烟肼、乙胺丁醇和链霉素)的耐药情况,并具有灵敏度高、特异度强、简便快速、闭管检测等优点,已被广泛用于临床结核分枝杆菌耐药性的检测[6-9]。
本研究数据显示,结核的RFP耐药率(21.15%)、INH耐药率(26.28%)和耐多药率(18.33%)均低于2013(29%、35%和19%)和2014年(38%、28%和20%)本市水平[10-11],但远高于全国调查水平(9.63%、18.96%、6.85%)[12]。这些数据表明,随着抗结核治疗的日趋规范,结核病的耐药情况有所好转,但耐药形势依然严峻,仍需要重视用药前的耐药性检测,合理选择治疗方案。本研究中,结核病患者的年龄分布以中老年为主,男性多于女性,且更容易发生耐药,这可能与男性接触肺结核患者的机会更多,配合治疗的依从性差有关[13]。
以绝对浓度法药敏试验为标准,荧光PCR熔解曲线法检测结核分枝杆菌对RFP耐药性的灵敏度为98.18%,特异度为95.28%;检测结核分枝杆菌对INH耐药性的灵敏度为85.85%,特异度为97.39%;熔解曲线法与绝对浓度法药敏试验具有极好的一致性(Kappa值>0.81)。刘艳等[14]报道该方法检测结核分枝杆菌对RFP耐药性的灵敏度为95.83%,特异度为95.50,其灵敏度低于本研究,特异度与本研究结果相近,刘艳等研究只有135例标本纳入耐药性检测,敏感度的差异可能与样本量等因素有关;吴慧娜等[6]报道该方法检测结核分枝杆菌对INH耐药性的灵敏度为85.4%,特异度为96.4%,与本研究结果较为一致。
MTB耐药的主要机制是基因突变。本研究在191株RFP分子耐药的菌株中全部检测到了rpoB基因突变,表明rpoB基因突变是RFP耐药的主要机制,与以往的研究结果一致,本研究发现RFP耐药相关位点突变主要发生在rpoB529~533(63.87%)[15]。rpoB基因突变位点与RFP耐药的强弱程度有关,有研究报道rpoB基因513、526和531位点发生突变可以引起RFP高度耐药,而其他位点的突变仅导致低度耐药[16]。本研究发现突变位点为rpoB507~512的20株菌株中只有7株表型耐药,推测药敏试验敏感的某些菌株可能已经出现了RFP低度耐药,由此可以解释药敏试验敏感而熔解曲线法耐药的情况,熔解曲线法检测rpoB507~512位点突变可以发现此类菌株,弥补药敏试验的局限性;另外本研究发现,rpoB基因双位点突变18株菌株全部表型耐药。与RFP耐药机制相比,INH的耐药机制更为复杂,涉及多个基因,katG315密码子、inhA启动子区及ahpC启动子区的突变可覆盖90%以上的INH耐药菌株。本研究katG315的突变率为66.49%,与Zhang等[17]针对华东5省的研究结果相似(64.4%),而与王希江等[18]针对新疆地区的研究结果相差很大(81.37%),提示katG315突变可能存在地域上的差异。本研究中2株katG315突变或缺失菌株表型敏感,提示表型药敏试验虽然是当前耐药性检测的金标准,但仍存在局限性,对于一些低水平耐药的菌株存在漏检的情况。有研究表明katG315突变和katG缺失与较高浓度的INH耐药相关[19],由于本地区INH耐药主要由katG基因突变导致,因此对于INH耐药的患者不建议采用高剂量的INH治疗方案。某些标本表型药敏试验检测结果为耐药,而分子药敏试验检测结果为敏感,可能是由于标本中结核分枝杆菌含量较低导致核酸扩增及检测失败,导致将标本判定为敏感。
本研究尚存在一些不足之处,本研究检测表型药敏的方法为绝对浓度法药敏试验,将耐药结果分为高度耐药和低度耐药,但是其低浓度耐药的药物浓度较其他标型药敏方法稍高[9],对低水平耐药的菌株存在漏检,导致RFP表型耐药菌株低于分子耐药菌株。对于药敏试验耐药而熔解曲线法敏感的样本没有进行测序,无法进一步证实是否存在检测范围外的基因突变,是否存在基因突变外的耐药机制,尚需要进一步的研究来解决这些未知的基因突变和耐药机制。因此对于两种方法检测结果不一致的患者,任一方法提示对RFP和INH耐药,均要给予足够重视,结合临床进行综合判断。
综上所述,荧光PCR熔解曲线法作为一种简便快速的分子药敏试验技术,与传统药敏试验具有极好的一致性,弥补了药敏试验对于低度耐药突变检测的局限性。耐药相关基因突变位点的检测对于结核病的及时诊断,规范的实施个体化治疗,以及控制结核的流行具有很大的意义。
利益冲突:无
