河南省人源产ESBLs鼠伤寒沙门菌单相变异株的分子特征研究
2022-12-28穆玉姣宋威蓉张白帆赵嘉咏马红霞黄学勇郭万申
穆玉姣,宋威蓉,胡 晓,张白帆,赵嘉咏,马红霞,黄学勇,郭万申
近年来鼠伤寒沙门菌单相变异株(S.1,4,[5],12:i: -)在多个国家的检出呈现大幅度的增加,并导致多次疫情在不同地区发生[1],其是鼠伤寒沙门菌(S.1,4,[5],12:i:1,2)的Ⅱ相鞭毛抗原缺失的单相变异菌,已在动物、食品及人类粪便、血液中分离发现。在抗生素的选择压力下,细菌的耐药性已成为严重的公共卫生问题。产超广谱β-内酰胺酶(extened-spectrum β-lactamases,ESBLs)可水解灭活青霉素类、头孢菌素和单环酰胺类抗生素的β内酰胺酶,接合性质粒介导其在同种或不同种属细菌之间转移、传播被认为是多重耐药基因传播的重要机制之一[2],可以导致耐药菌株在局部大规模爆发。目前对ESBLs的分析报道多以分离自血液、引流液、尿液中分离的大肠埃希氏菌、肺炎克雷伯菌等为主[3-4],对来源于腹泻病人粪便中的沙门菌研究较少,特别是鼠伤寒沙门菌单相变异株。鼠伤寒沙门菌变异株在进化过程中产生了严重的多重耐药现象,对主要抗菌药物氨苄西林、氯霉素、卡那霉素、庆大霉毒、四环素、新诺明等表现不同的敏感性,产生泛耐药和多重耐药。本研究从腹泻病人粪便中分离产ESBLs 的鼠伤寒沙门菌单相变异株沙门菌进行分子特征研究,为预防和控制耐药菌的产生和耐药基因的传播提供实验室参考依据。
1 材料与方法
1.1 菌株来源 河南省腹泻监测点从2008-2017年患者粪便标本中分离的124株1,4,[5],12:i:-沙门菌,药敏质控菌株大肠埃希氏菌ATCC 25922和肺炎克雷伯杆菌 ATCC 700603,沙门菌标准菌株H9812为本实验室保存,接合受体菌大肠埃希氏菌J53(叠氮钠耐药)由中国疾病预防控制中心惠赠。
1.2 主要试剂 药物敏感鉴定板(上海星佰公司),叠氮钠和头孢噻肟(北京Solarbio公司),LB肉汤、MH琼脂和MAC琼脂(北京陆桥),引物合成(上海生工),2×Taq PCR MasterMix和细菌DNA提取试剂盒(大连宝生物),Seakem Glod琼脂糖(美国LONZA公司),蛋白酶K(英国Roche公司),限制性内切酶XbaI(大连宝生物公司),1 M Tris-HC1/EDTA/5XTBE(北京solarbio公司)。
1.3 主要仪器 PCR扩增仪(美国Bio rad公司)、去离子水系统(美国Milipore公司)、SHZ-C型水浴摇床(上海博迅仪器)、三温水浴锅(北京东方精瑞)、Minispin台式离心机(德国Eppendorf)、Vitek2 Compact全自动微生物鉴定仪(法国梅里埃公司)、脉冲场凝胶电泳系统(美国Bio-Rad公司)、凝胶成像系统(美国Bio-Rad公司)
1.4 方 法
1.4.1 耐药表型及基因型特征性分析 1)最低抑菌浓度(MIC)测定方法:采用美国临床实验室标准化委员会CLSI推荐的肉汤稀释法测试124株1,4,[5],12:i:-沙门菌的最小抑菌浓度,根据药敏试验执行标准选择7类11种抗生素:β内酰胺类(氨苄西林AMP、头孢噻肟CTX、头孢他啶CAZ、亚胺培南IMI)、氨基糖苷类(庆大霉素GEN)、氯霉素类(氯霉素CHL)、四环素类(四环素TET)、喹诺酮类(环丙沙星CIP、萘啶酸NAL)、多肽类(多粘菌素PB)、叶酸途径抑制剂(复方新诺明SXT)。2)产ESBLs的菌株筛选: CLSI筛选和确认ESBLs的标准进行判断。3)ESBLs基因型检测:PCR扩增ESBLs四种耐药基因[5](SHV、OXA、TEM、CTX-M)型别,其中CTX-M型阳性的菌株,再分别扩增CTX-M组特异引物。PCR阳性菌株送上海生工测序、结果比对,确定基因型。
1.4.2 产ESBLs沙门菌分子特征分析 按照Pulsenet China网络实验室公布的沙门菌脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)标准分型方法,对产ESBLs菌株进行分子分型,沙门菌标准株H9812作为分子量标记。限制性内切酶XbaI(50 U),37 ℃酶切2 h。电泳参数:电压6 V/cm,脉冲时间2.2~63.8 s,线性转换,电场角度120°,电泳时间19 h,电泳液温度14 ℃。电泳结束后胶块用GelRed染料染色20 min后纯水清洗30 min后凝胶成像仪拍照(曝光时间3.0 s,去过饱和成像)。
1.4.3 产ESBLs沙门菌接合转移试验 使用肉汤接合法[6],将供体菌(产ESBLs沙门菌)和受体菌(J53)分别于5 mL LB肉汤中37 ℃过夜培养,各取1 mL,10 000×g离心1 min,弃上清液,加入新鲜LB肉汤混匀后再次10 000×g离心1 min,弃上清液,加入1 mL LB肉汤混匀后,将两者混合,37 ℃过夜培养。次日将稀释后的结合液涂布于加有100 μg/mL叠氮钠和4 μg/mL头孢噻肟的麦康凯平板上,37 ℃过夜培养进行筛选,次日挑取单个红色菌落, 37 ℃孵育18 h后,系统生化鉴定并采用通过PCR方法进行CTX-M基因检测,筛选CTX-M基因阳性接合子,依次进行药敏试验、PFGE。
1.5 数据分析 用凝胶分析聚类软件BioNumerics 6.0对PFGE结果进行分析,树状图和相关性由UPGMA聚类分析和Dice相似性系数推算而得。条带位置差异容许度选择1.5%,优化值选择1.5%。Dice系数(F×100%,F value×100%)来衡量PFGE带型之间的相似度。
2 结 果
2.1 基本情况 124株1,4,[5],12:i:-沙门菌中,男女性别比为1.64(77/47),其中51.61%(64/124)为1岁以下婴幼儿,28.23%(35/124)为1~2岁幼儿。农村地区检出率 (%) 高于城市地区 (%)。见表1。
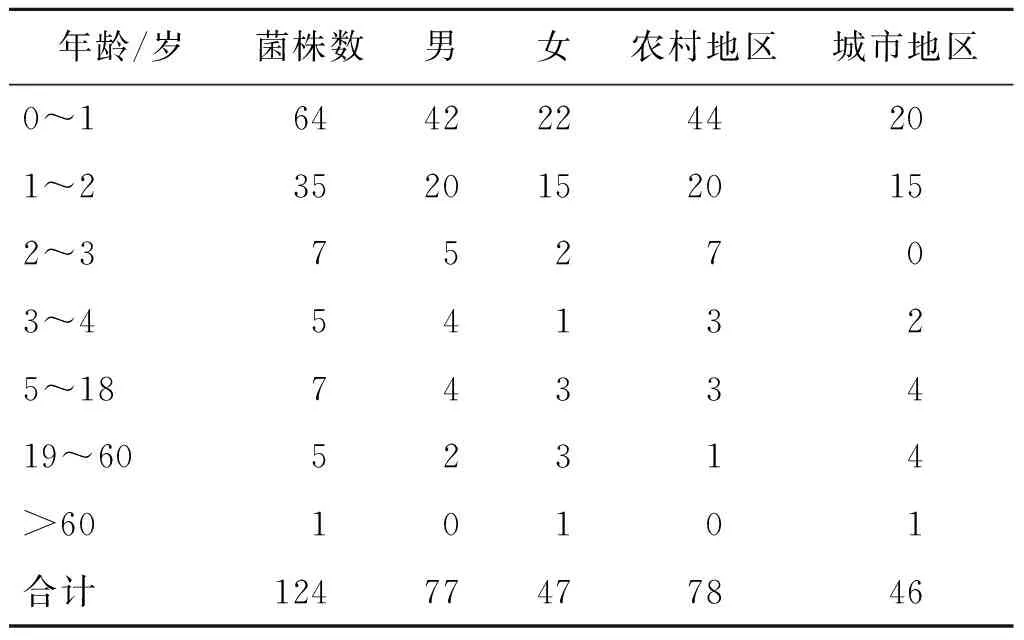
表1 124株人源1,4,[5],12:i:-沙门菌菌株信息Tab.1 Information on 124 strains from human of S.1,4, [5], 12: i: -
2.1 耐药表型 124株1,4,[5],12:i:-沙门菌株中,除对亚胺培南和多粘菌素B外均有不同程度的耐药(图1),其中对氨苄西林和四环素耐药率最高,分别为90.32%(112/124)和97.58%(121/124);其次为氯霉素61.29%(76/124)、萘啶酸58.87%(73/124)和复方新诺明52.42%(65/124);但对三代头孢类和喹诺酮类抗生素较敏感。92.74%(115/124)的菌株同时对三类以上的抗生素耐药,为多重耐药菌株。
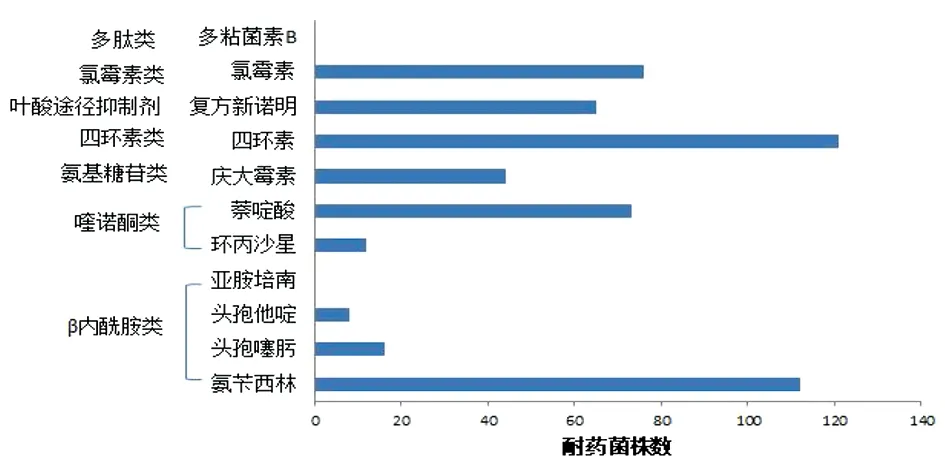
图1 124株1,4,[5],12:i:-沙门菌的药物敏感试验结果Fig.1 Drug suseptibility test results of 124 strains of S.1,4, [5], 12: i: -
2.2 产ESBLs沙门菌株的筛选 124株1,4,[5],12:i:-沙门菌株中有16株对头孢噻肟耐药,耐药率为12.90%;9株对头孢他啶耐药,耐药率为7.26%。ESBLs菌株确证试验验证了16株头孢噻肟耐药菌均为产ESBLs菌株。16株产ESBLs菌株对IMI、PB全部敏感,对剩余的8种抗生素均有不同程度的耐药,其中对AMP、TET、CHL全部耐药(图2)。16株产ESBLs菌株均为多重耐药菌,其中1株(6.25%)对五类抗生素耐药,6株(37.5%)对6类抗生素耐药,9株(56.25%)对7类抗生素耐药。
2.3 产ESBLs菌株的耐药基因型 四种型别耐药基因PCR结果显示(图2),16株产ESBLs 1,4,[5],12:i:-沙门菌均携带CTX-M型耐药基因,其中3株同时携带OXA型,9株同时携带TEM型,22株同时携带OXA型和TEM型,2株未携带OXA型和TEM型;本研究未检测出携带SHV型的菌株。见图2。经测序对比结果显示, TEM基因均为TEM-1型, OXA均为OXA-1型。扩增CTX-M组特异引物,经测序对比后,CTX-M型菌株中12株为CTX-M-1组(4株CTX-M-15型和8株CTX-M-55),4株为CTX-M-9组(4株CTX-M-14型)。
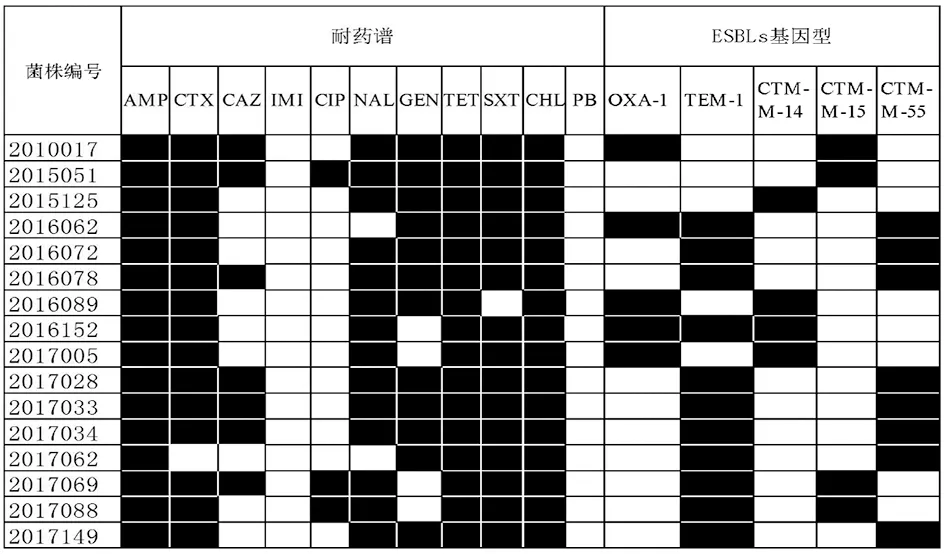
图2 16株产ESBLs 1,4,[5],12:i:-沙门菌耐药表型及ESBLs基因型结果Fig.2 Drug resistance phenotype and ESBL genotype results of 16 strains of S.1,4, [5], 12:i: - producing ESBLs
2.4 产ESBLs菌株间亲缘关系分析 PFGE分析结果如图3,通过BioNumerics6.0指纹图谱分析软件对PFGE结果进行聚类分析,16株产ESBLs 1,4,[5],12:i:-沙门菌经XbaⅠ酶切后共分为14种带型(Dice,positiontolence1.5%),分别命名为TH1-TH14。结果显示绝大多数菌株在基因图谱上分布在不同的遗传分支上,亲缘关系较远,没有绝对优势的PFGE图谱,仅有两株菌PFGE图谱具有100%同源性,其余带型各仅包含1株菌,相似度在52%~97%,无明显的优势带型。此外, 带型也无明显的地域、时间、聚集特征。

图3 16株产ESBLs1,4,[5],12:i:-沙门菌PFGE聚类分析Fig.3 PFGE cluster analysis of 16 strains of S.1,4, [5], 12: i: - producing ESBLs
2.5 产ESBLs沙门菌接合转移试验 16株ESBLs 1,4,[5],12:i:-沙门菌中有9株与大肠埃希菌J53接合后在筛选MAC平板上(100 μg/mL叠氮钠+4 μg/mL头孢噻肟)有红色菌落生长,经Vitek2 Compact全自动微生物鉴定仪鉴定为大肠埃希菌。接合子药敏结果显示9株菌成功的发生了β-内酰胺酶类药物耐药性接合转移,除头孢他啶、环丙沙星、萘啶酸和庆大霉素外,细菌对氯霉素、四环素、多粘菌素、复方新诺明都具有耐药性,说明这些耐药基因可以与CTX-M在一个质粒上发生共转移。PFGE结果显示接合成功的9株接合子的PFGE分型与受体菌(J53)一致而与供体菌不同。提取接合子菌DNA进行CTX-M基因PCR验证,接合子获得了与供体菌株一致的CTX-M基因。
3 讨 论
近年来,有关鼠伤寒沙门菌单相变异株(1,4,[5],12:i:-沙门菌)的文献报道越来越多,由其引起的感染比例大幅上升,其已成为一种非常重要的沙门氏菌血清型。随着抗生素的广泛使用,抗生素耐药菌株在临床分离菌株中所占比例不断增加,给临床抗感染治疗造成了巨大的困扰。本药敏研究结果发现,分离菌株对临床治疗传统药物广谱青霉素、氯霉素、磺胺类和四环素类抗生素均产生了一定的耐药性,对三代头孢类和三代喹诺酮类抗生素敏感性较强,这和栗薇薇[7]、许云敏[8]等报道一致。但随着第三代头孢菌素的广泛使用,出现了一类能够水解第三代、甚至第四代头孢菌素超广谱β-内酰胺酶(ESBLs),产ESBLs的沙门菌通常把抗生素耐药质粒、整合子和转座子携带的可转移元件作为抗生素耐药性传递的供体,参与发病机制的某些ESBLs基因通常与这些抗生素耐药基因元件一起转移,将编码基因ESBLs转移到细菌宿主的基因组或质粒中促进了更具毒性和耐药性的分离株的出现[9],并因此导致更难以治疗的感染。
本研究主要从我省腹泻病人中分离产ESBLs多重耐药1,4,[5],12:i:-沙门菌进行分析,通过药敏试验确定了16株ESBLs1,4,[5],12:i:-沙门菌。产ESBLs基因型主要有5种,包括 TEM、SHV、OXA、CTX-M 和其他型,沙门菌中以广谱青霉素酶 (TEM) 为最常见, 但近几年以很多地区以 CTX-M 型为主[10], CTX-M可水解三代头孢类药物。目前,CTX-M 型ESBLs 已发现 130多种亚型,根据其氨基酸序列的同源性可分为5组[11]:CTX-M-1组,CTX-M-2组,CTX-M-8组,CTX-M-9组和CTX-M-25组,上述不同组之间同源性≤90%。本次研究中共检测到OXA、TEM和CTX-M 3种ESBLs基因型,CTX-M型检出最多(100%),共发现3种型别:blaCTX-M-55、blaCTX-M-14和blaCTX-M-15,均属于CTX-M-1组和CTX-M-9组。有研究显示[12-14]CTX-M-14型和CTX-M-15型是许多地区腹泻沙门菌携带CTX-M的主要耐药基因,但本研究检出的耐药基因以blaCTX-M-55(50.0%)为主,其次是blaCTX-M-14(37.5%)。此外,blaTEM、blaOXA的阳性率分别为68.75%和31.25%,经测序对比结果显示,blaTEM均为TEM-1型,blaOXA均为OXA-1型。
PFGE作为一种有效的分子分型方法,可以用于分析菌株之间的相关性,被广泛应用于多种细菌的分子流行病学研究中,在疫情控制和溯源中发挥着重要方面。16株产ESBLs 1,4,[5],12:i:-沙门菌经XbaⅠ酶切后共分为14种带型,表现出相当大的多样性,无明显的优势带型,这表明我省产ESBLs 1,4,[5],12:i:-沙门菌在基因图谱分布在不同的遗传分支上,带型复杂,可能来自多个克隆群,多态性明显。较高的异质性和更多的克隆分布意味着更大的变异性和适应性,这说明携带主要流行亚型的blaCTX-M沙门菌遗传背景呈现多样性,并且耐药基因与基因分型无明显相关性,这也说明产ESBLs 1,4,[5],12:i:-沙门菌中不存在同一菌株的克隆传播,克隆传播可能不是其传播流行的主要方式。
本研究中,共有9株产ESBLs 1,4,[5],12:i:-沙门菌通过接合试验进行了blaCTX-M转移,说明耐药基因可通过质粒介导在不同细菌之间的进行水平传播,加重了耐药基因的扩散。对供体菌和接合子的药敏结果进行分析,供体菌除了携带ESBLs基因外,可能还携带其他耐药基因或元件,在接合试验中出现了非β-内酰胺类抗生素的耐药性与ESBLs表型共同转移现象,导致菌株的多重耐药。值得注意的是,同为β-内酰胺类抗生素的头孢他啶在接合试验后的MIC值呈下降状态,使的多株菌对头孢他啶的耐药表型由耐药或中介变为敏感,这可能与blaCTX-M基因编码的核苷酸序列有关,240位的赖氨酸或精氨酸活性集团与水解头孢他啶密切相关,而blaCTX-M缺少此类活性集团,因而对头孢他啶水解能力低下。但有研究证明[15]所获得的 CTX-M 的新型别中有64%的突变体对头孢他啶产生了抗药性,并且这些突变体一般都具有 A80V、P167S和D242G 的突变位点。头孢他啶可能会作为主要的选择压力,对 CTX-M型ESBLs分子进化路径产生较大的影响。
综上所述,河南省腹泻病人粪便中分离的产ESBLs 1,4,[5],12:i:-沙门菌与其携带的CTX-M 型耐药基因有关,并且编码该耐药基因的质粒可以通过接合转移在细菌之间进行水平传播。这提示我们应进一步开展此类耐药菌株的监测,为提高治疗有效率和阻止耐药菌株的产生和播散提供基础数据依据。
利益冲突:无
