化学链CO2部分脱氧热力学建模及载氧体性能评价
2022-12-27席嘉泽张韫炜王子宇
席嘉泽,王 坤,张韫炜,王子宇,薛 蒙
(1.东北大学 冶金学院,辽宁 沈阳 110819;2.东北大学 工业智能与系统优化国家级前沿科学中心,辽宁 沈阳 110819;3.山东钢铁股份有限公司,山东 济南 250101)
由化石燃料燃烧引起的CO2排放,被认为是导致全球变暖的主要因素[1]。碳捕获、利用与封存(Carbon capture, utilization and storage, CCUS)是减少CO2排放的关键技术之一[2-3]。但CCUS通常需要较高的CO2分离成本,且需要大量空间储存CO2[4]。近年来,将CO2作为碳源进行有效资源化利用受到了广泛关注[5-6]。其中,将CO2转化为CO用作费托合成的原料,并进一步转化为碳氢化合物燃料具有较好的工业应用前景[7]。但CO2分子结构高度稳定,如何高效地活化并分解CO2成为亟待解决的问题[8]。
化学链链式循环反应是指在一种固体中间媒介(载氧体)的促进下,将一个总化学反应分为多个独立的子反应,并分别在多个独立的反应器中进行的反应过程[9]。该类反应过程容易控制、产物容易分离且反应物转化效率高,载氧体还可发挥催化剂的作用。
将化学链技术应用于CO2资源化转化成为一种极具吸引力的研究方向[10-11]。QⅠU等[12]制备了三元尖晶石Cu0.4Co0.6Fe2O4载氧体,利用Cu对钴铁载氧体还原性的促进作用,实现了650 °C下CO2分解速率达 144.6 μmol/(g∙min),CO产率达 9100 μmol/g;SUN等[13]提出一种同步促进化学链CO2分解与生物质梯级利用的新工艺,Ca2Fe2O5载氧体表现出较高的氧化还原活性以及良好的循环耐久性;MAKⅠURA等[14]利用逆水煤气反应(RWGS)将CO2转化为CO,并以Co-Ⅰn2O3作为载氧体,该化学链反应体系相比传统催化体系,在较低的操作温度(450~550 °C)下,便现出了较高的CO2分解速率,且CO2转化率(约80%)远高于传统RWGS的平衡转化率。化学链CO2分解的关键在于选择具有优异性能的载氧体,即具有更高的载氧量、反应速率、化学稳定性、较低的成本和环境友好性等[15]。Fe、Nb、Cu、Mn、Ce和Co等金属的氧化物为化学链技术常用的载氧体[16-17]。目前,基于化学链技术的CO2还原反应研究尚未成熟,对适宜载氧体的研究较少,缺少一种通用的热力学评价方法来指导载氧体的开发。
针对上述问题,本文提出一种载氧体的通用热力学评价方法:建立化学链CO2部分脱氧(Chemical looping partial deoxidation, CLPD)生成CO的热力学模型;将CO2减排与CO制备相结合,基于反应吉布斯自由能变、化学平衡常数和最小化原理,筛选出高效、经济和环保的载氧体;进一步研究载氧体添加量、反应温度和反应压力对化学链反应系统性能的影响,优化操作参数。
1 热力学模型建立
CLPD生成CO的热力学模型如图1所示。CLPD分为两个独立的子反应,即CO2还原反应和载氧体再生反应,分别在还原反应器和再生反应器中进行。还原反应器中,在低价态金属氧化物载氧体的作用下,CO2部分脱氧为CO;再生反应器中,高价态载氧体被还原,形成氧空位以恢复其初始状态,并返回还原反应器中进入下一循环。金属氧化物在两个步骤之间起到运输氧的作用,在整个氧化还原过程中保持完整。本部分将建立CLPD模型,并给出载氧体选取以及操作参数优化的热力学方法。
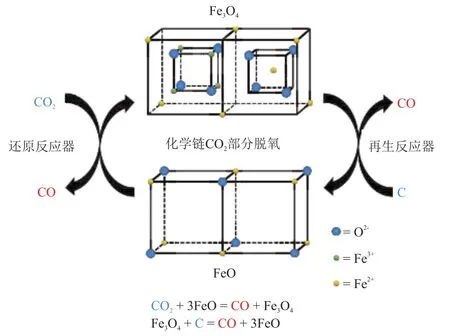
图1 化学链CO2部分脱氧Fig.1 Chemical looping CO2 partial deoxidation
1.1 选取载氧体的热力学方法
对CLPD过程的载氧体选取,从热力学吉布斯自由能变ΔG及化学平衡常数K两个角度进行分析[18]。当某一化学反应的吉布斯自由能变ΔG小于零且化学平衡常数K较大时,认为反应在该条件下可以自发进行。以此为依据选取载氧体。
吉布斯自由能(G,kJ/mol)通过式(1)计算[19]:
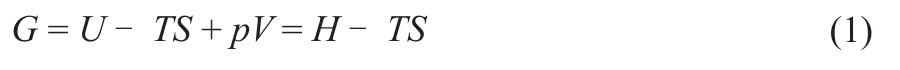
式中,U为系统的内能,kJ/mol;T为温度,K;S为熵,kJ/mol;p为压力,Pa;V为体积,m3;H为焓,kJ/mol。
由于CLPD过程涉及的化学反应均有气体参与,计算反应平衡常数时选择压力平衡常数Kp,其计算如式(2)和式(3)所示:
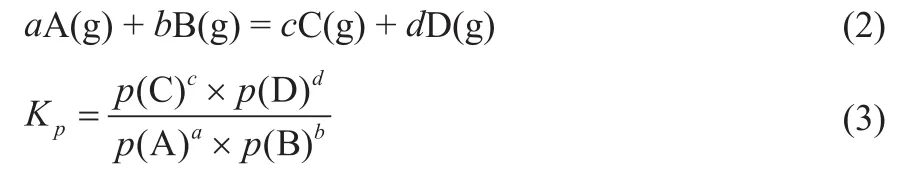
式中,p(A)、p(B)、p(C)和p(D)分别为组分A、B、C和D在反应中的平衡分压,Pa。
CO2还原过程可表示为:
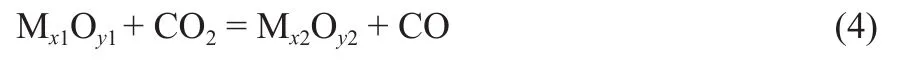
式中,M代表用作载氧体的金属元素。
将CO2和CO视为理想气体,则:

式中,pCO和pCO2分别为CO和CO2在反应中的平衡分压,Pa;R为气体常数,8.314 J/(mol∙K)。
将CLPD过程中载氧体再生过程设定为两种类型,第一种类型为CO2氧化后的载氧体发生分解反应,生成低价态载氧体和氧气,该过程为化学链空气分离制氧(Chemical looping air separation,CLAS)[20],定义该类型为直接再生反应;第二种类型为将CO2氧化后的载氧体与还原剂(燃料)发生化学链气化(Chemical looping gasification,CLG)[21]反应,生成低价态载氧体和还原气,定义该类型为间接再生反应。
其中直接再生反应可表示为:

将O2视为理想气体,则:
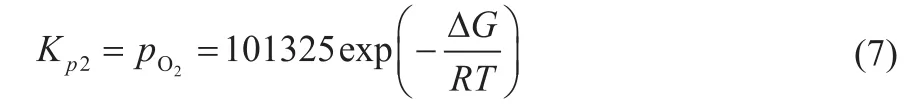
式中,pO2为O2在反应中的平衡分压,Pa。
而间接再生反应可表示为:

将CO视为理想气体,则:
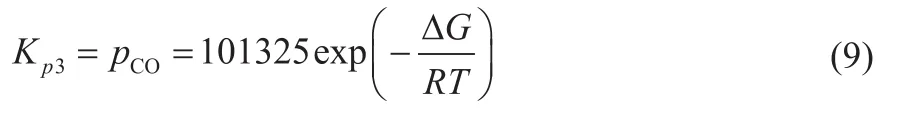
1.2 优化操作参数的热力学方法
基于吉布斯自由能最小化原理,可在不进行实验的情况下,获得化学反应产物的平衡组分,有效地模拟与优化影响平衡组分的操作变量[22]。
吉布斯自由能最小化原理与其平衡约束条件如式(10)和式(11)所示[23]:

式中,π、c代表一个有π个相、c个组分的多组分多相系统;nij、μij分别为在系统中某一物相j中某一物质i的物质的量与化学势,mol、kJ/mol。
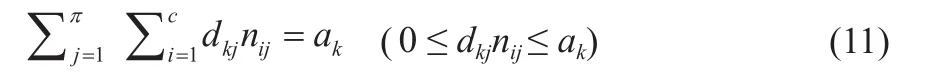
式中,dkj为组分i中元素k的原子数量;ak为系统中元素k的原子数量。
模拟中涉及的气体和固体物质分别为:C、CO、CO2、Fe、FeO、Fe2O3、Fe3O4、Fe3C、FeCO3、Fe(CO)5、Fe2(CO)9、Fe3(CO)12和O2。为了获得CLPD的最佳操作参数,本文定义了4个评价指标,分别用于还原反应器及再生反应器系统的性能分析。
CLPD中的CO2转化率(α,%)和CO产率(γ,%)如式(12)和式(13)所示:


式中,Δn(CO2)为反应中被转化的CO2物质的量,mol;n0(CO2)为反应前CO2物质的量,mol;n(CO)为反应达到平衡时所生成CO物质的量,mol。
载氧体再生过程,载氧体再生程度(β,%)和单质碳气化程度(δ,%)分别如式(14)和式(15)所示:

式中,n(FeO)为反应达到平衡时FeO物质的量,mol;n0(Fe3O4)为反应前Fe3O4物质的量,mol;n(CO)为反应达到平衡时所生成CO物质的量,mol;n0(C)为反应前单质碳物质的量,mol。
2 载氧体选取研究
2.1 CO2还原过程分析
依据上文载氧体选取所采用的热力学原理,将金属氧化物中金属元素的化学价态,及还原反应中载氧体发生的氧化反应作为限制条件,对CO2还原过程进行分析。针对几种常用于载氧体的金属元素(Fe、Mn、Co、Cu、Nb和Ce),其所有可能的氧化物形式,及其与CO2发生还原反应(T= 1123 K)的化学反应式如下所示[8,24]。
铁氧化物载氧体:

锰氧化物载氧体:
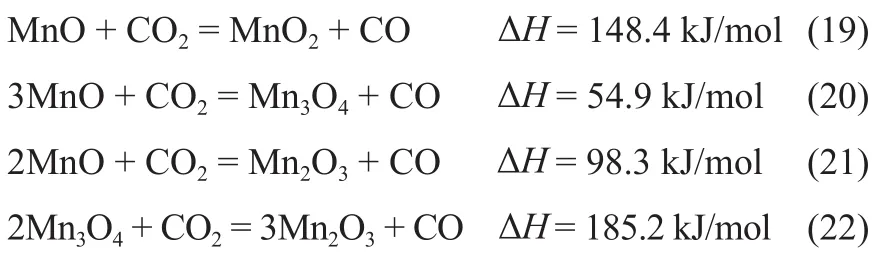
钴氧化物载氧体:
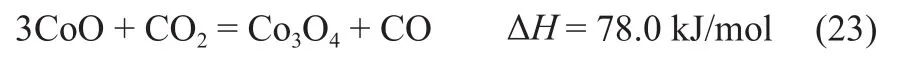
铜氧化物载氧体:

铌氧化物载氧体:
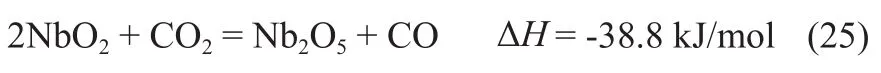
铈氧化物载氧体:

在标准状态下,计算了对应的金属氧化物与CO2发生还原反应时,吉布斯自由能变∆G和化学平衡常数K随温度的变化趋势,如图2所示。由图2(a)可知,在一定的温度范围内,FeO/Fe3O4、Ce2O3/CeO2和NbO2/Nb2O5体系还原反应的∆G小于零,且随温度升高FeO/Fe3O4和Ce2O3/CeO2体系的∆G逐渐增大,而NbO2/Nb2O5体系的∆G逐渐减小,说明高温有利于Nb基载氧体的CO2还原[25]。由图2(b)可知,上述3种载氧体还原反应的化学平衡常数K相比较大。所以,金属元素Fe、Nb和Ce适合用于CLPD流程还原反应的载氧体。
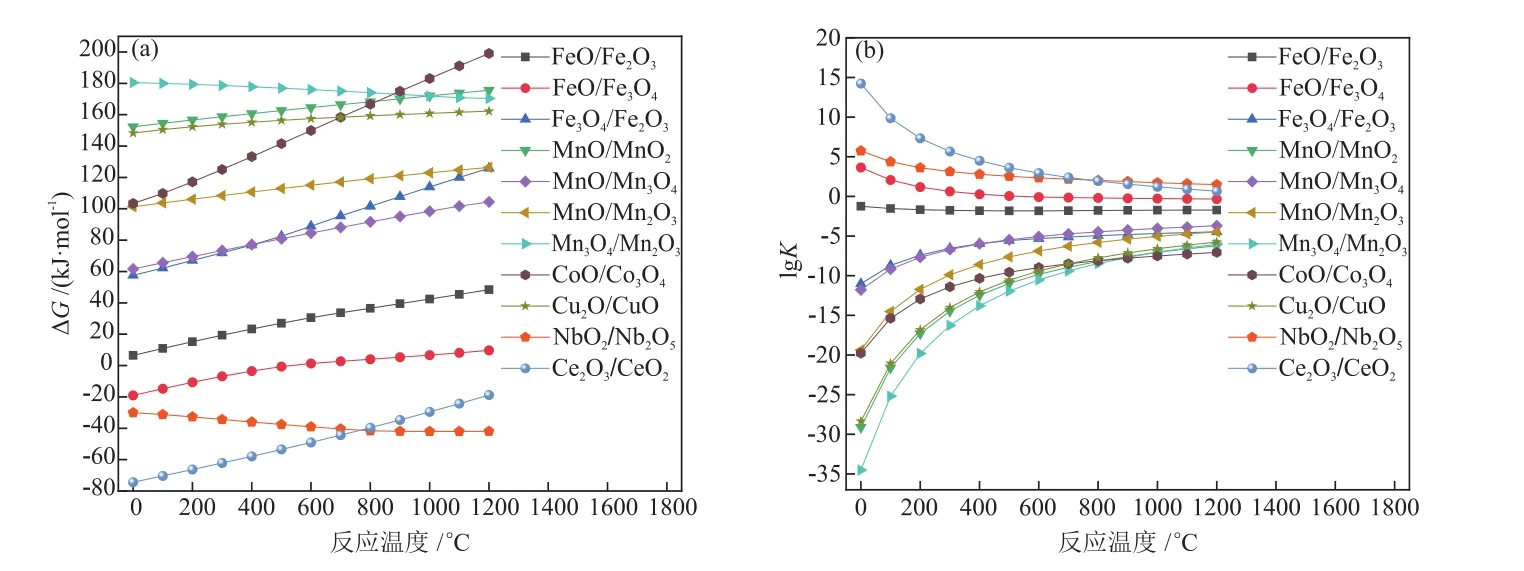
图2 还原反应中不同载氧体作用下∆G与K随反应温度的变化Fig.2 Changes of ∆G and K with reaction temperature under different oxygen carriers in reduction reaction
2.2 载氧体再生过程分析
结合CLPD流程载氧体还原反应所得结论,针对Fe、Nb和Ce 3种元素的金属氧化物,按照直接再生反应机制,其载氧体再生过程(T= 1123 K)的化学反应式分别如下所示。
铁氧化物载氧体:

铌氧化物载氧体:
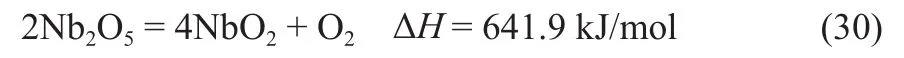
铈氧化物载氧体:
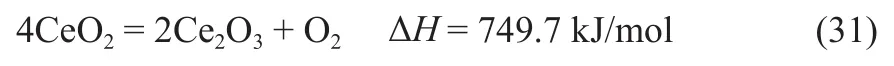
在标准压力下,计算得到不同金属氧化物载氧体发生直接再生反应的吉布斯自由能变∆G和化学平衡常数K随温度的变化趋势,如图3所示。由图3(a)和3(b)可知,在研究的温度范围内,以上几种载氧体直接再生反应的∆G均大于零,且化学平衡常数K均较小,相关的直接再生反应均不能自发进行,故第一种类型的再生反应不可行。

图3 直接再生反应中不同载氧体作用下反应∆G与K随反应温度的变化Fig.3 Changes of ∆G and K with reaction temperature under different oxygen carriers in direct regeneration reaction
第二种类型的再生反应为间接再生反应,通过向再生反应中加入还原剂,进行化学链气化反应,从而促使再生反应在研究的温度范围内可以自发进行。考虑CLPD产物为CO,本研究选择单质碳作为再生反应的还原剂,对应的金属载氧体再生反应式(T= 1123 K)如下。
铁氧化物载氧体:
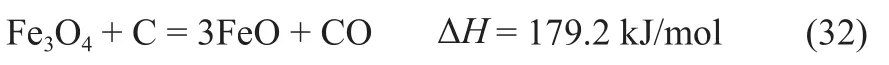
铌氧化物载氧体:
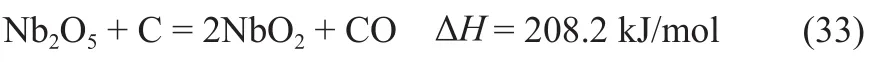
铈氧化物载氧体:

加入单质碳后,3种金属氧化物载氧体再生反应的吉布斯自由能变∆G和化学平衡常数K随温度的变化趋势,如图4所示。由图4可知,在一定的温度范围内,3种金属载氧体再生反应的∆G均小于零。从反应可自发进行的角度出发,加入单质碳可促进载氧体再生,从而促进反应的循环进行。同时,单质碳经过化学链气化反应也能转化为便于利用的CO气体。
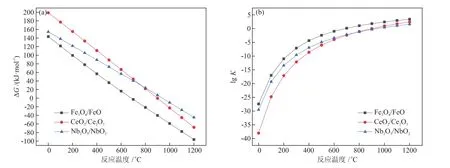
图4 间接再生反应中不同载氧体下反应∆G与K随反应温度的变化Fig.4 Changes of ∆G and K with reaction temperature under different oxygen carriers in indirect regeneration reaction
综上,经过热力学筛选,CLPD流程的载氧体初步确定为FeO、Ce2O3和NbO2。其中,铈和铌元素虽然是地壳中含量较丰富的稀有金属元素,但相比铁元素,其成本仍然较高。最终确定使用FeO作为CLPD流程的载氧体,单质碳作为载氧体再生反应中的燃料。
3 操作参数优化研究
3.1 原料配比及还原温度对CO2还原过程的影响
载氧体的添加量与还原温度的改变,均是影响CLPD的重要因素。为了使CO2部分脱氧效果更佳,本部分按照前文热力平衡计算方法及评价指标,对上述操作参数进行了优化。在还原反应器中,以1 kmol CO2为基准,在标准大气压下,改变FeO与CO2的配比(物质的量之比),研究还原温度对CO2剩余量、CO生成量的影响,如图5所示。

图5 还原反应器中不同原料配比下产物随反应温度的变化Fig.5 Changes of products with reaction temperature under different feedstock ratios in reduction reactor
由图5(a)可知,当温度高于 750 °C后,CO2剩余量、CO生成量均趋于稳定,且单质碳逐渐消失,说明CO2转化生成的积炭逐渐消失;当配比为1:1时,CO2剩余量趋近于 0.80 kmol,CO生成量则稳定在0.20 kmol左右。由图5(b)可知,当配比为2:1时,CO2剩余量稳定在0.72 kmol左右,CO生成量则稳定在0.28 kmol左右。由图5(c)可知,当配比为3:1时,CO2剩余量稳定在 0.68 kmol以下,CO生成量则趋近于0.33 kmol。由图5(d)可知,当配比达到4:1后,CO2剩余量、CO生成量与配比为3:1时相差很小。
综上,在还原反应器中,反应物FeO与CO2的最佳配比为3:1。因载氧体FeO在1000 °C后易烧结,适宜的反应温度为750~1000 °C。此时CO2的转化率可达32.9%,CO的产率可达0.327 mol/mol。NAJERA等[26]对FeO还原CO2进行了实验,数据显示FeO对CO2还原承载能力为15 g/mol,达到一定转化率所需最低温度为 700 °C,在 1000 °C时,CO2转化率约为30%,与本部分计算所得数据基本一致。
3.2 原料配比及再生温度对载氧体再生过程的影响
在再生反应器中,单质碳的添加量与温度的改变,也是影响CLPD的重要因素。以 1 kmol Fe3O4为基准,在标准大气压下,改变Fe3O4与C的配比,研究了再生温度对载氧体再生程度、单质碳气化程度的影响,如图6所示。由图6可知,当温度高于750 °C后,Fe3O4的还原程度基本趋于稳定,还原为最初的金属氧化物载氧体FeO,而且还原气CO的生成量也逐渐趋于一定。随着单质碳添加量的增加,气化程度逐渐加深。当配比为1:1时,FeO的再生量达到最大值,进一步添加单质碳,会使副产物Fe的生成量不断增加,从而影响载氧体再生。所以,在再生反应器中,反应物Fe3O4与C的最佳配比为1:1,考虑到载氧体在1000 °C后易烧结,适宜的反应温度为750~1000 °C,此时载氧体的再生程度可达47.3%,单质碳的气化程度可达53.9%。
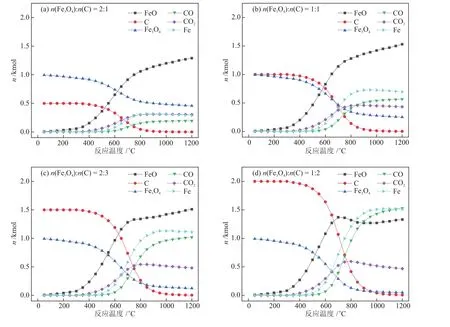
图6 再生反应器中不同原料配比下产物随反应温度的变化Fig.6 Changes of products with reaction temperature under different feedstock ratios in regeneration reactor
3.3 反应器内压力对CO2还原过程与载氧体再生过程的影响
根据吉布斯自由能最小化原理,控制还原反应器内部温度为 1000 °C,FeO与CO2配比为 3:1,再生反应器内部温度为 1000 °C,Fe3O4与C配比为 1:1,考察了反应器内不同压力对反应的影响,结果如图7所示。由图7(a)可知,随着压力的改变,反应组分的变化很小。根据Le Chatelier原理结合式(17)进行分析,无论压力如何变化,平衡状态下的反应体系中,各气体物质的量均不会发生变化,反应平衡不会移动。故还原反应器内部反应压力采用100 kPa。由图7(b)可知,随着压力的增加,CO生成量逐渐下降,FeO生成量也略微下降。根据Le Chatelier原理结合式(32)进行分析,随着压力增加,该反应的平衡向左移动,使载氧体再生与单质碳气化的效果下降,故再生反应器内部反应压力采用100 kPa。

图7 还原反应器(a)与再生反应器(b)中产物随反应压力的变化Fig.7 Changes of products with reaction pressure in reduction reactor (a) and regeneration reactor (b)
4 结论
本文建立了化学链CO2部分脱氧热力学模型,分别对CO2的还原与载氧体的再生过程开展了热力学分析,筛选载氧体并优化了反应条件,得到如下主要结论。
(1)综合考虑成本与性能,筛选出适合的载氧体即FeO/Fe3O4体系。在载氧体再生反应过程中耦合化学链气化反应,加入单质碳作为载氧体再生反应的燃料,以使被氧化的载氧体还原。
(2)还原反应器的优化操作参数为:n(FeO):n(CO2)为 3:1,反应温度为 750~1000 °C,反应压力为 100 kPa。此时CO2转化率可达32.9%,CO产率可达0.327 mol/mol。温度升高有利于积炭的消除从而提高反应性能。理论计算所得数据与文献实验数据基本吻合,证明了所建立计算方法对实验有一定的指导作用。
(3)再生反应器的优化操作参数为:n(Fe3O4):n(C)为 1:1,反应温度为 750~1000 °C,反应压力为 100 kPa。此时载氧体的再生程度可达47.3%,燃料单质碳的气化程度可达53.9%。添加单质碳过多,会导致载氧体进一步还原为Fe,从而影响再生性能。
