利用核磁共振研究脂肪氧合酶酶促氧化蛋黄磷脂
2022-12-22俞舜杰赵子建杨晓莹陈德慰
俞舜杰,赵子建,万 鹏,杨晓莹,陈德慰
(广西大学轻工与食品工程学院,广西 南宁 530004)
磷脂是一种具有两亲性的极性脂质,由甘油主链和sn-3上的磷酸基团组成。磷脂的动物来源主要是蛋黄、牛奶、海洋类生物、脑组织等,常见磷脂有磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰肌醇(phosphatidylinositol,PI)、鞘磷脂和其他复杂脂肪酸组成的甘油磷脂,而蛋黄磷脂主要由PC和PE组成[1-3]。31P核磁共振(nuclear magnetic resonance,NMR)已被证明是一种定量不同产品中磷脂的良好方法,并广泛应用于食品领域[2]。31P NMR和1H NMR相比,对含磷化合物具有选择性的重要优势,尽管31P NMR的灵敏度相对较低,但在低至5 μmol/100 g的含量下,仍可以很好地观察到磷脂[3]。
脂质氧化,尤其是磷脂的氧化对食品风味有着重要的影响[4]。磷脂中富含亚油酸等多不饱和脂肪酸,是重要的风味前体物质,极易氧化生成氢过氧化物。这些氢过氧化物不稳定,易降解成醛、酮等小分子物质,从而为不同食品提供风味特征。目前已有许多关于磷脂应用于提高食品风味的研究,Chen Dewei等[5]通过蛋黄磷脂提高了鸡肉香气,Guo Dong等[6]通过蛋黄磷脂提高了真空油炸薯条的风味,另外还有鳙鱼头磷脂[7]、猪肉磷脂[8]、牛奶磷脂[9]、鸡油磷脂[10]等也被用来研究对食品风味的影响。关于磷脂组成、磷脂抗氧化、磷脂促氧化以及磷脂对食品风味的提升等已经有了一定研究,但是对于磷脂氧化的机理还少有全面合理的解释。
脂肪酸可通过3种方式氧化:自氧化、光氧化以及酶促氧化。在氧化过程中,磷脂甘油链上的酰基会发生变化[11],可以通过酰基变化观察磷脂氧化的路径和程度。酰基可能发生变化的情况有3种:1)不饱和酰基链会导致分子内或分子间甘油三酯分子不同酰基链上碳原子间形成键,后一种情况下会导致聚合,可能减少多不饱和链的饱和度,以及可能产生二聚体、三聚体、低聚物或聚合物;2)酰基链形成含氧官能团,如氢过氧基、羟基、酮基或环氧基;3)酰基链断裂形成小分子,从而生成具有截断酰基链的甘油三酯。
脂肪氧合酶(lipoxygenase,LOX)属于氧化还原酶,能特异性地在顺,顺-1,4-戊二烯结构处通过分子加氧催化多不饱和脂肪酸,生成含有共轭双键的氢过氧化物。LOX主要作用于亚油酸、亚麻酸、花生四烯酸和其他高级脂肪酸,一般认为亚油酸的加氧位置在C9和C13位上[12],生成的一级产物氢过氧化物稳定性低,可继续降解并氧化成醛、酮等二级氧化产物,还可进一步氧化为环氧酸[13]。
在食品科学领域,脂质氧化常用的分析方法有过氧化值、酸价、碘值、对茴香胺值和2-硫代巴比妥酸值等的测定[14]。还有通过光谱法定量评估共轭二烯和三烯、使用气相色谱-质谱联用法[15]测定挥发性低分子脂质氧化产物等技术。NMR技术因其高效精确及专一性强的优点,已被广泛用于测定物质组成和监测物质化学变化。尽管1H NMR的δ窄,信号容易重叠,但是其灵敏度高,得到的信号较多,与传统分析方法相比能得到更多有利的信息。另外,相比于传统方法和色谱法,NMR技术对样品纯度要求不高,样品几乎不需要预处理且在室温下进行分析,并只需使用少量有机溶剂或试剂,而且分析样品的时间通常较短。利用1H NMR对脂质氧化产物的进一步研究确定了许多其他氧化产物,如共轭二烯体系的氢过氧化物、醛类和环氧化物[16],并有助于建立目前对脂质氧化的基本认识。1H NMR技术根据化合物特征官能团质子产生的光谱信号可对其进行定性和定量分析。
一直以来,研究热氧化食用油等脂质氧化规律的很多,但利用LOX催化探究磷脂氧化机理的研究还很罕见。蛋黄是磷脂的主要来源之一,本研究期望通过LOX催化氧化蛋黄磷脂,利用31P NMR测定蛋黄磷脂组成,通过1H NMR和两种化学方法监测蛋黄磷脂中主要酰基、一级和二级氧化化合物的变化,为酶促氧化磷脂生成醛类风味化合物提供一定理论基础。
1 材料与方法
1.1 材料与试剂
鸡蛋购自当地菜市场。
大豆LOX 浙江联硕生物有限公司;无水乙醇、氢氧化钾 成都市科龙化工试剂厂;氘代氯仿(CDCl3)、磷酸三苯酯 上海麦克林生化科技有限公司;正己烷、乙醚、丙酮、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、盐酸、柠檬酸、柠檬酸钠、硼砂、硼酸 西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
CR21N型高速冷冻离心机 天美(中国)科学仪器有限公司;AVANCE III HD 500 NMR波谱仪 德国Bruker公司;HJ-6A型数显恒温磁力搅拌器 江苏金怡仪器科技有限公司;RE-201D旋转蒸发仪 上海精密仪器仪表有限公司。
1.3 方法
1.3.1 样品的制备
实验共设置6 组样品:空白组:新鲜蛋黄磷脂;实验组1:水浴95 ℃氧化2 h的蛋黄磷脂;实验组2:pH 6条件下大豆LOX氧化3 h的蛋黄磷脂;实验组3:pH 9条件下大豆LOX氧化3 h的蛋黄磷脂;实验组4:实验组2酶促氧化蛋黄磷脂的热氧化(95 ℃水浴2 h)样品;实验组5:实验组3酶促氧化蛋黄磷脂的热氧化(95 ℃水浴2 h)样品。实验组2和实验组3的两种pH值分别为磷脂C9与C13位的最适氧化条件。蛋黄磷脂的热氧化用于使用1H NMR观察蛋黄磷脂中二级氧化产物。
1.3.1.1 蛋黄磷脂的制备
参考Chen Dewei等[5]的方法,并做少量修改。取6个新鲜鸡蛋去除蛋清,将蛋黄搅拌均匀后,利用3~6 倍体积的乙醇提取蛋黄磷脂。取出提取液至圆底烧瓶,向沉淀中继续加乙醇并于4 000 r/min离心15 min,合并上清液与提取液。将溶液减压蒸馏后,加入正己烷溶解,冰浴10 min,加入适量冷丙酮以沉淀磷脂。用丙酮不断洗涤沉淀物,冲洗至冲洗液无色,取沉淀至培养皿。在室温下,高真空6 h去除沉淀中少量残留溶剂,得到蛋黄磷脂样品,放入4 ℃冰箱保存。
1.3.1.2 蛋黄磷脂的酶促氧化
参考蔡琨[17]的方法,并做少量修改。称量1 g蛋黄磷脂(溶解度约0.5%)置于烧杯中,加入200 mL pH 6 0.1 mol/L柠檬酸钠缓冲液(或200 mL pH 9 0.2 mol/L硼酸盐缓冲液)。取大豆LOX在2 mL离心管中用蒸馏水溶解,振荡至完全溶解。将酶液加入烧杯,在37 ℃下磁力搅拌3 h后停止反应。用乙醚萃取氢过氧化物,并用水洗涤乙醚提取物,去除可能残留的蛋白质等杂质。利用高真空去除样品中的残留乙醚[18]。通过延长反应时间达到与文献相似的氧化效果。
1.3.1.3 蛋黄磷脂的热氧化
参考Xu Na等[19]的方法,并适当修改。取0.2 g蛋黄磷脂,加2 mL氯仿,氮吹蒸发溶剂,并减压蒸发残余氯仿后得到一层磷脂膜。放入具塞试管中,95 ℃水浴加热2 h,迅速冰浴冷却后保存。
1.3.231P NMR分析
参考Bettjeman[20]和Ahmmed[21]等的脂质内标法。将内标物磷酸三苯酯溶于CDCl3,涡旋1 min,质量浓度为25 mg/mL。取0.1 g蛋黄磷脂样品转移至10 mL离心管中,溶剂为0.4 mL CDCl3和0.4 mL甲醇-K4EDTA混合物。溶液振荡均匀后转移至5 mm核磁管中。使用带有5 mm低温探针的600 MHz的NMR波谱仪进行分析:单脉冲模式;实验温度25 ℃;扫描次数192次,弛豫时间3.5 s。
采用绝对定量法:由内标化合物特征峰面积与样品中某一特征峰面积的比值按下式计算样品质量浓度[22]:

式中:cx为待测物质量浓度/(mg/L);cstd为内标质量浓度/(mg/L);Mx为待测物分子质量;Mstd为内标分子质量;Ax为待测物峰面积;Astd为内标物峰面积;nx为待测物定量峰包含的磷原子数;nstd为内标物定量峰包含的磷原子数。
1.3.31H NMR分析
参考文献[23-24]的方法。取0.1 g蛋黄磷脂样品转移至2 mL的离心管中。溶剂为600 μL CDCl3。将溶液在振荡仪上摇匀,转移到5 mm核磁管中。使用带有5 mm低温探针的500 MHz的NMR波谱仪进行分析:内部温度295 K;单脉冲模式;扫描次数64次;弛豫时间1 s,采集时间3.744 s。
利用1H NMR计算油脂脂肪酸组成及含量的方法已被大量报道[23,25-26],总结整理得出计算公式。
主要脂肪酰基的相对物质的量按式(2)计算:

式中:xi待测脂肪酸的相对物质的量/%;Ii为待测脂肪酸的积分换算值;IFA为总脂肪酸的积分换算值。
脂肪酸的积分换算如式(3)~(10)所示,Ax表示相应信号的积分值,δ分配见表1。
选择甘油主链的—CH2OCOR,按下式计算总脂肪酸的积分换算值:

选择不饱和ω-3酰基的—CH3,按下式计算总ω-3脂肪酸的积分换算值:

选择二十二碳六烯酸(docosahexaenoic acid,DHA)酰基的—OCO—CH2—CH2—,按下式计算DHA的积分换算值:

选择二十碳五烯酸(eicosapentaenoic acid,EPA)和二十碳四烯酸(eicosatetraenoic acid,ARA)酰基的—OCO—CH2—CH2—,按下式计算EPA和ARA的积分换算值:

选择不饱和ω-3酰基的—CH3,按下式计算亚麻酸的积分换算值:

选择双不饱和ω-6酰基的=HC—CH2—CH=,按下式计算亚油酸的积分换算值:

选择除DHA外脂肪酸烯丙基的—CH2—CH=CH—,按下式计算油酸的积分换算值:

选择饱和、单不饱和ω-9和/或ω-7、不饱和ω-6酰基的—CH3,按下式计算饱和脂肪酸的积分换算值:
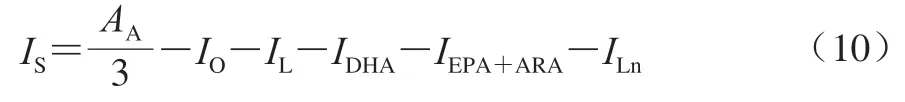
氢过氧化物、醛类的浓度比按下式计算:

式中:bi为待测物质的浓度比/(mmol/mol磷脂);Ii为待测物质的积分换算值;103为换算系数;IFA为总脂肪酸的积分换算值。相应氧化产物的δ分配见表1。
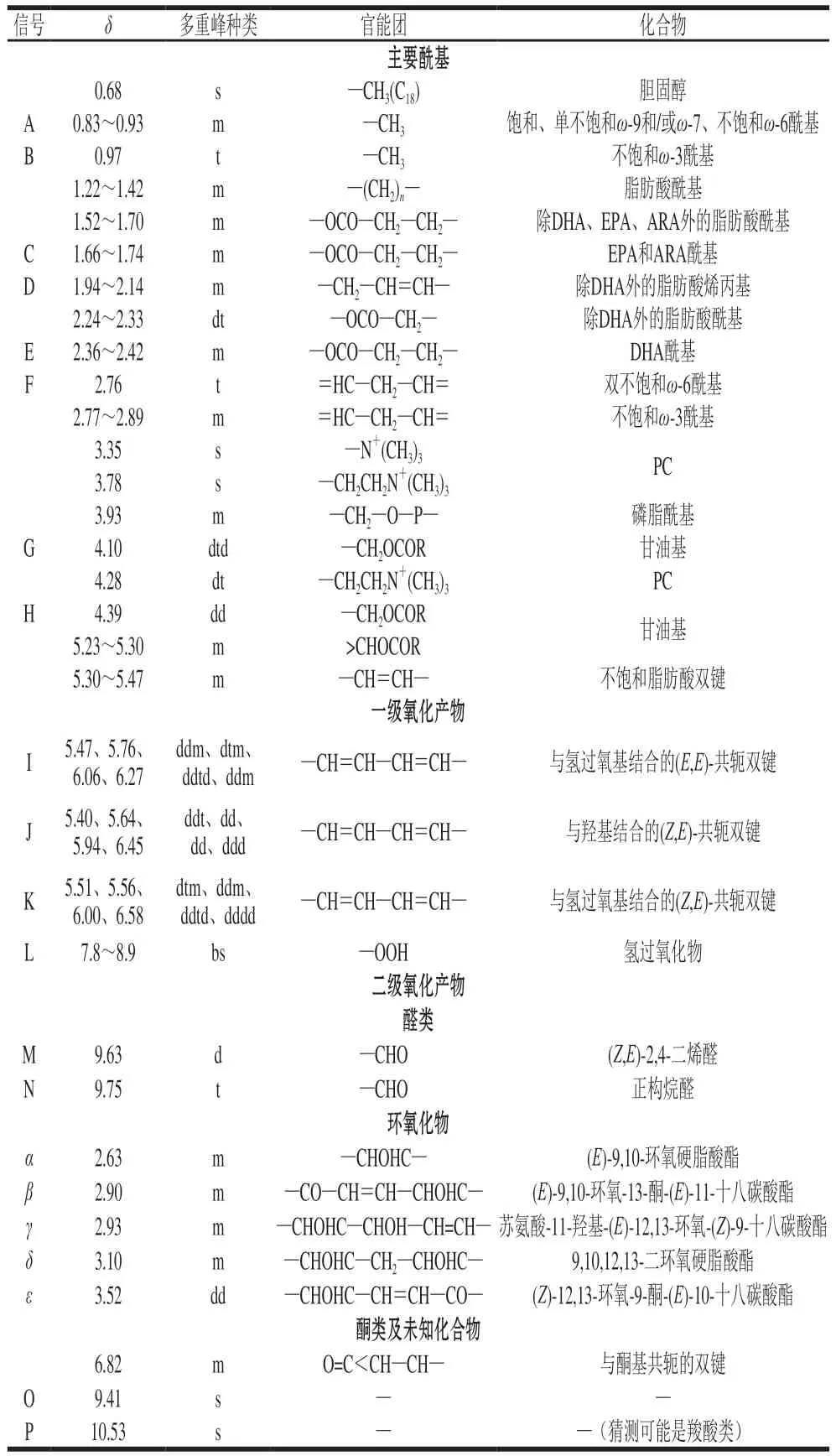
表1 蛋黄磷脂主要酰基与氧化产物在CDCl3中1H NMR信号的δ分配和多重峰种类Table 1 Chemical shift distribution and multiple peak types of 1H NMR signals of main acyl groups and oxidation products of egg yolk phospholipids in CDCl3
1.4 数据处理
使用SPSS 23.0软件进行t检验,P<0.05,差异显著。
2 结果与分析
2.1 蛋黄磷脂氧化前后成分分析
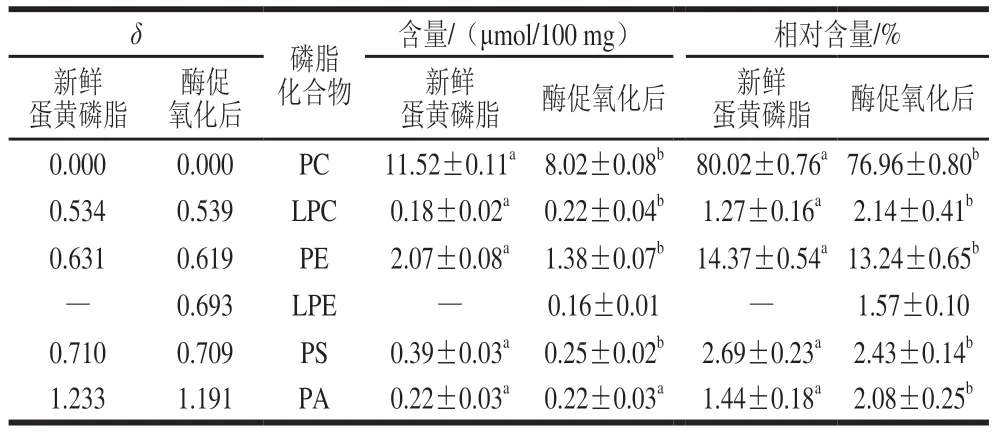
表2 酶促氧化前后蛋黄磷脂成分含量Table 2 Change in purity of egg yolk phospholipids before and after enzymatic oxidation
从表2可以看出,蛋黄磷脂中PC最多,PE其次。其中,新鲜蛋黄磷脂中含有(80.02±0.76)%的PC和(14.37±0.54)%的PE,这与文献[27]中蛋黄磷脂PC(78%)和PE(18%)的含量一致。不同来源蛋黄磷脂中PC含量会有波动,高PC含量的蛋黄卵磷脂大于90%,甚至大于95%,而低PC含量的蛋黄卵磷脂为68%~80%[28]。
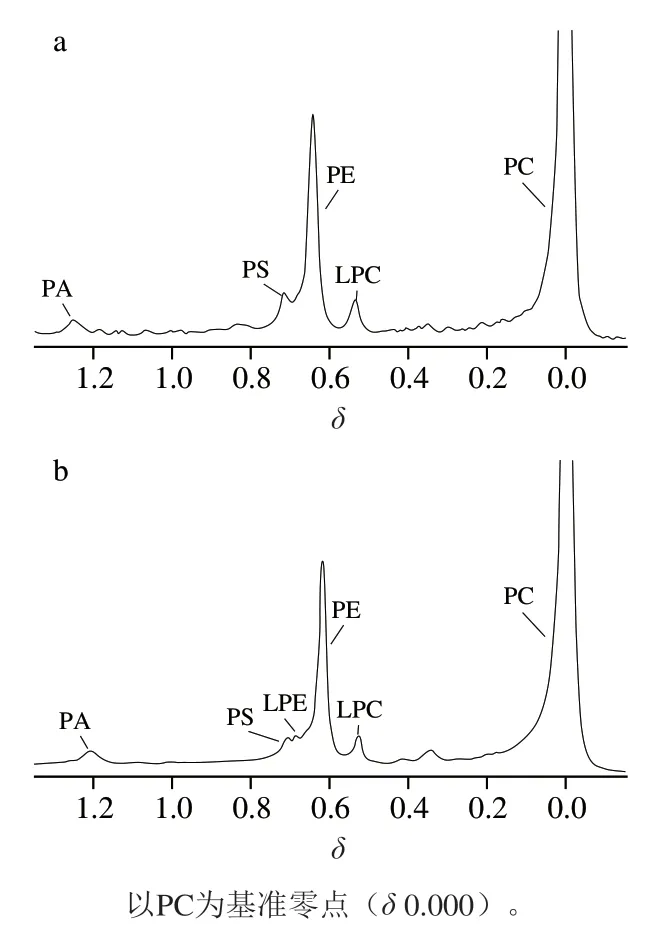
图1 空白组(a)和实验组2(b)蛋黄磷脂成分的31P NMR谱图Fig. 1 31P NMR spectra of egg yolk phospholipids in blank group (a) and experimental group II (b)
对比图1a和b可以发现,氧化后,蛋黄磷脂的成分发生了变化。由表2可知,酶促氧化后测得的蛋黄磷脂组分中,PC和PE含量均发生下降,这是因为氧化时,磷脂上的大量不饱和脂肪酰基的双键容易被自由基攻击。另外,酶促氧化后,蛋黄磷脂产生了LPE的峰(图1),LPC含量增加(表2),说明酶解反应增加了溶血性磷脂的含量。LPC来源于磷脂酶A2作用下PC的裂解:磷脂酶A2能够特异性水解甘油磷脂sn-2位的脂酰键,从而产生溶血性磷脂[29-30]。磷脂酶存在于动物和植物体内,推测其可能有两个来源:来自于实原材料鸡蛋本身或来源于LOX。
2.2 蛋黄磷脂氧化前后主要酰基变化分析
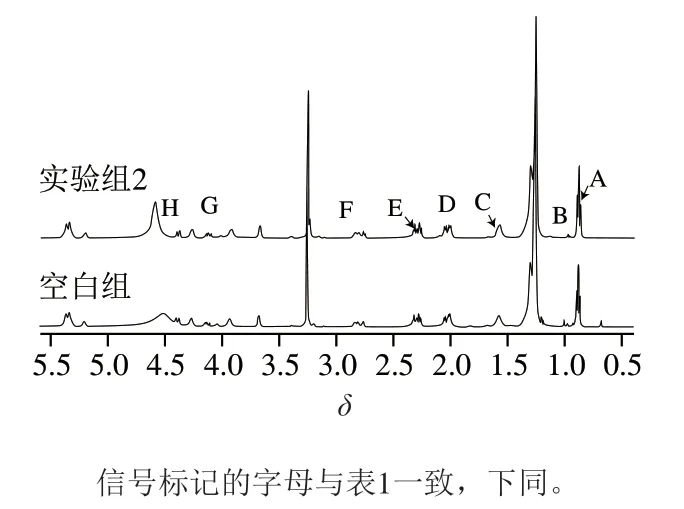
图2 空白组和实验组2蛋黄磷脂的1H NMR谱图(δ 0.5~5.5)Fig. 2 1H NMR spectra of egg yolk phospholipids in blank group and experimental group II (δ 0.5-5.5)
由图2可以看出,与空白组相比,实验组2脂肪酸酰基的峰仅有略微变动,无明显的改变。由表3可知,对比空白组,在水浴加热氧化或酶促氧化后,蛋黄磷脂的不饱和脂肪酸相对物质的量均下降,而饱和脂肪酸的相对物质的量均上升。这是因为不饱和双键极不稳定,加热会使碳碳双键发生自由基链式反应形成氢过氧化物,而LOX催化氧气插入含有一个(1Z,4Z)-戊二烯部分的脂肪酸使其过氧化,最终断裂生成小分子的醇、醛、酮或环氧化物。

表3 6 组蛋黄磷脂样品中各种脂肪酸的相对物质的量Table 3 Molar percentages of fatty acids in six egg yolk phospholipid samples
由表3可知,与空白组相比,5个实验组的亚油酸相对物质的量都有明显下降,说明在氧化条件下,蛋黄磷脂中的亚油酸均发生了剧烈的氧化降解反应,并生成氢过氧化物。pH 6酶促氧化蛋黄磷脂(实验组2)含有的亚油酸相对物质的量为(14.21±0.81)%,小于仅水浴加热蛋黄磷脂(实验组1)的亚油酸相对物质的量,这是由于LOX特异性催化亚油酸的双键,并且亚油酸是在磷脂中占比最高的多不饱和脂肪酸。pH 6和pH 9酶促氧化后水浴加热蛋黄磷脂(实验组4和5)含有的油酸相对物质的量均小于仅酶促氧化的样品(实验组2和3),说明氧化后单不饱和脂肪酸相对物质的量呈先上升后下降的趋势。这与单不饱和脂肪酸的峰的计算方式有关。在氧化初期,大量多不饱和脂肪酸的每个双键存在氧化顺序,含有单个双键的不饱和脂肪酸衍生物大量生成,由于多不饱和脂肪酸相比单不饱和脂肪酸更易被氧化,油酸的降解速率小于多不饱和脂肪酸降解后生成含有单个双键的不饱和脂肪酸衍生物的速率。
2.3 蛋黄磷脂氧化生成的一级氧化产物分析
先前的研究[31]表明LOX的氧化特异性随反应体系pH值的变化而变化:pH值在7.5以下时,LOX显示9-LOX活性,而在较高pH值下,13-LOX活性占优势;但是在极酸和极碱条件下,几乎检测不到LOX的活性。因此pH 6.0~9.0是LOX的最适pH值范围,pH 6时,酶催化产生9-氢过氧化物,而pH 9条件下会形成13-氢过氧化物。
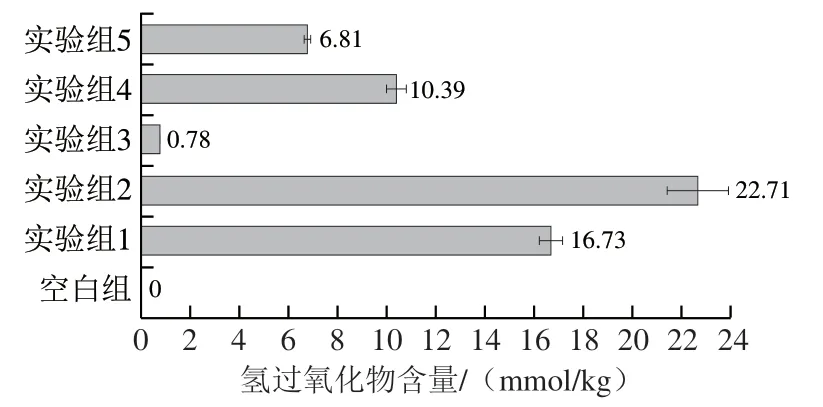
图3 蛋黄磷脂氧化生成一级氧化产物氢过氧化物的含量Fig. 3 Contents of hydroperoxide, the first oxidation product of egg yolk phospholipids
从图3可以看出,蛋黄磷脂样品氧化生成的氢过氧化物含量从多到少依次是实验组2>实验组1>实验组4>实验组5>实验组3>空白组。LOX可以特异性催化氧化含有(1Z,4Z)-戊二烯系统的多不饱和脂肪酸。尽管氢过氧化物是不稳定的中间产物,在没有加热等继续剧烈氧化的条件下,反应体系中也会尽可能地富集氢过氧化物,这也是pH 6酶促氧化磷脂(实验组2)生成氢过氧化物最多的原因之一。
实验组1尽管氧化也足够强烈,但是由于没有特异性催化的条件,生成的氢过氧化物极不稳定,容易进一步氧化降解。而实验组4是蛋黄磷脂样品在pH 6的环境中并在酶促氧化的基础上继续加热氧化,由于磷脂已经被氧化且生成了较多氢过氧化物,氢过氧化物降解的速度大于产生的速度,因此氢过氧化物被进一步消耗。实验组3产生的氢过氧化物极少,说明LOX在pH 9的条件下氢过氧化物的累积量不足以被1H NMR大量监测到。这是因为pH 9 是LOX的最适pH值[32],在此条件下使得蛋黄磷脂较快地产生氢过氧化物后又被快速降解了。Therond等[33]通过LOX处理获得相应的氢过氧化物,而在磷脂浓度较低的情况下,发生了氢过氧化物的降解,可能与LOX反应时间过长有关。本实验在监测pH 6和pH 9条件下的两种磷脂氧化反应条件中使用了相同的时间(3 h),希望在pH 6条件下磷脂氧化得更加充分,从而产生更多的C9位氢过氧化物。实验组5在已经被酶促氧化后,得到的氢过氧化物含量少于实验组1,可能是因为较长的酶促反应时间导致pH 9条件下的氢过氧化物生成后再降解。实验组5比实验组3生成氢过氧化物多的原因是受到水浴加热的影响而发生了热氧化(自动氧化)而并非来自于酶促氧化。由此可见,LOX可以在pH 6的条件下,特异性地催化蛋黄磷脂在C9位生成氢过氧化物。
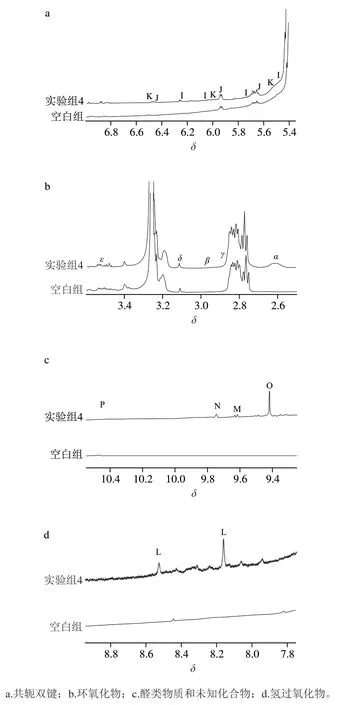
图4 蛋黄磷脂氧化前后的1H NMR谱图Fig. 4 1H NMR spectra of egg yolk phospholipids before and after oxidation
由图4所示,空白组的蛋黄磷脂在δ7.7~8.9之间几乎没有信号,而实验组4的磷脂在此区间内有一个宽信号峰(信号L)。图4d中还发现δ7.7~8.5处有许多小的单峰,有报道称这可能是连接氢过氧化物的—OOH或—OH[34],它的形成可能与加热过程中接触氧气量不足有关[35]。而在δ5.5~6.5区间内的信号峰表明,在磷脂未氧化时就产生了一些与—OOH或—OH相连的共轭二烯体系的信号。
2.4 蛋黄磷脂氧化生成的二级氧化产物分析
蛋黄磷脂被氧化后生成的一级产物不稳定,很容易进一步被氧化为多种类型的小分子化合物。有一些二级氧化产物具有不与其他物质重叠的1H NMR光谱信号,可以用于定性和定量分析。由于磷脂中亚油酸C9位的特定氧化路径可以用最终产物小分子醛类佐证,因此本研究主要对醛类物质进行分析。
由表1可知,从蛋黄磷脂1H NMR光谱中的δ9.2~10.6区域可以检测出4种化合物。δ9.63处的双重峰(信号M)为(Z,E)-2,4-二烯醛;δ9.75处(信号N)为正构烷醛[36];2个暂未定义的信号,一个在δ9.41处,另一个在δ10.53处(此峰猜测可能是羧酸类化合物)。Guillén等[37]在植物油的δ9~10区域内也检测出δ9.41这个信号,暂时把它认定为单醛。
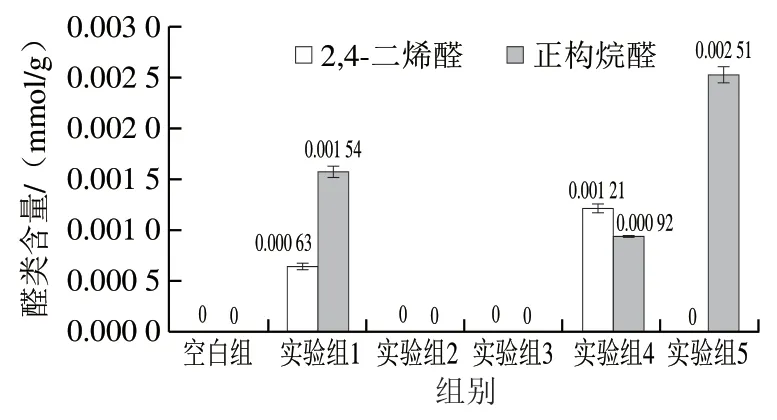
图5 蛋黄磷脂氧化生成的二级氧化产物2,4-二烯醛和正构烷醛的含量Fig. 5 Amounts of 2,4-diene aldehyde and n-alkanolaldehyde produced by the oxidation of egg yolk phospholipid samples
由图5可知,在酶促氧化的样品中,无论在pH 6还是pH 9条件下的磷脂(实验组2或3),均未检测到醛类物质。由于LOX特异性催化氧化含有(1Z,4Z)-戊二烯系统的多不饱和脂肪酸的区域[38],在适当酶活性、反应时间不足的情况下,脂质会尽可能地富集一级氧化产物。因此尽管氢过氧化物是中间产物且不稳定,但极少会被继续降解成小分子醛类。
通过酶促氧化后继续热氧化,可以将富集的氢过氧化物继续分解成二级氧化产物。在实验组4中,发现产生了较多的(Z,E)-2,4-二烯醛信号(图4c)。而在实验组5中并没有发现(Z,E)-2,4-二烯醛,只发现了正构烷醛,这是因为在pH 9时,蛋黄磷脂只产生13-氢过氧化物[39]。在课题组之前的研究中[5,40]氧化蛋黄磷脂时产生的2,4-二烯醛类主要是(Z,E)-2,4-癸二烯醛和(E,E)-2,4-癸二烯醛,产生的正构烷醛主要是己醛。2,4-癸二烯醛具有典型的油炸鸡肉味,是油炸食品的特征风味物质,并且其气味检测阈值较低,因此添加到油炸类、肉类等食品中,对风味有重大的贡献。由此可以推测,在pH 6条件下,LOX催化蛋黄磷脂大量生成的(Z,E)-2,4-二烯醛类为(Z,E)-2,4-癸二烯醛;而在pH 9条件下生成的正构烷醛为己醛。
3 结 论
将通过乙醇/正己烷/丙酮提取的蛋黄磷脂分别进行95 ℃水浴加热和LOX酶促氧化以及混合氧化。通过31P NMR对酶促氧化前后蛋黄磷脂的成分进行测定,发现氧化后磷脂的PC和PE含量均发生了下降,同时酶解反应增加了溶血性磷脂的含量。通过1H NMR对6 组磷脂样品进行监测,发现所有的氧化样品中总不饱和脂肪酸相对物质的量均下降,而饱和脂肪酸的相对物质的量均上升,其中在pH 6酶促条件下,亚油酸的降解速率最快。LOX在pH 6条件下特异性氧化蛋黄磷脂能生成更多的氢过氧化物,在加热后进一步生成更多期望的风味化合物(Z,E)-2,4-二烯醛,说明在LOX的作用下,蛋黄磷脂中亚油酸在C9位氧化更充分;而LOX在更有活性的pH 9条件下,由于酶促时间较长,蛋黄磷脂较快合成氢过氧化物后又发生降解,并且其主要在C13位发生氧化,因此在加热后生成了更多的正构烷醛。这些特性表明,LOX在适当条件下可以控制蛋黄磷脂氧化的路径进而生成期望的风味化合物,为食品风味物质前体的促进生成提供了思路。
