基于RBL-2H3模型分析过敏反应效应细胞激活的差异基因
2022-12-22谷福蝶陈慧莹曹敏杰刘光明刘庆梅
刘 艳,谷福蝶,陈慧莹,李 焱,周 钰,张 军,刘 红,曹敏杰,刘光明,刘庆梅
(集美大学海洋食品与生物工程学院,福建省海洋功能食品工程技术研究中心,福建 厦门 361021)
过敏性疾病被世界卫生组织列为21世纪重点防治的三大疾病之一,是世界上最常见的慢性疾病之一[1]。常见的过敏性疾病包括食物过敏、支气管哮喘、变应性鼻炎、特应性皮炎等,其特征主要是IgE介导的超敏反应[2-3]。IgE介导的过敏反应能够引起效应细胞激活,释放组胺、蛋白酶和细胞因子等,从而诱发全身性过敏反应症状[4]。
肥大细胞是过敏反应中的重要效应细胞,大量存在于机体屏障组织中,如皮肤、呼吸道和胃肠道黏膜[5-7]。肥大细胞可通过多种表面受体被激活,包括高亲和力受体、干细胞因子受体和细胞因子受体等。大鼠嗜碱性粒细胞(rat basophilic leukemia,RBL)-2H3表面高表达IgE高亲和力受体(high affinity IgE receptor,FcεRI),通常作为肥大细胞模型用于大通量的抗过敏药物筛选以及I型过敏反应的机理研究[8],该方法简便快捷、重复性高且经济成本低。Wang Chongyang等[9]通过RBL-2H3细胞模型探究了紫檀芪可通过调控肿瘤抑制因子LKB1/腺苷酸活化蛋白激酶AMPK信号分子抑制FcεRI通路;Ma Jing等[10]发现果胶寡糖能抑制RBL-2H3细胞的脱颗粒以及炎症因子的释放,可以作为治疗过敏性疾病的潜在药物;本课题组也用RBL-2H3细胞模型挖掘天然活性产物,为治疗食物过敏的食/药用原材料开发提供参考[11-13]。但是目前对于该细胞模型的机理探究还不够深入。
转录组测序(RNA-seq)技术是通过反转录从RNA中获得互补DNA序列的高通量测序技术[14]。RNA-seq是近年来转录组学中应用最广泛的技术之一,它可以揭示遗传改变与复杂生物学过程之间的关系[15]。通过RNA-seq技术,Kanagaratham等[16]研究了奥美拉唑对激活后肥大细胞的转录因子表达情况的影响,该药物能抑制过敏相关的转录因子表达,为肥大细胞特异性的药理靶点提供参考;Dong Na等[17]利用转录组学分析差异基因(differential expressed genes,DEGs)发现黄芪多糖通过调控核因子(nuclear factor kappa-B,NF-κB)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路抑制脂多糖LPS诱导的猪上皮细胞产生炎症因子。已有学者探究过敏反应效应细胞的某些信号通路[16,18],但针对RBL-2H3细胞激活的转录组信息全面分析还鲜见报道。因此本研究以IgE介导的RBL-2H3细胞为过敏反应模型,通过RNA-seq技术对RBL-2H3细胞激活后表达差异显著的基因及其参与的信号通路进行分析,以期为IgE介导的过敏反应潜在靶点提供参考。
1 材料与方法
1.1 材料与试剂
RBL-2H3细胞 上海复祥生物技术有限公司;最低必需液体培养基(Eagle’s minimum essential medium,EMEM) 美国HyClone公司;胎牛血清 美国Gemini生物科技公司;抗二硝基苯单克隆抗体 美国Sigma公司;二硝基苯偶联牛血清白蛋白(dinitrophenol-bovine serum albumin,DNP-BSA)、氟代五氯丙酮 美国Biosearch公司;组胺酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒 德国IBL公司;小鼠白细胞介素4/6 ELISA试剂盒、小鼠肿瘤坏死因子(tumor necrosis factor,TNF)-αELISA试剂盒 美国Perprotech公司;其他试剂为国产分析纯。
分别称取NaCl 8.0 g、KCl 0.2 g、NaHCO31.0 g以及NaH2PO40.05 g,加蒸馏水溶解,接着加入CaCl20.2 g及MgCl20.1 g,经磁力搅拌均匀后定容至1 L。量取50 mL的上述缓冲液加入50 mg葡萄糖,充分溶解后经0.22 μm过滤器过滤除菌后使用(台式缓冲液);量取50 mL台式缓冲液加入50 μL的Triton-X 100,振荡均匀后待用(细胞裂解液)。
1.2 仪器与设备
Forma 3111 CO2培养箱 德国Memmert公司;SG-403生物安全柜 美国的Baker公司;Infinite M200 PRO酶标仪 德国Tecan公司。
1.3 方法
1.3.1 RBL-2H3细胞的培养与模型构建
RBL-2H3细胞按照5×105个/孔培养于含10%胎牛血清(fetal bovine serum,FBS)的EMEM培养液(2 mL培养液/孔)中。所使用的6 孔板置于5% CO2、37 ℃的CO2培养箱,待细胞长满培养板80%(2~3 d)后进行传代。
参照Liu Qingmei等[12]的方法,将抗二硝基苯单克隆抗体anti-DNP-IgE(终质量浓度为100 ng/mL)加入含有RBL-2H3细胞悬液的10% FBS-EMEM培养液中,充分混合后将细胞悬液移入96 孔板中(细胞数5×104个/孔)。12~16 h后弃去培养液,用磷酸盐缓冲溶液洗涤后,接着用台式缓冲液继续培养,加入不同质量浓度的DNP-BSA(终质量浓度分别为0、100、200、500、1 000 ng/mL,其中未添加DNP-BSA为阴性对照组),刺激RBL-2H3细胞,15 min后收集部分上清液,通过ELISA测定组胺的释放量。1 h后回收细胞上清液,再加细胞裂解液裂解细胞;最后用25 μL上清液或细胞裂解液分别加入96 孔板,每孔加100 μL 1.2 mmol/L的氟代五氯丙酮试剂,37 ℃反应30 min,用酶标仪测定荧光值(激发波长360 nm,发射波长450 nm)。
根据β-氨基己糖苷酶确定合适的DNP-BSA质量浓度(500 ng/mL),用500 ng/mL终质量浓度的DNP-BSA处理IgE敏化后的RBL-2H3细胞,收集细胞培养上清液,通过ELISA测定IL-4(培养4 h)以及TNF-α(培养6 h)的产生量[19]。
1.3.2 RNA-seq技术
按照1.3.1节方法,RBL-2H3细胞在培养箱中培养1 h后弃去上清液,用磷酸盐缓冲溶液洗两次,每孔加入100 μL细胞裂解液,充分裂解细胞后将裂解液转移到2 mL的无RNA酶离心管,在室温下静置5 min,置于-80 ℃保存,用于RNA-seq。在IgE介导的RBL-2H3细胞激活模型中,其中未经过DNP-BSA刺激,即是正常的RBL-2H3细胞,释放极少的颗粒物质和组胺、细胞因子等,即定义为阴性组;而阳性组中的RBL-2H3细胞经DNP-BSA(500 ng/mL)刺激,细胞能够脱颗粒,释放组胺和细胞因子,呈现强烈的过敏反应。阴性组(阴性1、2、3)及阳性组(阳性1、2、3)2 组样品,每组设置3个平行。
收集上述样品委托美吉生物医药公司进行检测,对样品进行文库富集和聚合酶链反应扩增以便于后续Illumina平台上机测序[20-21]。为了保证后续生物信息分析的准确性,对原始数据raw reads处理得到高质量测序数据clean reads[22]。使用TopHat2软件将测序数据和参考基因组(大鼠基因组)进行定量比对分析。以显著性P值和差异倍数(fold change,FC)作为DEGs的筛选条件(|log2FC|≥0.585以及P<0.05),分析基因表达水平的差异[23-24]。基于直系同源蛋白分组比对(Evolutionary Genealogy of Genes: Non-supervised Orthologous Groups,EggNOG)数据库和基因本体论(Gene Ontology,GO)数据库对DEGs进行功能分类分析,利用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)对DEGs进行Pathway注释和富集分析[25]。
1.4 数据统计分析
2 结果与分析
2.1 RBL-2H3 细胞激活模型的建立
通过探究DNP-BSA的最适质量浓度建立了IgE介导的RBL-2H3细胞激活模型,测定β-氨基己糖苷酶释放率以及组胺释放量,结果如图1A、B所示,在DNPBSA质量浓度低于500 ng/mL时,β-氨基己糖苷酶释放率以及组胺释放量与DNP-BSA质量浓度呈正相关趋势。DNP-BSA终质量浓度1 000 ng/mL与DNP-BSA终质量浓度500 ng/mL相比,β-氨基己糖苷酶的释放有显著差异,但组胺释放差异不显著,说明当使用500 ng/mL DNP-BSA后,RBL-2H3的激活已基本饱和,从成本的角度考虑,最终确定DNP-BSA的最适质量浓度为500 ng/mL。此外,过敏反应发生后,效应细胞不仅脱颗粒和释放组胺等过敏介质,也会分泌大量的细胞因子(TNF-α及IL-4)诱发炎症反应,使用500 ng/mL DNP-BSA构建IgE介导的RBL-2H3细胞激活模型,测定TNF-α以及IL-4的分泌情况,结果如图1C所示,TNF-α产生量从120.08 pg/mL增加到253.69 pg/mL,IL-4的释放量从15.77 pg/mL增加到77.32 pg/mL,结果表明当RBL-2H3细胞被激活时炎症因子明显增多,说明500 ng/mL DNP-BSA刺激RBL-2H3后,细胞发生了强过敏反应,过敏介质及相关细胞因子均显著上调,模型构建成功。该过敏反应细胞模型的构建能够为效应细胞激活的分子机制探究奠定基础,也可用于抑制过敏反应的天然产物或药物的筛选及机理分析。本课题组也利用该模型对海洋的天然活性物质的抗过敏活性进行了初筛,并且使用该模型对筛选出的活性物质以及红藻中提取的多糖等进行了抗过敏机理的研究[5,11,26]。

图1 RBL-2H3细胞β-氨基己糖苷酶释放率(A)、组胺释放量(B)以及TNF-α、IL-4释放量(C)Fig. 1 Release rates of β-hexaminosidase (A), histamine release (B) and TNF-α and IL-4 release (C) from RBL-2H3 cells
2.2 DEGs RNA-seq数据质量分析
对RBL-2H3细胞激活后细胞样本进行RNA-seq,得到相应的原始测序数据raw reads,经过滤得到质控后的数据clean reads。对质控后的测序数据进行质量评估,根据表1结果可知,样品中Q20均高于98%,Q30均高于94%(Q20、Q30分别指测序质量在99%和99.9%以上的碱基占总碱基的百分比,一般Q20在85%以上,Q30在80%以上),这一结果表明测序的6个样本clean reads质量良好,没有存在污染的情况,能够达到RNA-seq的要求,可以用于后续分析[27]。

表1 阳性组与阴性组DEGs RNA-seq数据Table 1 Transcriptome sequencing data for positive and negative groups
2.3 DEGs表达水平分析
为了探究RBL-2H3细胞激活前后基因表达水平的数量以及动态变化,通过每百万次读取的转录本进行了不同样品间的DEGs分析。得到有关阳性组和阴性组样品之间DEGs的Venn图(图2A),其中检测到10 880个DEGs共同表达,而在阳性组中特异表达的DEGs有199个,阴性组特异表达的DEGs有185个。为进一步了解RBL-2H3细胞激活前后DEGs的差异变化,利用DESeq2软件分析获得两组间发生差异表达的基因,结果如图2B、C所示,共有232个DEGs,其中表达量显著下调的基因18个,表达显著上调的基因214个。由此可见,RBL-2H3细胞激活主要体现在DEGs的上调表达,如Tnfaip3、Tnfsf8、Fos等,RBL-2H3细胞的激活会发生细胞脱颗粒,产生大量的包括TNF-α在内的炎症因子,在一定程度上说明了显著上调的DEGs与炎症因子的产生有必然关系。在其他研究中,也发现效应细胞激活会导致信号通路下游蛋白迅速磷酸化从而释放炎症因子[16,18]。
2.4 DEGs的生物学功能分析
2.4.1 DEGs的GO功能分类统计
图3为GO分析中DEGs参与的生物学过程。涉及生物过程、细胞组分和分子功能,其中归属于生物过程的最多(25个),主要集中在细胞过程、生物调节和生物过程调节等;涉及细胞组分有14个生物学过程,主要集中在细胞部分、细胞和细胞器;分子功能富集到的生物学过程有11个,主要集中在结合。

图2 阳性与阴性组DEGs的Venn图(A)、火山图(B)和聚类分析(C)Fig. 2 Venn diagram (A), volcano map (B) and cluster analysis (C) of DEGs in between positive and negative groups
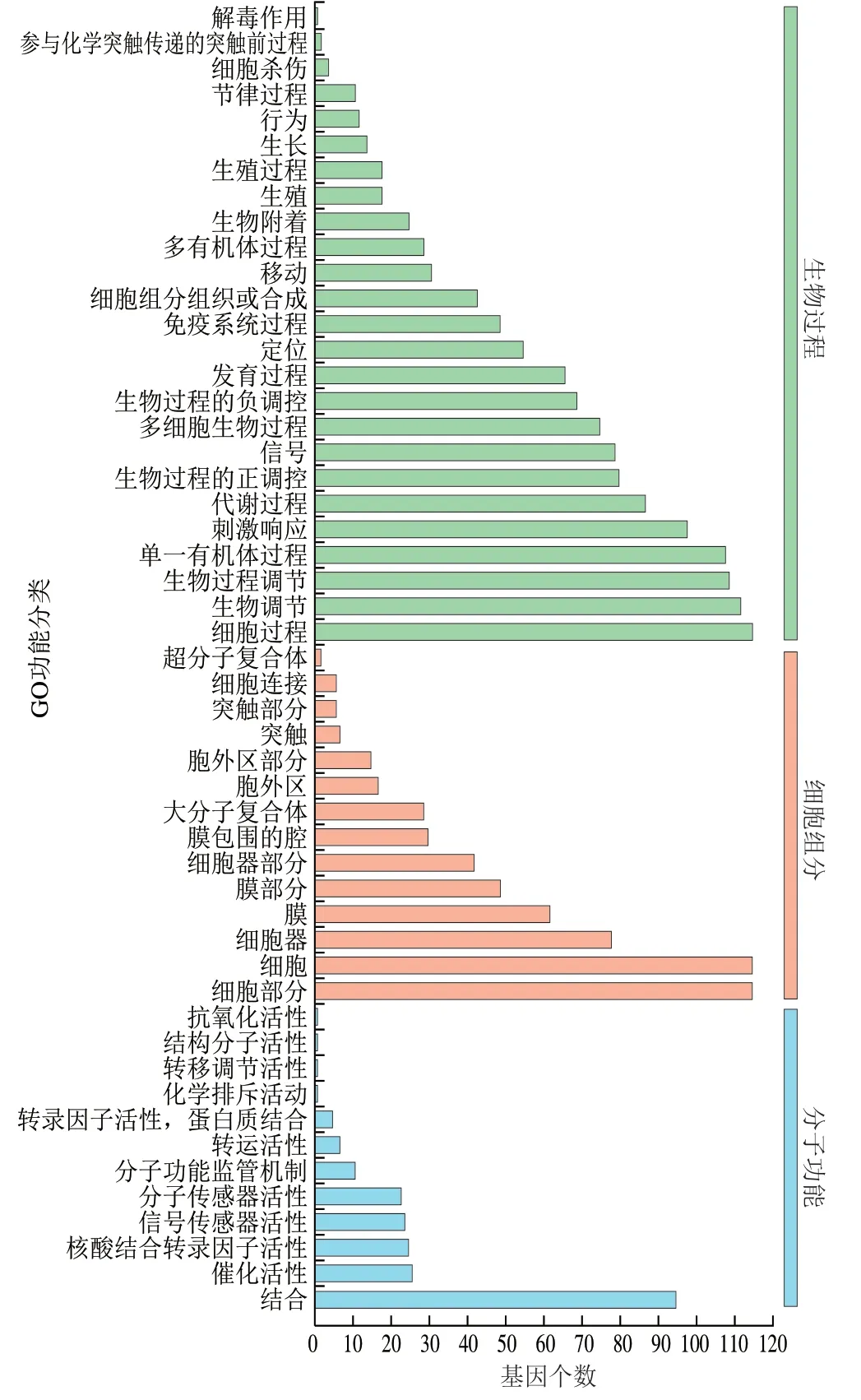
图3 阳性组与阴性组DEGs的GO生物学功能分析Fig. 3 GO biological function analysis of DEGs between positive and negative groups
2.4.2 DEGs的EggNOG功能注释
将DEGs注释到EggNOG数据库,并对DEGs的功能进行分类。由图4可知,有127个DEGs注释到EggNOG数据库,占总DEGs的54.74%,注释后的DEGs分配至13 类功能中,在不同的功能分类存在明显差异,其中细胞内运输、分泌和囊泡运输(占比最多(15.95%),其次是翻译后修饰、蛋白质折叠和分子伴侣占比9.48%,而转录占比7.76%,其余基因功能注释数目占比均在5%以下。根据注释结果得知RBL-2H3细胞激活后,转录因子细胞内运输、分泌和囊泡运输活跃,转录因子在细胞核中与DNA进行结合,使得胞内炎症介质等迅速生成与释放。Wang Chongyang等[9]的结果表明RBL-2H3细胞被激活后,一些炎症因子及介质分泌显著增多,而本课题组前期[26,28-29]的实验结果显示,在经过DNP-BSA激活后,效应细胞的β-氨基己糖苷酶、IL-4以及TNF-α等分泌明显增加。
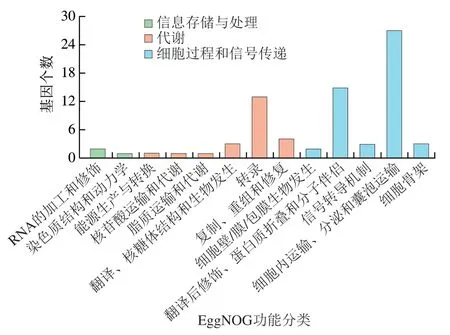
图4 阳性组与阴性组DEGs的EggNOG功能分类统计Fig. 4 COG function classification statistics of DEGs between positive and negative groups
2.5 DEGs的KEGG信号通路分析
2.5.1 DEGs的KEGG通路富集分析

图5 阳性组与阴性组DEGs的KEGG富集通路散点图Fig. 5 Scatter plot of KEGG enrichment pathway analysis of DEGs between positive and negative groups
为探寻DEGs参与的主要信号转导和生化代谢途径,进行KEGG通路富集分析,图5展示了部分信号通路,其中改变较为明显的KEGG通路为TNF信号通路、Janus激酶-信号转导与转录激活子(Janus Kinase-signal transducer and activator of transcription,Jak-STAT)信号通路、MAPK信号通路以及Toll样受体(Toll-like receptors,TLR)信号通路等。根据富集结果可以发现,效应细胞激活作用能够提高MAP3K8、Junb、Nfkbia、Jun、Fos等基因表达水平,促进TNF信号通路及下游基因表达(图5、表2),这可能是RBL-2H3细胞激活后释放炎症因子的重要原因之一。有研究证明,MAP3K8能够作为治疗过敏性疾病的一个关键靶点[30]。Chen Siyan等[31]找到与Junb相关的去泛素酶,能针对哮喘等过敏性疾病。通过KEGG通路的富集说明MAP3K8等转录因子在过敏性疾病中能够起到关键性作用,为后续寻找靶向这些转录因子药物提供一定的理论依据。

表2 与RBL-2H3激活相关的DEGsTable 2 DEGs associated with RBL-2H3 cell activation
2.5.2 DEGs的主要信号通路分析
MAPK信号通路(图6A)、Jak-STAT信号通路(图6B)、TNF信号通路(图6C)以及TLR信号通路(图6D)4 条信号通路的DEGs在阳性组和阴性组之间均显示不同的表达量,与阴性组对比,阳性组的基因表达均有所上调。MAPK是炎症反应中的典型下游信号通路[18],TNF-α在激活的RBL-2H3细胞中能检测到明显升高[9]。当RBL-2H3细胞被激活时,MAPK等信号通路的信号分子发生磷酸化,炎症因子得以产生并释放,这些信号通路是过敏反应中效应细胞激活的关键因素,相关信号分子有望成为抑制过敏反应的关键靶点。例如,Motojima等[32]报道毛蕊花糖苷能够通过下调嗜碱性粒细胞中Ca/NFAT等基因,并且通过降低JNK的磷酸化抑制MAPK信号通路,发挥减弱过敏反应的作用;Kang等[33]也研究发现,齐墩果酸抑制信号转导与转录激活因子1(STAT1)信号通路,减少促炎因子的表达,从而抑制人源肥大细胞的激活;此外,也有报道称白藜芦醇可以抑制STAT3的磷酸化,从而影响人肠组织中肥大细胞的激活[34];Xiong Wei等[35]发现右旋美托咪啶预处理能够通过下调TLR信号通路,降低心肌肥大细胞的活化,抑制炎症反应。通过本研究转录组信息分析和前人的相关研究,能够得知MAPK、Jak-STAT、TNF以及TLR信号通路在过敏反应效应细胞的激活中起到了重要作用,相关信号分子有望作为防治过敏性疾病的潜在靶点。
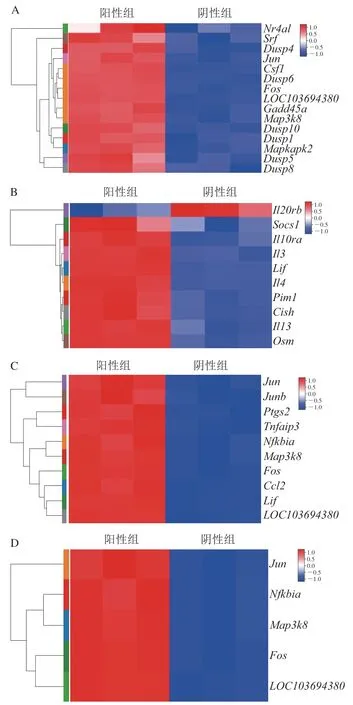
图6 MAPK(A)、Jak-STAT(B)、TNF(C)以及TLR(D)的DEGs情况Fig. 6 DEGs related to MAPK (A), Jak-STAT (B), TNF (C) and TLR (D) signaling pathways
2.5.3 DEGs的TNF信号通路图
根据KEGG富集的结果选取差异较显著的信号通路,其中差异最为明显的为TNF信号通路,TNF在维持免疫稳态和促进疾病发展中发挥重要的双重作用[36]。针对TNF信号通路,绘制具体的信号传导机制图,如图7所示,DNP-BSA能激活TNF信号通路,大致过程为在炎症反应中当TNF与其受体TNFR1结合后,通过招募TRAF2/5连接蛋白诱导下游的NIK等基因活化,使得转录因子AP-1产生量增加,而AP-1会进入细胞核,与DNA结合,促进TNF等炎症因子的释放量增加,进而产生严重的过敏反应。有研究表明TNF是关键的炎症调节因子,其通过激活2个主要信号通路,即NF-κB和MAPK实现其生物学功能[37],对于过敏反应及炎症反应都相当重要。Ling Yi等[38]发现,作为雷公藤的有效成分,山柰酚能够作用于TNF信号通路,参与调控Jun、TNFR1、TNFR2、TNF-α的表达,发挥抗炎作用;Huang Linlin等[39]发现南瓜果胶多糖通过抑制MAPK信号通路减少TNF-α的分泌,发挥免疫调节活性。这说明可以将TNF信号通路作为治疗过敏性疾病潜在的靶点。
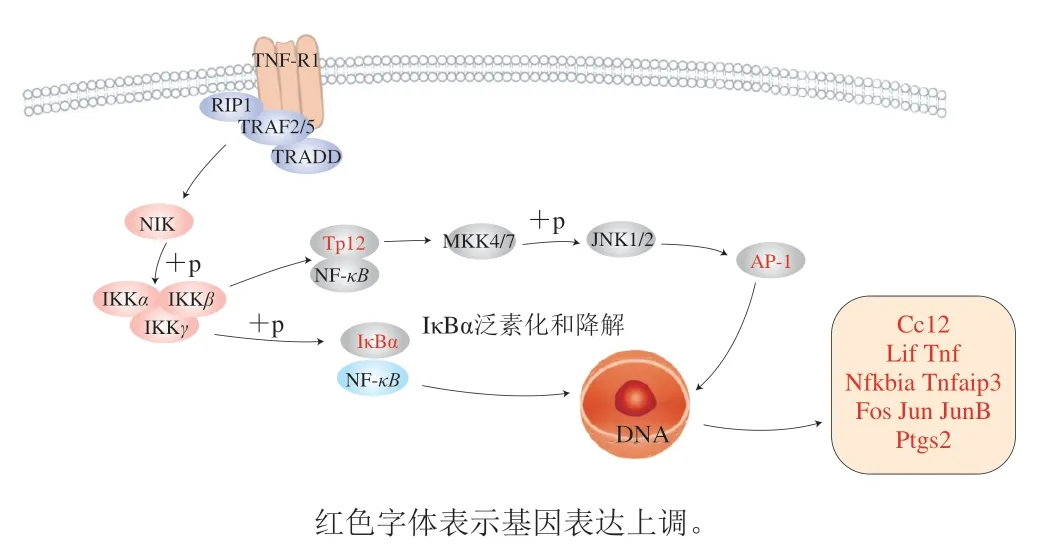
图7 DNP-BSA激活RBL-2H3细胞TNF信号通路Fig. 7 DNP-BSA promotes TNF signaling in RBL-2H3 cells
3 结 论
利用RNA-seq手段结合GO、KEGG数据库对IgE介导的RBL-2H3细胞体外过敏模型进行转录组学分析,IgE介导的RBL-2H3细胞激活后,转录水平上体现出多数基因的上调表达,共筛选得到232个表达量有显著差异的基因,其中显著上调基因214个,而显著下调的基因仅有18个;此外,DEGs的KEGG富集分析显示,RBL-2H3细胞激活参与调控的主要为TNF、MAPK和Jak-STAT等信号通路,其中TNF信号通路富集的DEGs数量最多。虽然本研究找到一些重要的转录因子,如MAP3K8、Junb、Nfkbia、Jun、Fos等,仍然缺乏足够的研究可以阐述过敏反应和这些转录因子之间的直接关系,这需要今后深入研究。本研究探讨了RBL-2H3细胞激活的分子机制,挖掘了过敏反应效应细胞激活的重要信号通路,为IgE介导的过敏反应的防控研究提供理论依据。
