绿藻栅藻对微囊藻的抑制效应及评价
2022-12-21宋婵媛李天丽宋立荣
宋婵媛 白 芳 李天丽 宋立荣
(1.大连海洋大学, 大连 116023; 2.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
水体富营养化导致的蓝藻水华已成为全球性的问题。蓝藻水华的发生严重恶化水体生态。微囊藻(Microcystis)是淡水生态系统中最常见的水华蓝藻之一, 因其产生的微囊藻毒素而备受关注[1]。微囊藻藻毒素不仅对鱼虾贝类产生毒性效应, 而且通过食物链富集于体内, 进而威胁人类饮食健康[2]。因此, 控制水体中的蓝藻水华具有重要意义。
生物控藻技术的机理是利用生态学原理, 与水华藻类竞争或通过生长抑制物质来抑制或杀灭藻类, 从而达到控藻的目的[3]。目前生物控藻方法主要包括利用水生动物的摄食作用、利用水生植物对营养盐的竞争或化感作用和利用微生物中溶藻活性物质进行控藻[4]。近年来研究发现, 利用有益藻类与有害藻类的藻间关系, 来提高共生藻的优势和藻类多样性, 从而改变水体藻类群落结构, 可以达到治理蓝藻水华的目的[5]。在实践应用中, 绿藻等有益藻类既可以作为水产动物的饵料, 也可以在养殖水体中发挥调节生态系统稳定性的功能[6]。目前市场上硅藻(Diatoms)、小球藻(Chlorella)、卵囊藻(Oocystis)等藻种已被量产作为调水剂, 用于养殖池塘的水质改善和蓝藻水华控制。
利用藻类之间的种间竞争进行生物控藻的研究主要是围绕藻类之间的化感作用展开。Qiu等[7]发现四尾栅藻(Scenedesmus quadricauda)滤液中的物质对水华微囊藻(Microcystis flos-aquae)具有抑制作用; Bittencourt等[8]研究表明单针藻(Monoraphidium convolutum)、尖胞栅藻(Scenedesmus acuminatus)的滤液中的提取物会抑制微囊藻生长; Briand等[9]研究了阿氏浮丝藻(Planktothrix agardhii)与铜绿微囊藻(Microcystis aeruginosa)之间的化感作用, 表明浮丝藻对微囊藻在生长、形态和代谢上都有影响。此外已有研究发现, 添加合适数量的波吉卵囊藻(Oocystis borgei)可能通过释放某种化学物质有效抑制对虾池塘中微囊藻的生长, 驱动对虾池浮游植物群落的演替[10]。另外, 影响藻类种间竞争结果的因素除了化感作用, 还有温度、营养盐形态及浓度等, 浮游藻类生长速率、产毒特性等也会影响种间竞争的结果[7,11,12]。在养殖水体或其他污染严重的水体中, 氨氮通常含量较高[13], 因此氨氮耐受性是野外环境中利用藻类控制有害水华蓝藻的重要特性。人工水体例如养殖池塘对溶氧的需求度较高[14], 在控制水华的同时需要考虑水体溶氧。分析已有的研究和应用现状, 可以看出, 要筛选出对微囊藻等水华种类具有显著抑制效果的藻种, 应扩大藻种的筛选数量, 多方面评估潜在优势藻种的生长生理特性和环境耐受性, 才有可能为实际应用奠定坚实的基础。
因此, 本研究将藻类之间的化感作用作为切入点, 选择7个不同属(栅藻Scenedesmus、小球藻Chlorella、角星鼓藻Staurastrum、盘星藻Pediastrum、丝藻Ulothrix、单针藻Monoraphidium和双星藻Zygnema)的绿藻和不同产毒特性的微囊藻作为研究对象。利用绿藻滤液培养筛选出对微囊藻有抑制作用的绿藻, 对其进行生长指标和部分生理指标的测定, 考察其抑制微囊藻的能力。并将其与微囊藻进行共培养, 考察其在竞争中是否具有优势, 为利用藻类种间竞争防控蓝藻水华提供理论与技术依据。
1 材料与方法
1.1 藻种及藻种培养
本研究所用绿藻(表1)和微囊藻均来自国家水生生物种质资源库—淡水藻种库[15](湖北武汉)。其中, 两株微囊藻FACHB-3550和FACHB-905的毒素含量分别为1876.66和4711.69 μg/g DW。所有藻株均使用BG11培养基, 在温度(25±1)℃、光强35 μmol/(m2·s), 光暗比12h﹕12h条件下进行培养。
1.2 对微囊藻具抑制效应的绿藻筛选
为筛选出对微囊藻生长产生抑制效应的绿藻,对34株绿藻进行30d的培养(表1), 设置滤液处理组与对照组进行实验。其中, 滤液为藻液经孔径1.2 μm的GF/C滤膜(Whatman, 英国)抽滤后所得, 并进行营养盐的补加, 以确保与对照组营养盐水平一致,对照组为普通BG11培养基。实验在24孔板(Corning, 美国)中进行, 体积为2 mL, 每个组设置4个平行。所有实验组均分别接入处于对数期的微囊藻,初始接种密度为1×106cells/mL。所有组别设置4个平行, 培养条件同上。接种后每隔24h使用酶标仪(Molecular Devices, 美国)对微囊藻的OD680进行测定。比生长速率(μ)计算公式为μ=(lnW2–lnW1)/(t2–t1),W1表示t1时的OD680,W2表示t2时的OD680,t1和t2分别为0和96h。细胞的生长抑制率(Inhibition Rate,IR)通过如下公式计算:IR=(N0–Ns)/N0×100%。式中,N0和Ns分别为对照组和处理组的比生长速率。

表1 用于筛选对微囊藻生长具抑制效应的34株绿藻信息Tab.1 Information of 34 strains of green algae used to screen for inhibitory effects on the growth of M.aeruginosa
1.3 所筛选藻株抑藻物质的探究
为探究具抑制效应藻株FACHB-1229滤液中的作用物质, 将培养30d的藻株胞外滤液(约500 mL)进行富集, 使用HLB小柱(Waters, 美国)进行固相萃取, 使用前小柱用4 mL甲醇活化再用4 mL纯水清洗。用25 mL二氯甲烷洗脱两次后, 旋转蒸发仪蒸干, 加入1 mL色谱级二氯甲烷复溶并离心获取上清液, 然后通过气相色谱质谱联用仪(GC-MS)(Thermo scientific, 美国)进行分析。色谱条件: 使用TG-5SILMS型毛细管色谱柱(0.25 mm×30 m, 0.25 μm); 程序升温方法为初始温度50℃, 保持5min, 再以8℃/min升至290℃, 保持3min; 载气氦气(99.999%), 体积流量1 mL/min; 进样量1 μL; 进样温度及检测器温度均为250℃; 不分流进样。质谱条件: EI离子源70 eV;离子源温度300℃; 传输线1、2、3温度均为250℃;溶剂延迟时间3min; 全扫描采集模式, 质量范围m/z50—650。以滤液不抑制微囊藻生长的藻株盘星藻FACHB-492作为对照, 分析两株藻株中的差异物质, 对比文献进行分析, 获取可能具抑制作用的成分。
1.4 对所筛选藻株的评价
所筛选藻株的生长及部分生理特性的测定为探究所筛选藻株的生长特性, 对其生长速率进行测定。将对数期藻细胞转移至24孔板(2 mL体系)中,接种初始密度OD680为0.2, 设置3个平行, 每3天使用酶标仪测定OD680。
为探究所筛选藻株野外应用潜力, 考虑到养殖水体中氨氮含量较高、对溶氧的需求较高, 本研究对藻株氨氮耐受性和光合放氧速率进行测定。首先, 依据BG11培养基NaNO3的N水平, 使用NH4Cl进行N源替代并设置不同浓度, 分别为0、94.43、188.86、472.15、944.30 和1888.60 mg/L。另通过补加NaCl以保持不同处理培养基的渗透压相同。所有组别设置4平行, 计算96hμ值。对光合放氧速率的测定通过Clark氧电极(Hansatech, 英国)进行,方法参照文献[16], 光合放氧速率[μmol O2/(mg Chl.a·h)]=实验测得放氧速率/叶绿素含量。叶绿素含量使用80%丙酮进行抽提[17]。
所筛选藻株与微囊藻的共培养为进一步确定所筛选藻株的生物学特性是否可促进其在与微囊藻的竞争中占优, 本研究将前期筛选出的栅藻FACHB-1229分别与2株不同产毒特性的微囊藻进行24孔板共培养实验。初始接种密度各为1×106cells/mL, 栅藻与微囊藻细胞数比例为1﹕1。以微囊藻和绿藻的单种培养作为对照, 初始接种密度均为2×106cells/mL。所有组别均设置4个平行, 依据藻细胞大小和自发荧光的差异, 利用流式细胞仪(Beckman, 美国)进行分群并计数。
1.5 数据处理
所有实验数据均为平均数±标准误。在比较处理组和对照组差异时, 采用单因素方差分析(ANOVA),P<0.05为显著性差异。使用GraphPad Prism 8(GraphPad Softwar, 美国)进行数据的分析和图形的绘制。使用CytExpert(Beckman, 美国)对流式细胞仪数据进行分析。
2 结果
2.1 对微囊藻具抑制效应的绿藻筛选
结果如图1所示, 34株绿藻的滤液对微囊藻的生长效应不尽相同, 且整体无规律性。栅藻FACHB-1229、FACHB-1235、FACHB-1974和角星鼓藻FACHB-523、FACHB-1084、FACHB-1126的滤液可对两株微囊藻的生长产生不同程度的抑制。其中, 栅藻FACHB-1229滤液对微囊藻FACHB-3550、FACHB-905的抑制作用最强, 抑制率分别为53.95%和48.39%。因此, 后续研究将主要围绕栅藻FACHB-1229藻株进行。
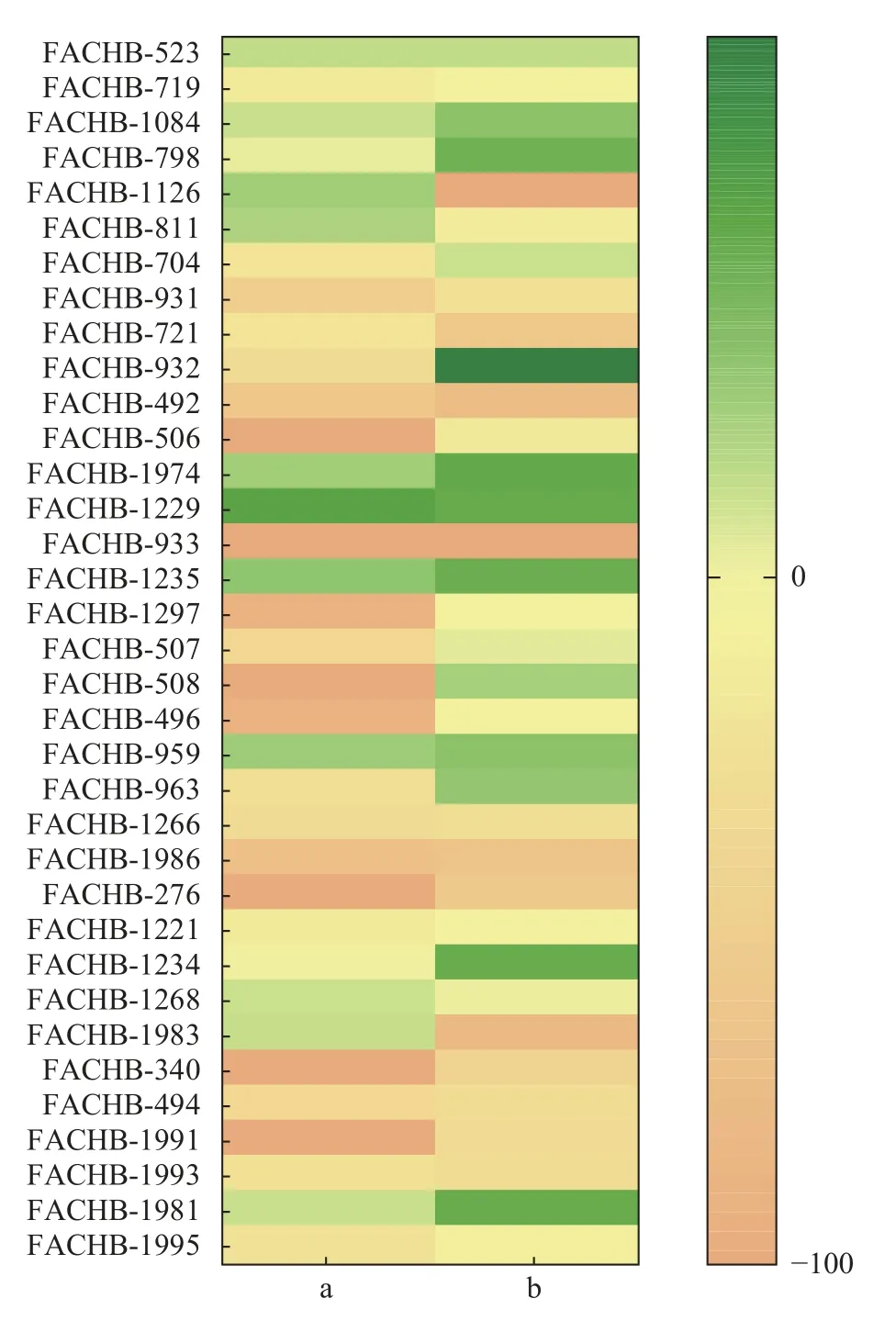
图1 34株绿藻滤液对微囊藻FACHB-3550 (a)和FACHB-905(b)的生长效应热图Fig.1 Heat map of the growth effect of 34 strains of green algae spent medium on M.aeruginosa FACHB-3550 (a)and FACHB-905 (b)
2.2 栅藻FACHB-1229滤液抑藻物质鉴定
通过GC-MS物质分析结果可得, 有抑制作用与无抑制作用的藻液滤液中差异物质共17种, 主要为酯类、烃类、胺类和醛类等物质(表2)。根据文献[19]报道的对微囊藻具有抑制作用的物质推测, 邻苯二甲酸二(2-甲氧基乙基)酯(1,2-Benzenedicarboxylic acid, bis(2-methoxyethyl)ester)可能为栅藻FACHB-1229滤液中抑制微囊藻生长的物质。
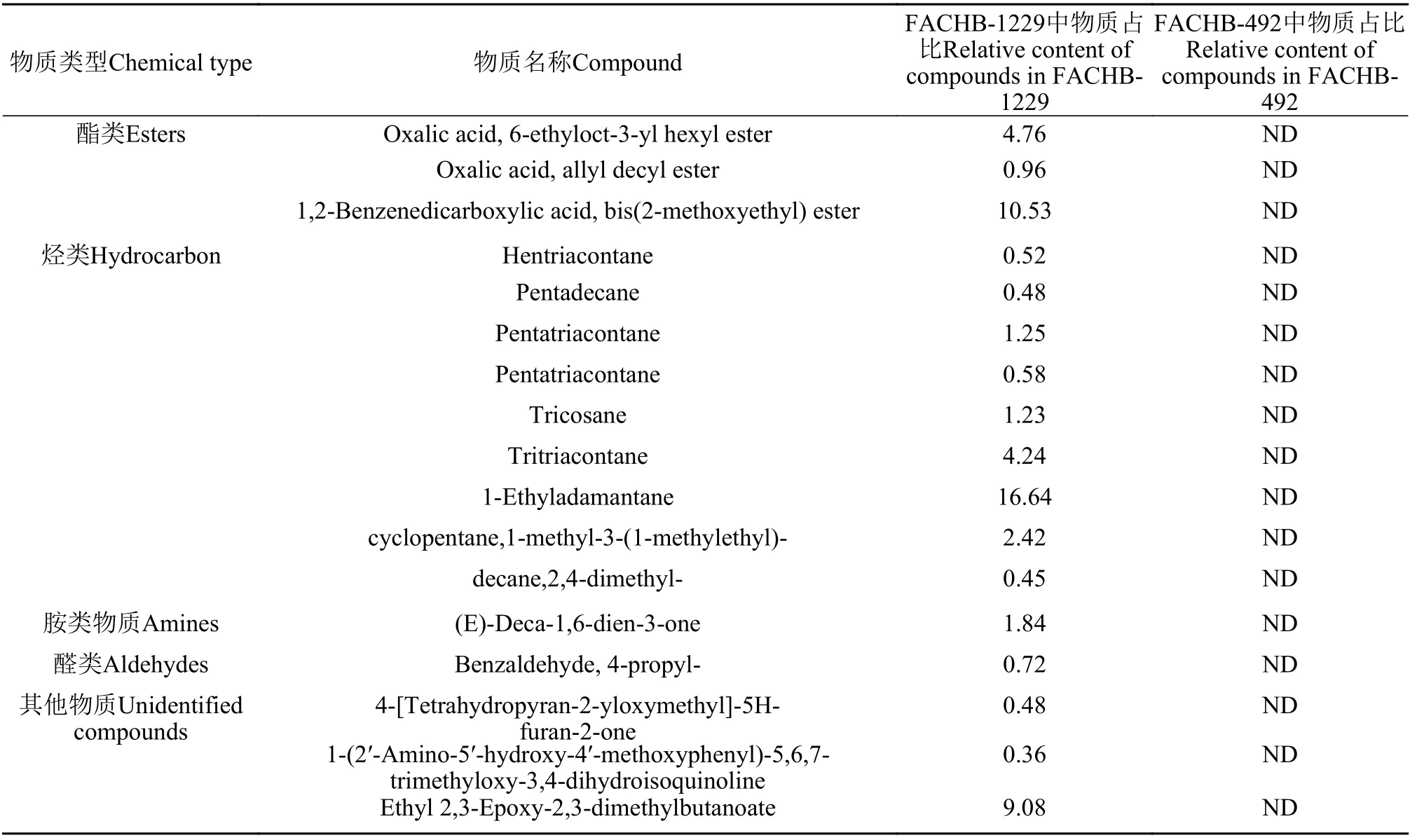
表2 具抑制效应藻株FACHB-1229和无效应藻株FACHB-492滤液GC-MS分析结果差异物质及占比Tab.2 Relative content of compounds (%)analyzed using GC-MS in FACHB-1229 and FACHB-492
2.3 对栅藻FACHB-1229的评价
栅藻FACHB-1229生长及部分生理特性生长速率的结果表明, 栅藻FACHB-1229的μ值(0.38±0.06/d)大于微囊藻FACHB-3550和FACHB-905的μ值[均为(0.13±0.03)/d, 图2]。

图2 FACHB-1229和微囊藻FACHB-3550、FACHB-905的生长速率Fig.2 Growth rates of FACHB-1229, M.aeruginosa FACHB-3550 and FACHB-905 in 24-well microplates
对氨氮耐受性测定结果表明, 随着氨氮浓度的逐渐上升, 三株栅藻的生长速率仍然较高, 而作为对照的微囊藻生长逐渐受抑制。在氨氮浓度为1888.60 mg/L(相当于BG11中N含量的两倍)时, 三株栅藻的生长速率高于微囊藻, 此时栅藻FACHB-1229的生长速率最高, 可达(0.30±0.08)/d, 表明其对高浓度氨氮耐受能力较强。在光合放氧方面, 栅藻FACHB-1229的光合放氧速率也最高, 为(229.91±10.49)μmol O2/(mg Chl.a·h)(图3), 大于同时测定的其他2株栅藻(FACHB-1606和FACHB-1602)和3株小球藻(FACHB-1552、FACHB-1554和FACHB-1580)。
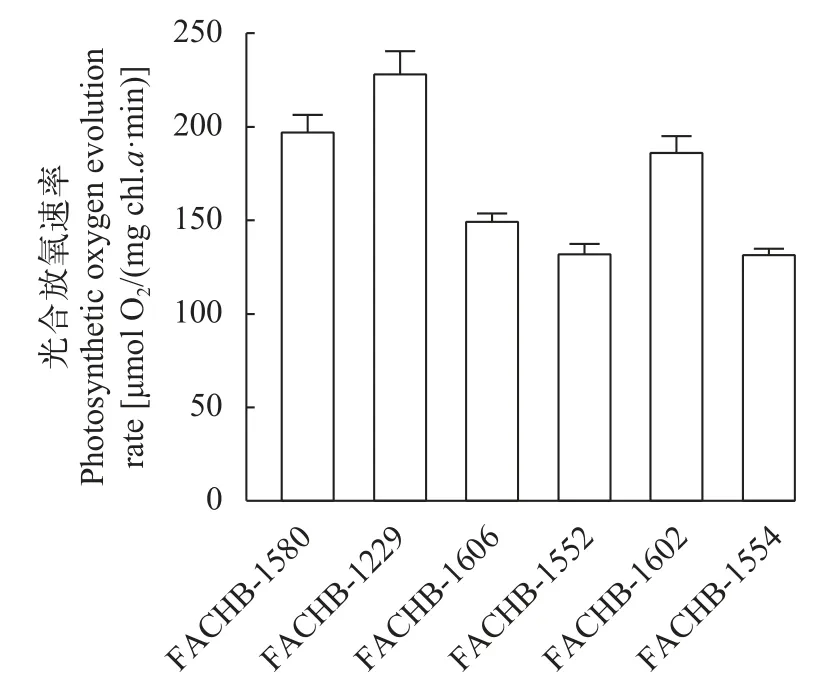
图3 6株绿藻光合放氧速率Fig.3 Photosynthetic oxygen evolution rate of 6 strains of green algae
孔板体系的栅藻FACHB-1229与微囊藻共培养共培养结果显示, 当与低毒微囊藻FACHB-3550共培养第6天时, FACHB-1229所占比例从初始的33.52%上升至51.03%(图4); 而当与高毒微囊藻FACHB-905共培养时, 栅藻所占比例浮动较小, 仅从共培养第0天的36.90%变化至第6天的31.80%(图5)。
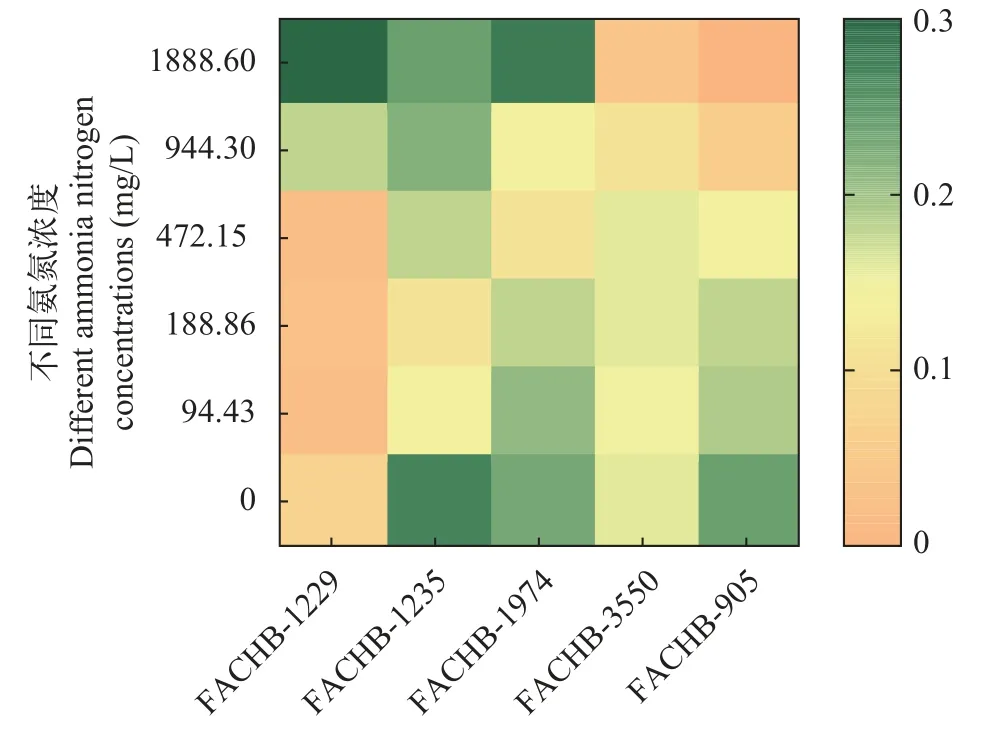
图4 4株栅藻和2株微囊藻在不同氨氮浓度下的生长速率Fig.4 Growth rates of 4 strains of Scenedesmus sp.and 2 strains of M.aeruginosa in media with different ammonia nitrogen concentrations
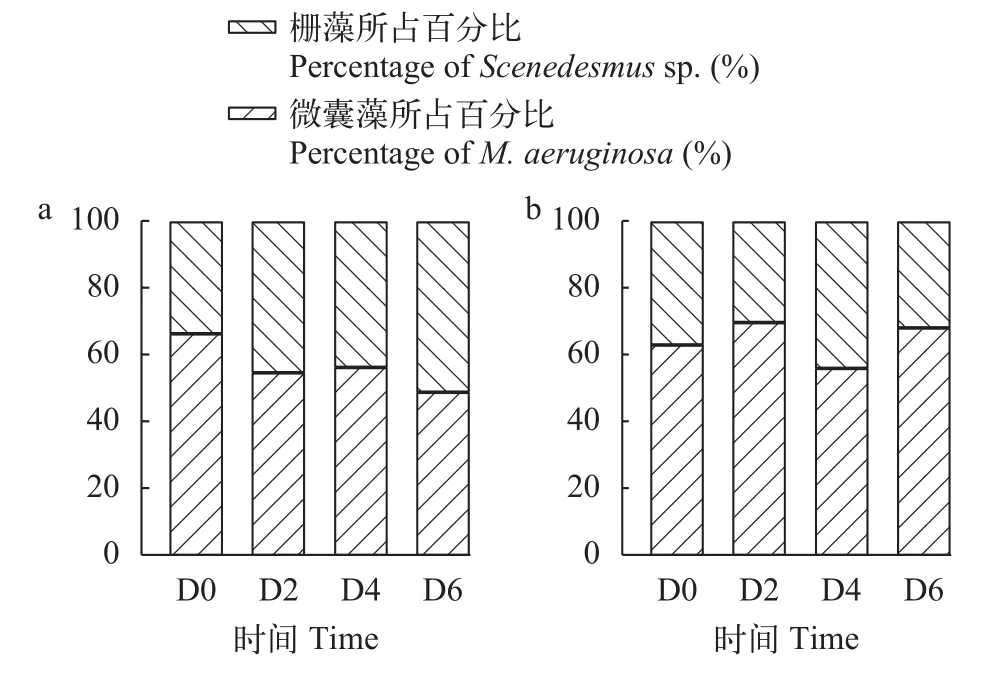
图5 栅藻FACHB-1229分别与低毒微囊藻FACHB-3550(a)和高毒微囊藻FACHB-905(b)共培养条件下细胞所占比例变化Fig.5 Percentage of cells in co-culture conditions of Scenedesmus sp.FACHB-1229 with M.aeruginosa FACHB-3550 (a)and M.aeruginosa FACHB-905 (b), respectively
3 讨论
本研究以种间竞争的生态学原理为出发点, 利用绿藻滤液培养微囊藻, 筛选出对微囊藻具有抑制作用的栅藻FACHB-1229, 对其滤液中的抑藻物质进行测定。同时, 对该藻株的生长和氨氮耐受能力、光合放氧能力等生理指标进行评价, 进一步通过与微囊藻的共培养竞争实验探究其与微囊藻的竞争能力。
3.1 具微囊藻抑制效应绿藻的筛选及抑藻物质探究
蓝藻和绿藻的相互作用是极为复杂的。已有大量的文献发现, 微囊藻的滤液可显著抑制其他绿藻(如四尾栅藻、蛋白核小球藻Chlorella pyrenoidosa)的生长[20,21]。其中, 微囊藻毒素、其他多肽物质(如cyanopeptolins、cyanobactins)等被认为是微囊藻抑制其他藻类生长的主要化学物质[8,21]。同样地, 也有研究报道, 一些绿藻的滤液可抑制微囊藻的生长,如Bittencourt-Oliveira等[8]报道了尖胞栅藻和单针藻的滤液可抑制微囊藻的生长, Qiu等[7]和Harel等[22]发现栅藻滤液可对微囊藻的生长产生抑制效应。本研究中也得到了类似的结果, 在所测试的34株绿藻中, 共计3株栅藻(FACHB-1229、FACHB-1235和FACHB-1974)和3株角星鼓藻(FACHB-523、FACHB-1084和FACHB-1126)的滤液可对微囊藻的生长产生不同程度的抑制(图1)。文献中提到, 对藻类具有抑制作用的化感物质包括酚类、含氮化合物、萜类物质及衍生物、有机酸、酯类等, 这些化感物质可通过影响藻类的光合作用[23]、产生氧化损伤[24]、诱导藻细胞的程序性死亡[25]、破坏微囊藻细胞结构[26]或影响其他生理生化作用从而对藻类产生抑制效应。前人对可对微囊藻产生抑制效应的绿藻滤液的化学成分分析发现, 邻苯二甲酸二丁酯、β-谷甾醇[19]和对叔丁基邻苯二酚[7]等是产生抑藻效应的主要化学物质。本研究分析物质成分的结果中,酯类物质中邻苯二甲酸二(2-甲氧基乙基)酯与并联藻(Quadrigula chodatii)中报道的邻苯二甲酸二丁酯同属于邻苯二甲酸酯, 推测其可能为滤液中抑制微囊藻生长的物质, 该物质对微囊藻的抑制机理还需后续实验进行探究。
3.2 所筛选藻株的竞争优势
在探究栅藻FACHB-1229的生长特性结果发现, 该栅藻在孔板中的生长速率(0.38±0.06)/d高于微囊藻。在后续孔板体系的共培养实验中发现, 其可抑制微囊藻所占比例的升高, 微囊藻FACHB-3550比例从66.48%下降至48.97%, FACHB-905从36.90%变化为31.80%。类似的结果在前人研究中也有体现, Ma等[21]研究发现生长速率较高的小球藻与无毒微囊藻共培养时小球藻能够占据优势;Mariana等[27]指出拟柱孢藻(Cylindrospermopsis raciborskii)对共培养中的微囊藻生长产生抑制是由于化感物质的作用; 高生长速率的斜生栅藻在与微囊藻共培养时, 在化感作用影响下微囊藻受抑制而斜生栅藻生长占据优势[28]。结合前期对栅藻FACHB-1229化感物质的探究可以推测, 栅藻FACHB-1229的化感作用及较高生长速率的特性可促使其在竞争中占优。对于影响共培养中藻株占据优势的条件, Zhang等[19]研究发现在共培养条件中下, 并联藻对微囊藻的化感作用影响了微囊藻对氮的利用进而影响了微囊藻的生长; 生长速率较高的拟柱孢藻可在与微囊藻的竞争中占据优势地位, 其主要依赖于对有机磷的特殊利用策略[11], 据此推测本研究所筛选藻株高生长速率的特性表明其对营养的运用不同, 这会促使其在竞争中占据优势地位。
3.3 所筛选藻株的生理特性
本研究对所筛选藻株和微囊藻竞争的不同营养形式及浓度的探究围绕氨氮展开, Dai等[29]认为氨可能是决定淡水系统中常见藻类物种和蓝藻水华分布的关键因素。已有研究报道, 与微囊藻相比,斜生栅藻对氨氮的耐受性更强, 并可促使其在氨氮浓度较高的自然水体中占据优势地位[30,31]。本实验对氨氮耐受株的测定结果也发现, 栅藻FACHB-1229对高浓度氨氮的耐受性最强, 而此时微囊藻生长完全被抑制。Cheng等[32]研究发现, 蛋白核小球藻在氨氮含量较高(578.27 mg/L)的废水中培养8d后对氨氮的去除率可达82.2%, 故对于本研究所筛选的栅藻FACHB-1229来说, 对微囊藻的化感作用及对高氨氮耐受的特性, 使其可以在抑藻的同时,还能降低养殖水体中氨氮含量。此外, 芦尚德等[33]研究表明, 绿藻可通过固定化技术培养并应用于养殖水体中, 可作为生物供养剂解决生态养殖的缺氧问题。通过测定藻株的光合放氧速率计算可知, 在无损耗状态下, 投加10 mg生物量(叶绿素a)的FACHB-1229藻液1h后可释放73.57 g的氧气。综合此藻株滤液对微囊藻的抑制效应和较高的光合放氧能力, 未来可通过对培养投放技术的进一步优化,促使栅藻FACHB-1229在野外应用中作为养殖池塘控藻增氧的潜在绿藻之选。
3.4 所筛选藻株的应用潜力
值得注意的是, 自然水体的微囊藻水华经人工控制(如化学法)后, 栅藻类绿藻常常是最先出现的藻类(结果未发表), 表明这些栅藻具有与微囊藻共存甚至竞争的潜力。因此, 除可以利用FACHB-1229对微囊藻的化感作用进行控藻之外, 还可以在使用物理或化学方法降低微囊藻生物量后, 利用FACHB-1229的高生长速率及耐氨氮特性在水体中快速生长, 使其在水体中占据优势, 压制微囊藻的再次生长, 进而起到增加水体溶解氧、调整水体浮游植物结构和调节水质等作用。
4 结论
对蓝藻和绿藻种间竞争的研究已有诸多报道,涵盖营养盐、温度、他感物质等多个方面, 但多聚焦探讨有害蓝藻如何在竞争中获优, 鲜少有将种间竞争应用于有害蓝藻的控制的相关研究。如何利用藻间化感作用和绿藻的生理优势, 建立以有益绿藻为优势种的浮游植物群落, 最终形成生态平衡的水体, 我们认为需要从以下几个方面进行: (1)探究可促使绿藻产生化感物质的最适营养条件和温度;(2)对可抑制有害蓝藻生长的绿藻滤液中的效应物质进行分离并鉴定, 以期实现工业化生产, 辅助加入以协助绿藻占据优势; (3)建立不同藻类的生长参数指标与种间竞争能力的关系指数, 以便更科学地预测加入绿藻后浮游植物群落的结构变化。而本研究选取不同类型绿藻进行优良藻株的筛选并进行初步的评价, 正是此工作的第一步, 实验表明栅藻FACHB-1229可作为优良藻株的备选。未来将对备选藻株产生的化感物质进行进一步的研究, 深入探讨作用途径和机理, 同时开展野外水体样品的应用验证以检验其应用潜力, 为利用种间竞争的生态学原理进行有害蓝藻的控制技术提供理论基础。
