厚壳贻贝新型抗菌肽myticalin和mytimacin的分子鉴定
2022-12-21杨金月阳宗欣何建瑜张晓林何梦岚严小军
刘 璐 杨金月 阳宗欣 何建瑜 张晓林 何梦岚 严小军 廖 智
(浙江海洋大学海洋科学与技术学院, 海洋生物资源与分子工程研究室, 舟山 316022)
贻贝是我国东部海域重要的养殖贝类之一, 具有重要的经济价值。目前, 在牡蛎, 蛤类等代表性贝类的养殖过程中已显现出大规模病害的威胁, 并因此对贝类养殖产业带来严重影响[1—4]。但值得注意的是, 与其他贝类相比, 贻贝在养殖过程中表现出对疾病的较强耐受性[4—6], 目前尚无贻贝属(Mytilus)大规模病害的报道[4,5]。这表明, 与其他贝类相比, 贻贝的免疫系统可能具有其独特性, 因此,贻贝已成为海洋生物免疫相关研究的重要对象[6—10]。以往的研究表明, 贻贝的免疫系统组成较为复杂,包括黏液免疫系统、细胞免疫系统及体液免疫系统[11], 涉及免疫识别、免疫信号传递和免疫效应发挥等不同阶段。 涉及的具体免疫分子机制包括免疫细胞聚集、免疫细胞吞噬等细胞免疫过程, 以及酚氧化酶、氮自由基、裂解酶, 抗菌肽等分子免疫机制[7,11—13]。其中, 贻贝抗菌肽在贻贝的免疫系统中负责对入侵微生物的直接杀伤和抑制, 且其结构和功能具有较强的分子多样性。目前已先后有10种不同类型的贻贝抗菌肽被报道[7]。其中, mytilin、myticin、mytimycin和Mytilus galloprovincalisdefensin (MGD)是最早从地中海贻贝(Mytilus galloprovincalis)血清中被分离得到[14—17]; 之后, myticusin和mytichitin从厚壳贻贝血清中分离得到[18,19]; 此外, 又陆续从地中海贻贝组织转录组中预测到big defensin、mytimacin、myticalin和arthropod like defensin (ALD)四种贻贝抗菌肽序列[7,20,21]。从已有研究结果来看, 贻贝抗菌肽不仅家族数众多, 且在同一家族内也表现出极强的分子多样性[22,23]。丰富的贻贝抗菌肽分子类型为新型生物抗生素的研发提供了重要的先导分子来源。
厚壳贻贝(Mytilus coruscus)是我国东部海域最重要的养殖贝类之一, 也是西太平洋沿岸的代表性贻贝物种。此前已鉴定厚壳贻贝抗菌肽mytilin[24]、myticin[25]、myticusin[18,26]及mytichitin[27]。但与其他贻贝属物种, 如地中海贻贝(M.galloprovincalis)和紫贻贝(M.edulis)相比, 厚壳贻贝中抗菌肽研究仍存在很大空间。为进一步挖掘厚壳贻贝新型抗菌肽分子, 通过对厚壳贻贝基因组[28]及血细胞转录组[29]进行数据筛选, 从中获得两种新型的厚壳贻贝抗菌肽分子。序列分析结果表明, 该新型抗菌肽与地中海贻贝已报道的myticalin[20]和mytimacin[21,30]具有较高的序列相似性。myticalin是一种首次从贻贝中发现的, 其成熟肽序列中不含二硫键的抗菌肽, 对革兰氏阳性和革兰氏阴性菌均具有抑制作用[20]。而mytimacin则是一种富含半胱氨酸并形成多对二硫键的抗菌肽家族, 从结构上看, 属于macin抗菌肽家族。macin家族抗菌肽首次发现于环节动物Theromyzon tessulatum, 具有多对二硫键以及对革兰氏阳性菌较强的抑制活性[31,32]。此外, 软体动物, 如贝和螺类中也均发现macin抗菌肽的存在[33,34], 表明macin是一种低等生物中较为保守的抗菌肽。myticalin和mytimacin抗菌肽在厚壳贻贝中的发现, 丰富和拓展了对贻贝抗菌肽分子多样性的认识, 但这两种抗菌肽的分子特征及其对厚壳贻贝免疫防御的贡献目前尚不清楚。为此, 对厚壳贻贝myticalin和mytimacin开展了序列分析, 固相化学合成及功能验证, 以及在不同微生物诱导后, myticalin和mytimacin的免疫响应研究。结果表明, 厚壳贻贝myticalin和mytimacin分别与地中海贻贝的myticalin和mytimacin具有较强的序列相似性, 结构预测结果表明上述两种抗菌肽具有不同的空间结构; 化学合成的myticalin和mytimacin具有广谱的抑菌活性。此外, myticalin和mytimacin在应对不同微生物诱导时具有不同的免疫响应特征。上述研究一方面为深入了解厚壳贻贝的抗菌肽分子多样性及myticalin和mytimacin在贻贝免疫过程中的分子角色奠定了基础, 也为后续开发厚壳贻贝新型抗菌肽为来源的生物抗生素提供了科学依据。
1 材料与方法
1.1 厚壳贻贝血细胞转录组数据挖掘与序列分析
根据厚壳贻贝血细胞转录组所测63942条unigene[29], 根据其序列的注释结果, 利用BlastX程序从中筛选myticalin和mytimacin基因序列, 阈值(Evalue)为1E-05。将筛选到的基因序列对比厚壳贻贝基因组数据库以验证序列的完整性, 选择开放阅读框完整的myticalin和mytimacin基因序列代表性序列开展后续分析。其中, 开放阅读框采用Lasergene软件的Editseq模块(版本7.1.0)进行分析。氨基酸序列中的成熟肽、结构域和信号肽预测分别采用ProP软件[35]、SMART软件 (http://smart.emblheidelberg.de/)及SignalP 4.0软件[36]进行分析。蛋白质二级结构和三级结构分别利用Prabi (http://pbil.ibcp.fr/)及SWISS MODEL服务器在线进行预测。多序列比对采用CLUSTALO软件 (https://www.ebi.ac.uk/Tools/msa/clustalo/)在线进行。
1.2 固相多肽化学合成及鉴定
多肽固相化学合成参照文献[37], 在十二通道半自动多肽合成仪(上海强耀)上合成, 合成方向为从羧基端向氨基端进行。合成后的线性多肽粗品以高效液相色谱仪(Agilent 1260, 美国安捷伦公司)进行分离纯化, 采用C18分析型反相柱 (Kromasil 100-5, 4.6 mm×250 mm, 5 μm)进行分离, 洗脱液分别为A液 (含0.1%TFA的纯水)和B液 (含0.1%TFA的乙腈); 其中, myticalin合成产物的洗脱梯度为20min内B液比例由20%上升到80%; mytimacin合成产物的洗脱梯度为25min内B液比例由15%上升到40%; 流速均为1.0 mL/min; 采用紫外检测器进行检测, 检测波长为 280 nm。收集洗脱目标峰开展质谱分析, 采用质谱 (Agilent-6125B, 美国安捷伦公司)对合成后的多肽纯品进行精确分子量鉴定, 质谱检测条件参照文献[37]进行。参照文献[37]方法对合成后的多肽样品开展基于谷胱甘肽的氧化复性。复性后的多肽进一步经高效液相色谱纯化后开展功能分析。
1.3 抑菌活性测试
参照文献[38]方法, 采用生长曲线抑制法对复性后的myticalin和mytimacin开展抑菌活性测试。myticalin和mytimacin以生理盐水分别配置成200、100、50、25、12.5、6.25、3.13、和1.56 μmol/L浓度梯度。测试菌种购自北京中国普通微生物菌种保藏管理中心, 包括5种革兰氏阴性菌, 分别为大肠杆菌Escherichia coli、铜绿假单胞菌Pseudomonas aeruginosa(ATCC9027)、哈维氏弧菌Vibrio harveyi(ATCC33842)、溶藻弧菌Vibrio alginolytica(ATCC19659)和副溶血弧菌Vibrio Parahaemolyticus(ATCC17802); 4种革兰氏阳性菌, 分别为巨大芽孢杆菌Bacillus megaterium(ATCC19161)、金黄色葡萄球菌Staphylococcus aureus(ATCC25923)、枯草芽孢杆菌Bacillus subtilis(ATCC19659)和藤黄叠球菌Sarcina lutea(ATCC4698); 真菌为白色念珠菌Candida albicans(ATCC10231)。
1.4 红细胞毒性分析
取绵羊血 (购自南京森贝伽生物科技有限公司), 离心 (1000×g, 10min, 4℃)收集红细胞, 以PBS缓冲液 (pH 7.4)洗涤3次, 之后以PBS缓冲液(pH 7.4)重悬细胞制备成1% 红细胞悬浮液。合成的myticalin和mytimacin以PBS缓冲液 (pH 7.4)配置成1 mmol/L浓度, 按照1﹕9比例分别加入抗菌肽溶液和红细胞悬浮液, 抗菌肽终浓度分别为100、50、25、12.50、6.25、3.13、1.56和0.78 μmol/L浓度梯度, 以 PBS缓冲液(含0 μmol/L抗菌肽)为阴性对照, 以 triton X-100为阳性对照。37℃培养4h后取出, 经离心 (1000×g, 10min, 4℃)后, 上清液转移至96孔板, 以酶标仪于波长405 nm处测定吸光度。抗菌肽溶血率按照 (检测孔A405–阴性孔A405)/(阳性孔A405–阴性孔A405)×100%进行计算。
1.5 扫描电镜观察
以溶藻弧菌、金黄葡萄球菌和白色念珠菌作为指示菌, 分别加入myticalin和mytimacin (100 μmol/L); 孵育8h后, 离心收集菌体, 经4%多聚甲醛固定后, 参照文献[37]方法对其开展扫描电镜(Nova nano SEM 450, 美国FEI)观察。
1.6 荧光定量PCR分析
根据厚壳贻贝myticalin和mytimacin序列中开放阅读框序列设计特异性引物 (表1), 参照文献[37]方法进行PCR扩增及测序分析。进一步设计荧光定量PCR引物 (表1)并开展myticalin和mytimacin的基因表达分析。细菌诱导实验参照文献[39]进行。诱导微生物包括金黄色葡萄球菌、溶藻弧菌和白色念珠菌, 诱导后分别于0.5h、1h、2h、 4h、8h、12h、24h、48h 和72h, 采集厚壳贻贝血淋巴, 血淋巴经离心 (1500×g, 10min, 4℃)后获得血细胞。对血细胞进行总RNA提取和逆转录, 所得血细胞cDNA作为模板开展后续荧光定量PCR分析。
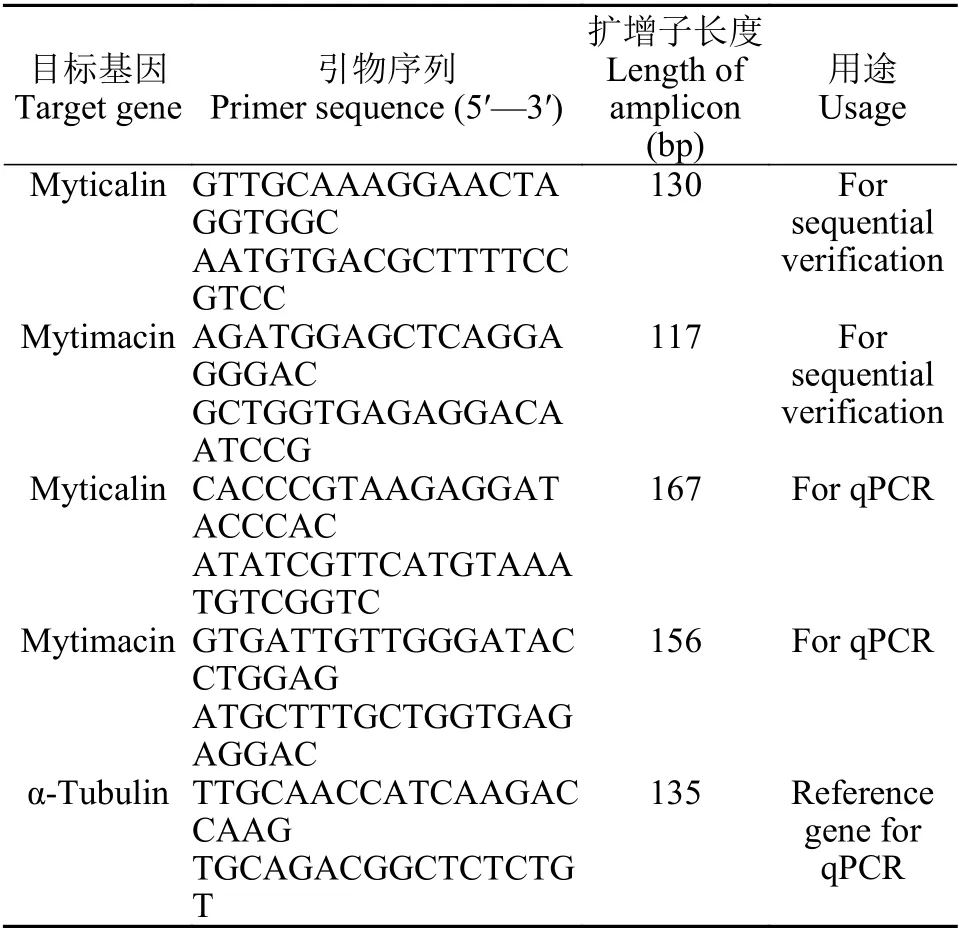
表1 荧光定量PCR研究的特异性引物Tab.1 Primers for qPCR analysis
荧光定量PCR参照文献[37]方法在实时定量PCR系统 (MX3000P, 美国Stratagene公司)进行。表达量依据Ct值采用2–∆∆Ct方法[40]进行分析。采用3次重复试验, 所得数据以SPSS 软件(v25.0)的Oneway ANOVA方法进行显著性差异分析,P<0.05代表具有显著性差异。
2 结果
2.1 厚壳贻贝myticalin和mytimacin的序列特征
两种新型厚壳贻贝抗菌肽序列已上传, 其在GenBank数据库中的编号分别为MW922042.1/QXT 26521.1 (myticalin)和MW922041.1/QXT26520.1(mytimacin)。myticalin基因开放阅读框长度为336 bp,编码一条113个氨基酸残基组成的前体多肽, 包括23个氨基酸残基组成的信号肽、37个氨基酸残基组成的成熟肽和53个氨基酸残基组成的pro区。myticalin成熟肽理论分子量为4459.25 Da, 理论等电点为12.30, 属于碱性多肽; 其成熟肽序列中含量最丰富的氨基酸为脯氨酸, 其含量达到28.6%, 此外, 精氨酸含量也较高, 达到19.1%。mytimacin基因开放阅读框长度为261 bp, 编码的前体肽长度为86个氨基酸残基, 包括22个氨基酸残基组成的信号肽, 17个氨基酸残基组成的pro区和47个氨基酸残基组成的成熟肽。其成熟肽序列中含有6个半胱氨酸, 推测形成3对二硫键。此外, mytimacin成熟肽序列中甘氨酸和丝氨酸含量较丰富, 占比均为12.8%; 其理论分子量为5232.08 Da, 理论等电点为9.20, 属碱性多肽。
二级结构预测结果表明, myticalin前体肽序列的二级结构以无规卷曲为主, 占比达到88.57%。其前体肽序列中, 除信号肽之外无其他可预测的结构域, 但是存在低复杂度区域(Low complexity region),其位置分别在25—54号残基和64—76号残基, 其特征在于富含脯氨酸和天冬氨酸。在mytimacin序列中, Alpha螺旋区含量占比10.64%, 完全伸展区占比19.15%, 无规卷曲占比53.19%。其前体肽序列中含有一个典型的macin结构域 (结构域编号: PF14865),其位置位于前体肽的29—85号残基。Macin结构域是一种由二硫键维持其稳定的致密结构域, 含macin结构域的蛋白通常均具有抑菌活性, 如theromain、neuromacin和hydramacin-1等[33,34,41]。在结构上, macin结构域的典型特征在于形成一个二硫键稳定的α/β超二级结构模体[41]。
三级结构预测结果表明, myticalin在其成熟肽序列中无半胱氨酸及由此形成的二硫键, 且序列中存在丰富的脯氨酸, 因而整体结构呈现无规卷曲状态, 但不排除局部肽段形成α-螺旋。由于myticalin在三级结构预测中无合适的模板结构, myticalin的三级结构采用从头预测 (De novo)手段进行预测, 因此, 其结果与二级结构预测结果并不完全一致; mytimacin的三级结构呈现典型的二硫键稳定α/β结构[42]。 其三级结构特征包括均包含一段位于序列N端的2段反平行β-折叠和C端的α-螺旋, 且三级结构预测结果与二级结构预测结果具有类似特征。
对myticalin和mytimacin的前体肽序列的同源搜索比对结果表明, myticalin与来自贻贝属的myticalin具有较高序列相似性, 其序列一致性达到70%以上, 其保守区域主要集中在信号肽及pro区, 而成熟肽序列差异较大。而mytimacin则与来自贻贝属、牡蛎属及蛤类的mytimacin具有较高序列相似性, 特别是在序列中段, 即macin结构域所在区域具有较高的保守性。
2.2 myticalin和mytimacin的固相化学合成
为检测myticalin和mytimacin的抑菌活性, 采用固相多肽合成策略, 完成对这两种抗菌肽的成熟肽区序列的化学合成。由图1可知, mytimacin合成后的粗品经高效液相色谱纯化, 其目标峰出峰时间为9.28min, 根据曲线下面积计算, 其纯度达到95%以上; 质谱鉴定结果表明, 合成的mytimacin分子量为5232.07 Da, 与理论分子量(5232.08 Da)一致 (图1A);合成的myticalin经高效液相色谱纯化, 其纯度达到96%以上, 其质谱鉴定分子量为4459.40 Da, 与理论分子量(4459.25 Da)一致 (图1B)。

图1 固相化学合成myticalin (A)和mytimacin (B)粗品的HPLC纯化与分子量质谱鉴定Fig.1 Purification of solid chemical synthesized myticalin (A)and mytimacin (B)by HPLC and the mass spectrum of the fraction collected from HPLC elution
2.3 化学合成的myticalin和mytimacin的抑菌活性
厚壳贻贝myticalin和mytimacin分子经化学合成后进行氧化复性, 进一步通过高效液相色谱法对复性后的多肽进行纯化。由图2可知, 复性后的多肽经C8反相柱分离后, 纯度较高, 可用于后续抑菌活性实验。myticalin和mytimacin的抑菌活性结果见图3, 合成的myticalin对不同微生物的抑菌活性存在差异, 其最低抑菌浓度(Minimal inhibitory concentration, MIC)在1.56—200 μmol/L。其中, myticalin对巨大芽孢杆菌和藤黄叠球菌抑制活性较强, 其MIC值低于8 μmol/L; 而对革兰氏阳性菌的抑制活性普遍较弱, 其最低抑菌浓度均在50 μmol/L及以上;而对白色念珠菌则只有微弱抑制活性, 其MIC值达到200 μmol/L (图3A)。合成的mytimacin对所测试菌种均表现出明显的抑制活性, 但整体而言, 其对革兰氏阳性菌的抑制活性要弱于革兰氏阴性菌。其对革兰氏阳性菌的MIC值在100 μmol/L, 而对革兰氏阴性菌的MIC值多为50 μmol/L, 但对铜绿假单胞菌抑制活性较弱, 其MIC值达到200 μmol/L, 此外, mytimacin对白色念珠菌的MIC值为50 μmol/L,相比myticalin表现出对真菌较强的抑制活性 (图3B)。

图2 复性后的myticalin和mytimacin的反相液相色谱纯化图Fig.2 The purification of myticalin and mytimacin by reverse-phase HPLC after oxidation after oxidation

图3 化学合成的myticalin (A)和mytimacin (B)的抑菌活性Fig.3 The antimicrobial activities of chemical synthesized and refolded myticalin (A)and mytimacin (B)
2.4 红细胞毒性分析及扫描电镜观察结果
抗菌肽溶液与绵羊红细胞悬浮液经孵育,OD405检测结果表明, 与对照组相比, 不同浓度的myticalin和mytimacin均未能导致红细胞发生明显溶血现象, 不同浓度的myticalin和mytimacin其溶血率均小于5%, 与对照组无明显差异(P>0.05; 图4)。

图4 myticalin和mytimacin对绵羊红细胞的溶血活性测试 (平均值±标准差, n=3)Fig.4 Erythrotoxicity activity of myticalin and mytimacin against sheep red blood (mean±SD, n=3)
进一步利用扫描电镜观察myticalin与mytimacin对三种不同微生物形态学影响, 结果表明, 与对照组相比, 两种抗菌肽均对金黄色葡萄球菌产生明显影响, 导致金黄葡萄球菌产生凝集现象(图5A—C),且凝集后的菌体出现裂解和内容物释放现象。此外, myticalin与mytimacin对溶藻弧菌的表面形态结构也具有明显影响, 如图5D—F所示, 与对照组相比, 两种抗菌肽均导致溶藻弧菌表面结构变得粗糙, 出现皱缩或片状凸起, 但未导致细菌内容物的释放。此外, 与对照组相比, mytimacin导致白色念珠菌表面出现破壁现象, 导致出现火山口状孔洞(图5G和H)。而myticalin则对白色念珠菌的形态结构无明显影响 (图5I)。

图5 扫描电镜观察myticalin与mytimacin对金黄葡萄球菌、溶藻弧菌和白色念珠菌的形态结构影响Fig.5 Scanning electron microscopic observation of the effects of myticalin and mytimacin on the morphology and structure of S.aureus,V.alginolyticus, and C.albicans, respectively
2.5 myticalin和mytimacin在不同微生物刺激下的免疫反应模式
为进一步分析myticalin和mytimacin在不同微生物刺激下其在厚壳贻贝血细胞中的相对表达量变化。分别采用金黄葡萄球菌、溶藻弧菌及白色念珠菌对厚壳贻贝进行注射诱导, 荧光定量PCR结果见图6。由图6A可见, 在血细胞中, myticalin对金黄葡萄球菌诱导具有较强敏感性, 与对照组相比其相对表达量在1—12h均出现显著上调 (P<0.05),其峰值出现在诱导后4h, 且其相对表达量相对于对照组上升了约7倍; 而在溶藻弧菌诱导下, 与对照组相比myticalin相对表达量仅在2h和4h出现显著上调 (P<0.05), 其最大上升幅度约3.5倍; 此外, 在白色念珠菌诱导下, myticalin的相对表达量与对照组相比仅在4h和12h出现显著上调 (P<0.05), 最大上升幅度约3.5倍 (图6A)。
Mytimacin则对白色念珠菌和金黄葡萄球菌诱导表现出较强敏感性。在白色念珠菌及金黄葡萄球菌诱导下, mytimacin的相对表达量与对照组相比在2—8h出现显著上调(P<0.05), 其最大上升幅度分别为3倍和2.8倍; 在溶藻弧菌诱导下, mytimacin相对表达量与对照组相比仅在4h和8h出现表达量的显著上调(P<0.05), 且其最大上升幅度约为2倍(图6B)。
3 讨论
3.1 myticalin和mytimacin的序列特征
贻贝体内丰富的抗菌肽家族已成为新型生物抗生素研发的重要先导分子来源[43,44]。随着厚壳贻贝基因组序列及其多种组织转录组数据的公布,为预测和筛选厚壳贻贝新型抗菌肽分子奠定了基础。但厚壳贻贝中多数预测的抗菌肽分子因其在体内含量极低, 因此, 常规的蛋白质分离纯化技术不足以获得足够样品而进行后续分析。常规的蛋白质重组表达策略因抗菌肽序列中丰富的半胱氨酸及其形成的二硫键, 因而成功的例子也不多。目前厚壳贻贝中仅myticusin和mytichitin两种抗菌肽的真核重组表达获得了成功[26,45]。
Myticalin[20]和mytimacin[32]最早从地中海贻贝基因组中预测得到。通过对厚壳贻贝基因组及转录组学数据的筛选, 我们发现厚壳贻贝中也存在上述两种抗菌肽的序列。但是对这两种抗菌肽分子特性及其在贻贝免疫过程中的作用和机制尚不清楚, 为此, 我们对厚壳贻贝myticalin和mytimacin开展了固相化学合成, 抑菌活性测试以及不同微生物诱导后的表达谱开展研究。由于两种抗菌肽在贻贝体内含量极低, 因此无法通过常规的蛋白质分离纯化手段获得其样品, 因此, 对其序列分析主要依赖于生物信息学手段。分析结果表明, 两种抗菌肽前体序列中均含有pro区, 该区域被认为是贻贝抗菌肽普遍具有的结构特征之一[46]。但是该区域在两种抗菌肽序列中的位置不同, Myticalin的pro区位于其预测成熟肽区的C端, 而在mytimacin中则位于成熟肽与信号肽之间, pro区在部分生物毒素多肽中被认为是蛋白翻译后修饰的特征之一, 该区肽段可在翻译后被羧肽酶E切除[47,48]。目前对pro区的生物学意义尚不清楚, 有研究发现富含酸性氨基酸的per-pro区可能有助于富含碱性氨基酸的成熟肽在细胞内的稳定[49], 三级结构预测结果表明 Myticalin和mytimacin的pro区也符合该特征, 其序列中酸性氨基酸数量较多, 特别是myticalin的pro区中, 其酸性氨基酸(天冬氨酸和谷氨酸)占比超过35%, 而其成熟肽中其碱性氨基酸(精氨酸)占比达到19%,因此, 其pro区高含量的酸性氨基酸可能有助于维持多肽在细胞内的稳定。
3.2 myticalin和mytimacin的结构特征与其抗菌活性之间的关联
从厚壳贻贝myticalin和mytimacin的结构来看,两种抗菌肽表现出不一样的结构特征。其中, 最大的区别在于myticalin成熟肽序列中不含半胱氨酸,这也是目前发现的贻贝抗菌肽中唯一不含有半胱氨酸的抗菌肽家族。此外, myticalin的成熟肽序列中富含脯氨酸和精氨酸, 该特征类似于哺乳动物中的经典抗菌肽cathelicidin[50]。其中, 脯氨酸已被证明对抗菌肽活性发挥具有重要作用, 特别是可通过非裂解方式破坏细菌细胞膜从而发挥抑菌活性[51]。三级结构预测结果表明, 缺乏二硫键的myticalin主要形成无规卷曲结构, 但在部分肽段出现螺旋结构。虽然脯氨酸对规则二级结构具有破坏作用, 但连续的脯氨酸也可能会形成螺旋结构, 且该结构与蛋白质聚集体形成及位点识别具有关联[52]。事实上, 富含脯氨酸的抗菌肽已在多种物种中被发现,包括哺乳动物、节肢动物及植物[53]。此外也有研究发现, 精氨酸同样对这类抗菌肽的抑菌活性具有重要贡献[54,55]。因此, 我们推测, myticalin成熟肽序列中高含量的脯氨酸和精氨酸可能是其具有抑菌活性的内在原因。此外, 以往的研究表明, 富含脯氨酸的抗菌肽通常对真核细胞毒性较低[56,57], 而我们的研究结果同样表明, 合成后的myticalin对真菌抑制效果不明显(图3), 同时对绵羊红细胞也未表现出明显毒性(图4)。与myticalin相比, mytimacin则表现出贻贝抗菌肽的普遍特征, 首先具有多对二硫键, 其三级结构表现为典型的二硫键稳定的α/β结构。此外, mytimacin前体序列中pro区位于信号肽与成熟肽之间, 也符合多数软体动物与节肢动物抗菌肽的特征[16,58]。
为验证myticalin和mytimacin的体外抑菌活性,采取固相化学合成策略结合多肽复性手段, 获得myticalin和mytimacin的化学合成样品。体外抑菌试验结果表明, 两种抗菌肽均表现出抑菌活性。但是合成的mytimacin的抑菌活性要强于myticalin, 这可能与mytimacin具有较多规则二级结构有关。此外, myticalin表现出对革兰氏阴性菌较强的抑制作用, 这一点此前其他富含脯氨酸的抗菌肽类似[20,53]。而mytimacin则对革兰氏阳性菌抑制作用较强, 这与此前对地中海贻贝mytimacin的研究结果类似[31]。从扫描电镜结果来看, 两种抗菌肽对金黄葡萄球菌和溶藻弧菌的形态学影响类似, 意味着两种抗菌肽可能具有相似的作用机制。此外, mytimacin对真菌也具有明显抑制作用, 而myticalin则对真菌的抑制作用较弱.扫描电镜结果也证实了这一结果, mytimacin能显著改变白色念珠菌的形态结构, 而myticalin则无此影响。上述研究结果表明myticalin和mytimacin对各种微生物的抑制作用差异, 可能与其在贻贝体内可能具有不同的分工有关。两种抗菌肽在体外实验中均无明显的溶血活性, 表明两种抗菌肽均具有开发成为抗生素的潜力。
3.3 myticalin和mytimacin的免疫响应特征
考虑到血细胞在贻贝免疫过程中的重要作用[6],我们选择了血细胞研究myticalin和mytimacin在微生物刺激条件下的表达量变化。同时, 考虑到贻贝对不同微生物具有不同的免疫特征[59], 我们分别选取了金黄葡萄球菌、溶藻弧菌及白色念珠菌作为刺激条件。从研究结果来看, myticalin和mytimacin均表现为微生物诱导后产生显著的免疫响应(图6),表明两种抗菌肽分子均参与了厚壳贻贝的免疫过程, 但两种抗菌肽对不同微生物的反应敏感性具有差异。Myticalin表现出对金黄葡萄球菌的较强敏感性, 其响应持续时间及表达量上调倍数均强于溶藻弧菌和白色念珠菌诱导。而mytimacin则表现出对白色念珠菌的反应敏感性, 其次是对金黄葡萄球菌, 而对溶藻弧菌反应较弱。上述结果表明, myticalin和mytimacin在贻贝不同微生物刺激下具有差异化的免疫响应模式。该模式推测可能与两种抗菌肽具有不同的免疫识别和免疫信号传导机制有关。不同类型抗菌肽具有不同的免疫响应特征在节肢动物抗菌肽研究中已有较为深入的了解。例如, 已发现具抗真菌活性的节肢动物防御素的表达受到Toll 信号通路的调控, 而其他防御素的表达则受到免疫缺陷(Immune Deficiency, IMD)信号通路的调控[60]。贻贝中目前发现多种与免疫相关的信号通路[61,62], 但其与贻贝抗菌肽表达之间的关联目前尚未明确。我们推测, myticalin和mytimacin在贻贝体内参与免疫防御过程可能受到不同的免疫信号通路调节, 但该推测还需进一步的实验证实。

图6 三种不同微生物刺激下厚壳贻贝myticalin和mytimacin在血细胞中的表达量变化时间曲线 (平均值±标准差, n=3)Fig.6 The relative expression of myticalin and mytimacin in hemocytes of Mytilus coruscus, respectively, after infection with Staphylococcus aureus, Vibrio alginolyticus and Candida albicans (mean±SD, n=3)
综上所述, 对厚壳贻贝中新发现的两种抗菌肽myticalin和mytimacin 开展了序列分析, 固相化学合成, 功能验证,以及表达谱分析。该研究证实了两种抗菌肽分子在厚壳贻贝免疫防御过程中的作用,拓展了对贻贝抗菌肽分子多样性的理解。同时, 该研究结果也为后续在基于贻贝抗菌肽结构与功能研究的基础上, 深入了解贻贝抗菌肽的构效关系和抗菌机制, 并最终开发贻贝抗菌肽来源的新型生物抗生素奠定基础。
