草鱼β-防御素1的趋化活性及免疫佐剂效应研究
2022-12-21周建成刘小玲苏建国袁改玲
况 睿 周建成 刘小玲 苏建国 袁改玲
(1.华中农业大学水产学院, 武汉 430070; 2.武汉大北农水产科技有限公司, 武汉 430090)
草鱼(Ctenopharyngodon idella)是我国淡水养殖中最主要的养殖品种之一, 2021年中国渔业年鉴统计结果显示, 2020年我国草鱼产量高达557.1083万吨。随着我国水产养殖业的迅速发展, 水产养殖的病害问题日渐突出。当前用于治疗鱼类细菌性疾病的主要是抗生素类化学药物, 但抗生素污染问题已经成为目前影响我国水产养殖业可持续健康发展的重大科技问题。寻找能够替代抗生素的环保型饲料添加剂, 研制出无抗生素的环境友好型饲料, 是我国水产养殖业健康发展的迫切需求[1,2]。
抗菌肽广泛存在于各种生物体中, 是机体先天性免疫的重要组成部分[3]。抗菌肽对细菌、真菌和病毒等多种病原具有生物活性且不易产生耐药性[3,4],同时还具有非常好的免疫调节活性, 被认为是开发抗菌药物的新方向。Ganz等[5]将在人和兔白细胞中首次发现的一类结构相似的抗菌肽命名为“防御素”, 之后研究发现防御素几乎广泛分布在所有的生物体中, 根据防御素六个保守的半胱氨酸的位置及形成二硫键的连接方式不同可将动物防御素分为α、β和θ三种[6], β-防御素在所有脊椎动物中广泛分布, α-防御素仅存在于哺乳动物中, θ-防御素仅在恒河猴和狒狒中被发现[7]。α-和θ-防御素被认为是从古老的β-防御素进化而来[8]。
近年来研究发现, β-防御素除了具有强大的直接抗病原微生物活性以外, 还可以在天然免疫中发挥趋化等调节作用[9], 而巨噬细胞和中性粒细胞等白细胞定向迁移到病原入侵部位对宿主防御和诱发免疫反应至关重要[10]。了解防御素对鱼类白细胞的趋化作用及其免疫佐剂效应可以为鱼类防治微生物感染及疫苗提供新的策略, 为鱼类β-防御素在生产实践中的应用提供理论依据。
1 材料与方法
1.1 实验草鱼和细菌
实验草鱼[(1000±100)g 和(30±5)g]购自湖北省仙桃市排湖风景区渔场, 在华中农业大学水产学院循环水养殖系统中暂养2周。水温控制在(26±2)℃, 每日投喂鱼体重量2%的商品化饲料(武汉大北农集团)。实验鱼通过华中农业大学实验动物中心动物伦理审核(伦理号: HZAUFI-2021-0018), 一切操作均严格遵守实验动物福利伦理原则。金黄色葡萄球菌(S.aureus, ATCC 25923)、无乳链球菌(S.agalactiae, ATCC 13813)、大肠杆菌(E.coli,ATCC 25922)和嗜水气单胞菌(A.hydrophila, ATCC 7966)分别从美国标准菌库(American Type Culture Collection, ATCC)中获得, 由本实验室扩大后自主保管。
1.2 生物信息学分析
从NCBI(https://www.ncbi.nlm.nih.gov/)中下载得到人类(Homo sapiens)、小鼠(Mus musculus)、原鸡(Gallus gallus)和包含草鱼在内的多种鱼类β-防御素的氨基酸序列。将包含所有序列信息的文档上传到Clustal Οmega在线程序(https://www.genome.jp/tools-bin/clustalw)完成各物种β-防御素的多序列比对, 并通过MEGA7软件构建NJ系统发育树。
利用在线网站https://services.healthtech.dtu.dk/service.php?SignalP-5.0预测CiBD1成熟肽, 将成熟肽序列通过在线同源建模系统SWISS-MODEL(http://swissmodel.expasy.org/)预测CiBD1三级结构。之后将其三级结构导入PyMOL软件(PyMOL Molecular Graphics System, Version 1.3, 2011)中进行蛋白质三级结构成像, 进行可视化分析。最后, 利用软件直观展现蛋白质三级结构, 分析CiBD1的α螺旋与β折叠结构和CiBD1的表面净电荷分布。
1.3 引物合成
根据CiBD1(GenBank登录号: KX906958.1)基因核苷酸序列, 利用Primer 5.0软件设计特异性引物, 在引物上游引入KpnⅠ限制性内切酶和肠激酶(Enterokinase, EK)酶切位点, 在引物下游引入XhoⅠ限制性酶切位点。实验中用于扩增CiBD1基因及实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)使用的引物序列见表1, 由武汉擎科生物工程有限公司合成。
1.4 A.hydrophila感染前后草鱼各组织中CiBD1的转录分析
随机取5尾健康草鱼[(30±5)g]用MS222麻醉,先进行尾静脉放血然后解剖取各组织(脾脏、皮肤、鳔、肝胰腺、鳃、后肠、脑、眼、头肾和体肾)混样后用TRIzol试剂盒(中国北京, Aidlab)提取总RNA。使用NanoDrop 2000分光光度计测定浓度并根据260和280 nm下的吸光度比值判断RNA质量,A260/A280值在1.8—2.0为佳。通过2%琼脂糖凝胶电泳检测RNA完整性。使用HiScript®Ⅱ Q RT SuperMix for qPCR with gDNA wiper(中国南京,Vazyme)试剂盒按说明书操作进行反转录得到cDNA。qRT-PCR反应体系(20 μL)为: AceQ®qPCR SYBR Green Master Mix (中国南京, Vazyme)10 μL, 上下游引物(表1)各0.4 μL, cDNA 1.0 μL, ddH2O 8.2 μL。反应程序为: 94℃预变性3min; 95℃变性10s; 60℃退火30s; 72℃延伸20s; 重复40个循环。溶解曲线:95℃ 15s, 60℃ 1min , 95℃ 15s。以草鱼β-actin作为内参基因, 每个样品设置3个重复。使用2–∆∆Ct方法计算各组织CiBD1相对转录水平, 将感染前脾脏转录水平设为1, 其余组织是此基准的相对值。

表1 本研究所用到的引物Tab.1 Primers used in this study
取5×107CFU/mL嗜水气单胞菌悬液以200 μL/尾注射20尾草鱼, 72h后进行取样。之后操作步骤同感染前草鱼样品的处理一致。
1.5 原核表达载体构建与CiBD1重组蛋白的获得
根据预测得到的成熟肽对应的核苷酸序列设计特异性引物, 原核表达载体选择pET-32a。以草鱼后肠cDNA为模板, 采用PCR扩增目的片段, 用1.5%琼脂糖凝胶进行电泳检测。使用Gel Extraction kit 试剂盒(中国杭州, Axygen), 参照说明书纯化回收CiBD1的PCR扩增产物。用限制性内切酶KpnⅠ(中国北京, TaKaRa)和XhoⅠ(中国北京, TaKaRa)对CiBD1的PCR扩增片段和pET-32a载体进行双酶切, 37℃水浴酶切30min, 将酶切产物回收后进行连接。采用大肠杆菌DH5α感受态细胞进行重组载体的转化和阳性克隆筛选, 以单个克隆的菌液为模版,用CiBD1扩增引物进行 PCR扩增, 选择 PCR扩增检测阳性的菌落送武汉擎科生物科技有限公司进行测序确认。确认无误后扩大培养菌液并提取质粒,转化到大肠杆菌表达菌株 BL21(DE3)pLysS中进行重组表达, 转化和鉴定方法同上。经确认的重组载体命名为pET-32a-CiBD1。
表达菌株的最适诱导条件: 1.0 mmol/L IPTG,37℃, 5h。诱导结束后5000 r/min离心10min收集菌体, 使用平衡缓冲液(10 mmol/L Tris, 50 mmol/L NaCl, 20 mmol/L 咪唑, pH=7.2)重悬菌体, 使用高压破碎仪(中国上海, 励途, FB-110X)在850 Pa下破碎5min, 然后12000 r/min离心60min, 分别收集上清和沉淀。添加 5×SDS-PAGE上样缓冲液后, 在沸水中变性10min后于–20℃保存样品。用SDS-PAGE凝胶试剂盒(中国北京, Solarbio)配制12% SDSPAGE凝胶。取上清和包涵体样品进行点样检测,凝胶电泳条件为 80 V 2h。在电泳完成后, 分离SDS-PAGE凝胶进行考马斯亮蓝染色1h, 用水冲洗凝胶后, 于沸水中脱色20min后拍照检测。确定CiBD1表达于上清后, 采用Ni-NTA柱进行蛋白纯化, 使用肠激酶去除标签蛋白, 收集酶切产物。用Tris-Tricine-SDS-PAGE 凝胶试剂盒(中国北京, Solarbio)配制15%凝胶进行酶切产物检测。使用His标签抗体对重组蛋白进行免疫印迹(Western Blot)检测。
1.6 CiBD1重组蛋白的体外抑菌活性检测
本研究中检测CiBD1重组蛋白抗菌活性的方法为 CFU平板法。将冻存的金黄色葡萄球菌(ATCC 25923)、无乳链球菌(ATCC 13813)、大肠杆菌(ATCC 25922)和嗜水气单胞菌(ATCC 7966)接种到LB培养基中复苏。将复苏的菌液以1﹕100比例重新接种到新LB培养基中培养至对数期。使用平衡缓冲液稀释细菌到1×106CFU/mL, 吸取50 μL菌液与含CiBD1蛋白100 μg/200 μg的蛋白溶液150 μL混合后在细菌最适生长温度(金黄色葡萄球菌、无乳链球菌和大肠杆菌为37℃, 嗜水气单胞菌为28℃)水浴1h, 吸取50 μL 涂布在无抗LB固体平板上, 培养16h后拍照计数, 以Tris-HCl缓冲液为阴性对照。
1.7 CiBD1重组蛋白的趋化活性分析
用Percoll梯度离心法分离草鱼[(1000±100)g]头肾白细胞[11]。清洗两遍后调整细胞浓度为1×106CFU/mL。在迁移小室(Corning, 规格3 μm)中进行趋化实验, 将500 μL含有5% FBS(Fetal Calf Serum, 胎牛血清)和不同浓度CiBD1蛋白(0、12.5、25、50、100和200 ng/mL)的DMEM培养液(美国, Life Technologies)引入外室, 在内室中引入300 μL白细胞悬液。28℃趋化2h后收集外室的细胞悬液, 采用流式细胞仪(美国, BD Biosciences)进行计数, 并基于SSC(前向角散射)和FSC(侧向角散射)参数分析迁移细胞的种类。
1.8 灭活疫苗制备与个体感染实验
采用福尔马林灭活法制备嗜水气单胞菌灭活疫苗, 首先将嗜水气单胞菌复壮培养24h后加入福尔马林溶液(分析纯, 国药集团化学试剂有限公司),使终浓度为0.2%, 37℃灭活24h。将灭活后的嗜水气单胞菌于5000 r/min 离心10min 沉淀菌体, 弃置上清后用PBS 悬浮再离心以去除残余的甲醛, 重复3次。用PBS稀释调整菌的浓度至1.0×108CFU/mL, 即为嗜水气单胞菌灭活疫苗。将灭活疫苗与Montanide ISA206(法国, Seppic)佐剂按1﹕1(质量比)准备, 然后分别加热至(30±2)℃, 将Montanide ISA206佐剂倒入组织匀浆机中, 以200 r/min搅拌,并将灭活疫苗缓慢加入, 待灭活疫苗加完后, 提高搅拌速度至2000 r/min, 保持在30℃搅拌10min后逐渐降低搅拌速将苗液冷却至15℃停机, 在15℃以下静置24h后完成制备, 于4℃保存备用。CiBD1的佐剂组是先将CiBD1重组蛋白与嗜水气单胞菌灭活疫苗混合后再按上述方法与Montanide ISA206佐剂混合完成制备。吸取100 μL 疫苗涂布在无抗LB固体平板上, 37℃培养72h, 期间没有细菌或真菌生长,完成疫苗的无菌性检测。以100 μL/尾的剂量, 将制备好的各疫苗组注射到20尾健康草鱼体内, 以PBS作为阴性对照。观察7d后, 草鱼未出现死亡即完成疫苗的安全性检测。
将暂养两周的健康草鱼[(30±5)g]随机分为对照组, 疫苗组和疫苗+CiBD1组置于3个单独的400 L养殖水缸中。每组3个平行, 每个平行30尾鱼, 每组的3个平行在同一个大缸中并用特制网箱分隔开。每尾鱼腹腔注射100 μL PBS/疫苗/疫苗+CiBD1进行免疫, 控制水温为(28±2)℃, 免疫14d后用半致死浓度的嗜水气单胞菌(5×107CFU/mL)进行腹腔注射感染, 每尾注射量为200 μL。在感染前及感染后14d分别进行1次取样, 包括血清、头肾和后肠。注射感染后每8h监测1次, 统计14d的死亡率。
1.9 血清酶活测定和免疫相关基因qRT-PCR检测
采用尾椎静脉抽取草鱼[(30±5)g]血液后在4℃静置12h, 在4℃, 3000×g下离心15min, 收集血清。血清总超氧化物歧化酶(Total superoxide dismutase,T-SOD)、溶菌酶活性(Lysozyme Activity, LA)和补体C3酶活性的测定采用南京建成生物工程研究所生产的试剂盒。免疫相关基因采用qRT-PCR检测方法同1.4。
1.10 数据处理与统计学分析
采用Microsoft Office Excel 2010和GraphPad Prism 7.0软件进行数据分析、统计分析和图形展示。结果以平均数±标准差(SD)的方式表示。用单因素变量方差分析法(ANOVA)对抑菌、趋化等只有单一变量的实验进行统计学分析, 两组间采用非配对双尾Student’st检验判断是否有统计学差异,用Mantel-Cox检验对保护率数据进行分析。P<0.05被认为具有显著差异, 并用“*”标记;P<0.01用“**”表示;P<0.001用“***”表示。
2 结果
2.1 CiBD1的生物信息学分析
参与比对的所有β-防御素均具有6个高度保守的半胱氨酸, 但是, 鱼类β-防御素高度保守的第4号半胱氨酸与人、鼠和原鸡的第4号半胱氨酸位置存在差异。图1展现了人类、小鼠、原鸡和多种鱼类共39条β-防御素氨基酸序列的NJ系统发育树 。使用Neighbor-Joining聚类法, 在bootstrap检验中, 进行 500次重复, 使用p-distance模型计算进化距离,在任何位置都允许少于50%的比对间隙、缺失数据和模糊的碱基。在进化关系上, 草鱼β-防御素与鲤、团头鲂和斑马鱼更为相近。通过在线网站预测得到的CiBD1成熟肽序列为: ASFPWTCASLSGVCRQGVCLPSELYFGSLGCGKGFLCCVSH FG。使用PyMOL软件对CiBD1成熟肽进行可视化分析, CiBD1的二级结构中C端有一个α螺旋, 另外最为明显的特征是3个反向平行的β折叠, 这正是其高度保守的6个半胱氨酸两两连接组成, 是β-防御素最为典型的结构特征之一。当展现CiBD1静电势表面时, 其表面包含疏水基团与亲水基团, 同时正电荷分布大于负电荷, 由此可见CiBD1为阳离子两亲性蛋白。
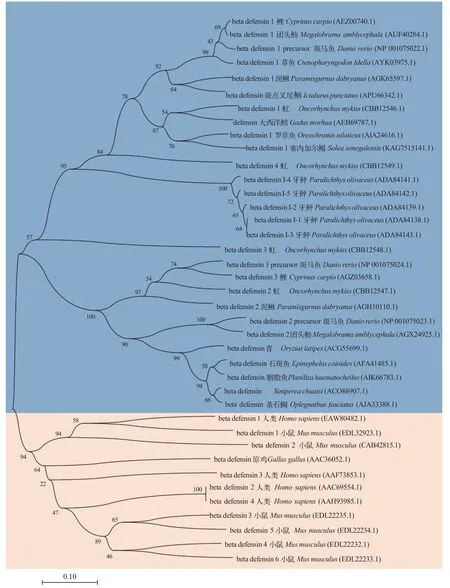
图1 β-防御素氨基酸序列NJ系统发育树Fig.1 NJ phylogenetic tree of β-defensin amino acid sequence
2.2 嗜水气单胞菌感染前后CiBD1的组织转录水平
为了探究CiBD1的生理学作用, 我们研究了CiBD1基因在正常生理条件下草鱼不同组织中的转录水平(图2), 在感染前的各组织中, 皮肤和眼是CiBD1转录水平最高的两个组织。嗜水气单胞菌感染72h后的草鱼各组织中CiBD1转录水平与感染前相比有明显差异, 表现为与黏膜免疫相关的组织,如皮肤、鳔、后肠和眼中的CiBD1的转录水平较为显著。
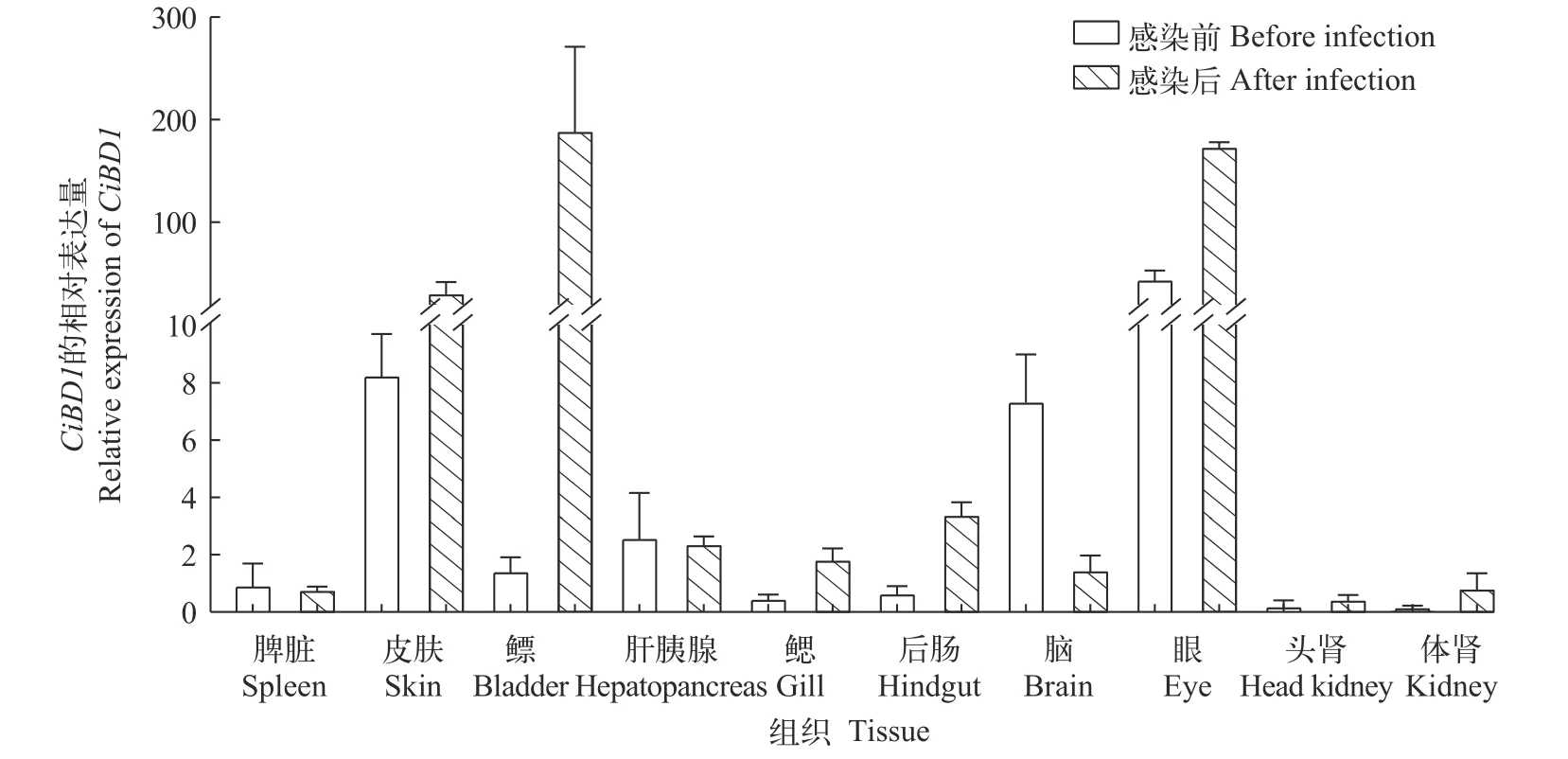
图2 嗜水气单胞菌感染前后CiBD1在各组织中的转录水平Fig.2 Constitutive levels of CiBD1 transcription in different tissues before and after A.hydrophila infection
2.3 获得CiBD1重组蛋白
将构建的重组质粒转化到表达菌株中进行菌液PCR后用琼脂糖凝胶电泳检测, 结果(图3A)显示在159 bp处有一条特异性条带, 大小与预测的目的条带一致。采用pET-32a质粒, 选择KpnⅠ和XhoⅠ两个酶切位点间插入目的基因片段。12%的SDSPAGE凝胶电泳结果显示, IPTG诱导后在22.5 kD大小处出现特异性条带(图3B), 与重组融合蛋白预测大小一致。使用His标签进行融合蛋白免疫印迹检测, 结果显示在22.5 kD大小处出现与预测大小一致的特异性条带(图3C)。肠激酶切后用15%的Tris-Tricine-SDS-PAGE凝胶检测结果显示在4.7 kD大小处出现特异性条带(图3D), 与目的蛋白大小一致。
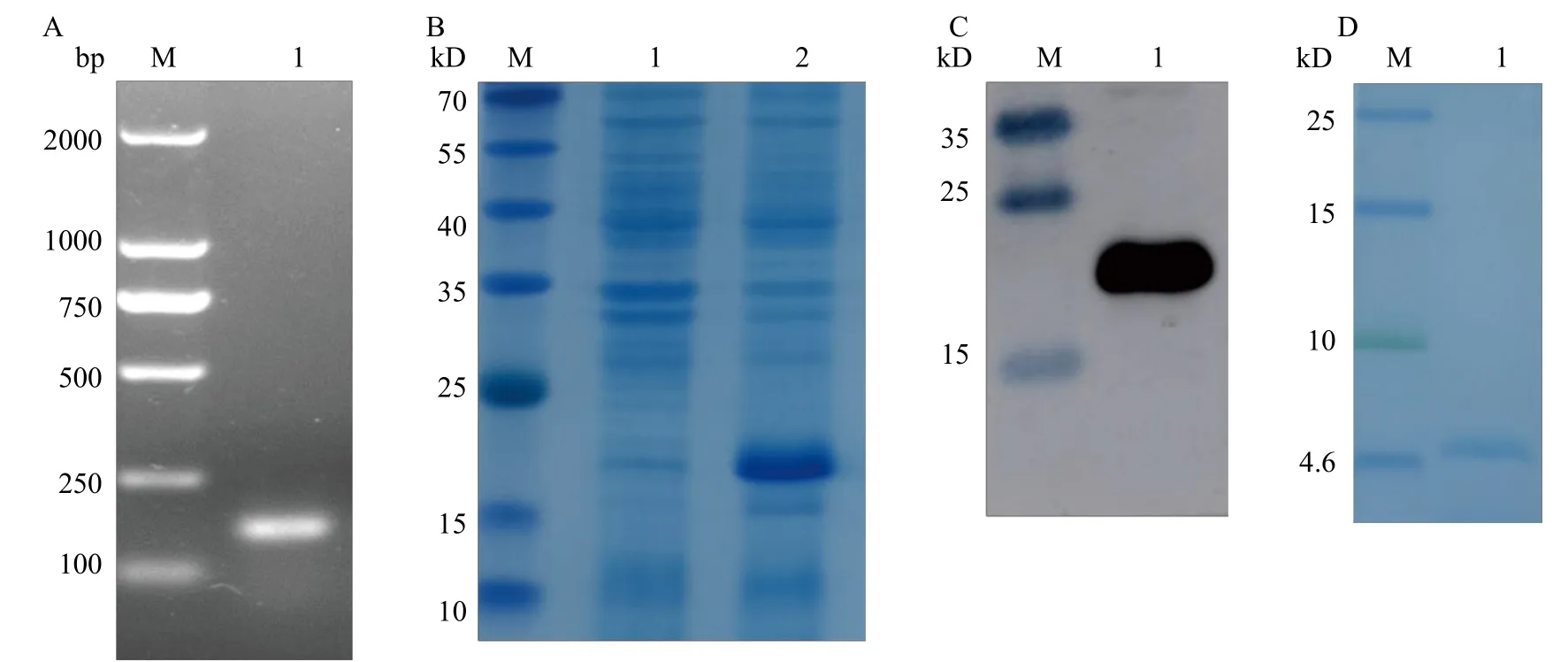
图3 重组质粒构建与蛋白表达纯化及检测Fig.3 Construction of recombinant plasmid and expression, purification and detection of protein
2.4 CiBD1蛋白具有体外抑菌活性
CFU平板法检测CiBD1蛋白的抗菌活性。选择两种革兰氏阴性菌(嗜水气单胞菌和大肠杆菌)和两种革兰氏阳性菌(无乳链球菌和金黄色葡萄球菌)进行蛋白抑菌实验。结果显示CiBD1蛋白对两种G–和G+均具有抑制活性(图4A)。对细菌平板拍照后用ImageJ软件进行计数, 将数据转换成柱形图直观展示, 并进行显著性分析(图4B)。

图4 CiBD1的抗菌活性分析Fig.4 Antibacterial activity analysis of CiBD1
2.5 CiBD1蛋白对草鱼原代白细胞具有趋化功能
使用Percoll梯度离心法分离草鱼头肾白细胞,吸取100 μL制备涂片后通过吉姆萨染色并进行扫描电镜, 参照相关研究报道[12]对淋巴细胞、单核巨噬细胞和粒细胞进行了形态学观察与鉴定(图5A)。
采用迁移小室进行白细胞趋化实验, 收集趋化后的外室细胞用流式细胞仪进行分群与计数(图5B)。将各组细胞数转换成柱形图的方式进行展现, 淋巴系细胞与髓系细胞分开展现(图5C和5D)。以5%FBS作为阳性对照, 结果表明在一定范围内CiBD1蛋白对草鱼白细胞的趋化迁移能力与蛋白浓度正相关。CiBD1蛋白在50 ng/mL时对草鱼头肾淋巴系细胞和髓系细胞均表现出较强的趋化活性。
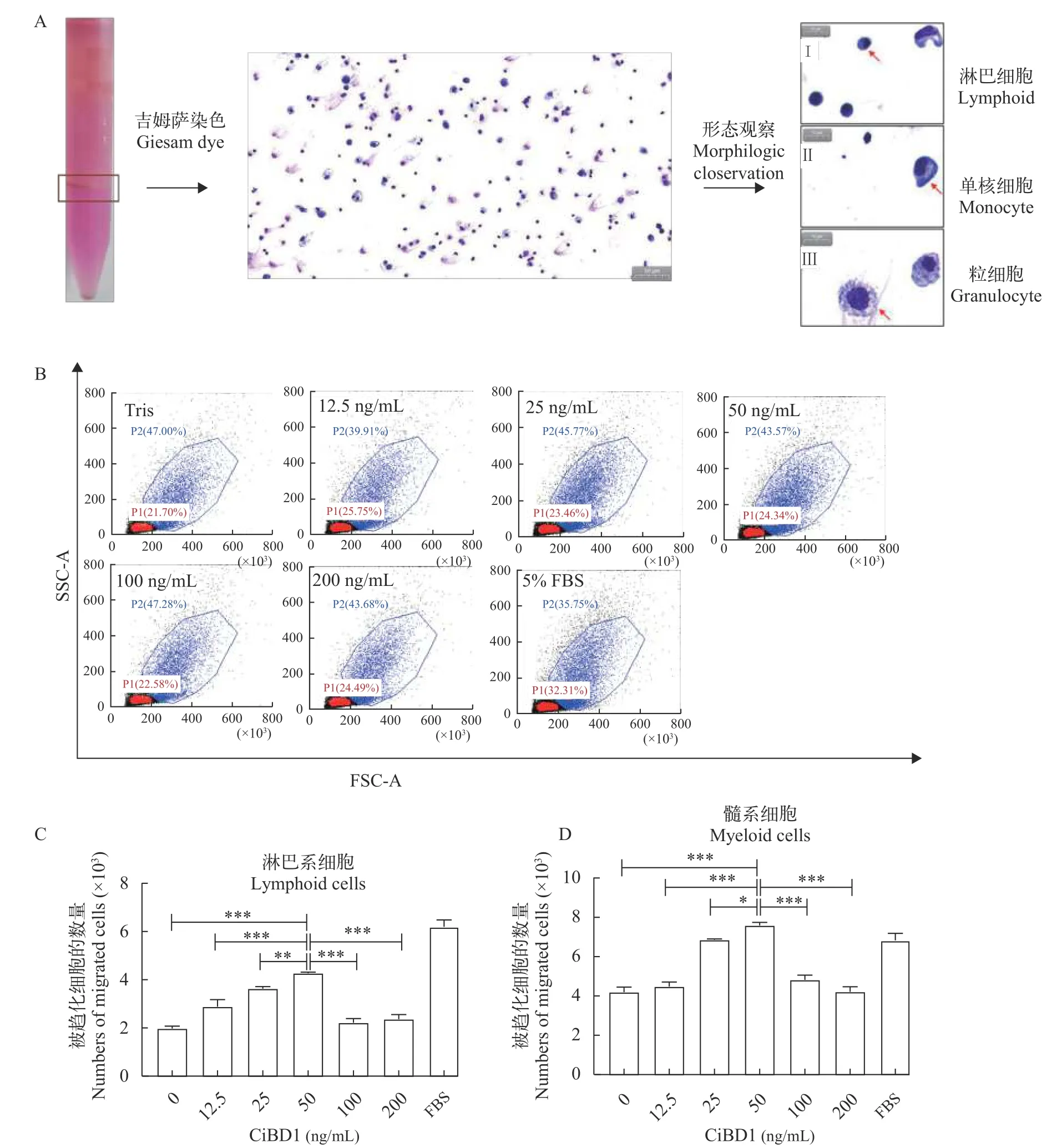
图5 CiBD1对草鱼白细胞的趋化活性Fig.5 Chemotactic activity of CiBD1 on grass carp leukocyte
2.6 CiBD1蛋白能保护草鱼抵抗嗜水气单胞菌感染
依据草鱼免疫应答产生规律[13], 设置免疫和感染时间节点如图6A所示。感染后14d的存活率曲线(图6B)显示, 疫苗+CiBD1组草鱼存活率最高, 且与疫苗组和对照组存在显著性差异。
用分光光度法对血清T-SOD、LA和C3进行测定(图6C—E)。免疫后14d疫苗组和疫苗+CiBD1组的T-SOD、LA和C3均显著高于对照组, 且疫苗+CiBD1组的T-SOD和LA显著高于疫苗组。感染后14d疫苗+CiBD1组的T-SOD、LA和C3均显著高于对照组和疫苗组。
免疫前、免疫后14d(感染前)和感染后14d分别检测后肠和头肾中免疫基因IL-1β、IL-6、MHCII、IgM和IgZ的表达水平(图6F1—F4)。结果显示,免疫后14d, 疫苗+CiBD1组头肾中IL-1β和IgM表达水平显著高于对照组及疫苗组,IL-6和IgZ的表达水平没有显著性差异(图6F1); 疫苗+CiBD1组和疫苗组后肠中IL-1β、IgM和IgZ的表达水平较对照组显著提高, 但疫苗+CiBD1组和疫苗组之间未表现出显著性差异(图6F2)。感染后14d, 疫苗+CiBD1组头肾中IgM和MHC II表达水平显著高于对照组和疫苗组, 疫苗+CiBD1组和疫苗组IL-6表达水平显著低于对照组(图6F3); 疫苗+CiBD1组和疫苗组后肠中IL-1β表达水平显著低于对照组, 疫苗+CiBD1组MHC II表达水平显著高于对照组和疫苗组, 疫苗组IgZ表达水平显著高于对照组, 而疫苗+CiBD1组IgZ表达水平显著低于对照组(图6F4)。
3 讨论
3.1 CiBD1的生物信息学与组织分布分析
防御素是一类广泛存在于动植物界中的小型阳离子抗菌肽, 但在鱼类中仅存在β-防御素[14]。对CiBD1多肽的生物信息学分析发现, 其具有β-防御素的典型结构, 即6个高度保守的半胱氨酸组成的3个β折叠结构。本研究检测CiBD1在嗜水气单胞菌感染前后的组织表达水平结果表明, 感染前CiBD1呈组成型分布在草鱼各组织并高表达于一些黏膜组织, 而细菌感染后一些与外周环境接触密切的组织中的CiBD1转录水平上升显著。CiBD1高表达于皮肤、眼和肠道等黏膜组织的结果预示着CiBD1在黏膜免疫的防御中可能发挥着重要作用,与高等脊椎动物β-防御素主要在各种器官或组织的上皮细胞中产生一致[15]。随着物种进化, β-防御素结构、种类和功能变得多样, 草鱼作为早期进化的脊椎动物, 目前仅发现三种结构相似的β-防御素。而在人和鼠上有多达48种β-防御素[16,17], 这些β-防御素功能多样, 如抗细菌、真菌、病毒和寄生虫活性, 以及趋化, 诱导细胞成熟, 补体激活, 结合LPS和损伤修复等免疫调节功能[18]。CiBD1在结构上具有高度保守性, 在功能上也与哺乳动物存在很大的相似性。
3.2 CiBD1的抗菌活性及趋化活性检测
大肠杆菌表达系统用于外源蛋白的表达具有方便高效且低廉的优势, 通过肠激酶去除融合标签可以最大程度地保留重组蛋白的活性。本研究显示纯化并肠激酶切去融合标签的CiBD1对G+和G–具有一定的抑制活性, 但是最小杀菌浓度(MIC)较高。目前研究认为, 抗菌肽主要通过膜破损的方式杀菌[19], 其杀菌能力在一定范围与所带正电荷成正比, 推测CiBD1较弱的电荷限制了其体外杀菌能力, 相较于PI值更高的蛋白如CXCL20a[20], CiBD1对细菌具有更高的MIC, 这与其他鱼类β-防御素的报道一致[21]。
关于防御素的趋化活性, 在高等哺乳动物已有大量报道, 而且不同类型人防御素表现出对不同细胞的趋化活性[22]。比如人β-防御素2是人上第一个被证明具有趋化活性的防御素[23], 其对肥大细胞具有趋化作用[24]; 在纳克浓度下, HNP-1和HNP-2可以募集单核细胞集合到炎症部位, 并对T细胞和未成熟的树突状细胞也有趋化活性[25]; 鱼β-防御素趋化活性也有报道[26,27]。脊椎动物免疫细胞趋化是一种重要的宿主防御机制[28,29], 尤其是抗原提呈细胞的趋化对免疫应答的启动起着重要作用[30—32]。本研究结果中发现50 ng/mL的CiBD1重组蛋白在体外对草鱼白细胞具有明显的趋化活性, 提示CiBD1具备免疫佐剂的应用潜力。
3.3 免疫佐剂效应探究
免疫佐剂是一类能够非特异性增强机体对抗原的免疫应答反应, 但本身不具备抗原性的物质[33]。免疫佐剂具有减少抗原使用量, 迅速激活免疫系统,增强免疫应答等作用。免疫佐剂种类很多, 包含铝佐剂、微生物类佐剂、蜂胶佐剂、油乳佐剂、左旋咪唑佐剂、中药佐剂及小肽类佐剂等。一些常规佐剂虽然具有一定的免疫增强效果, 但同时会存在一些副作用, 如铝佐剂在白鼠体内可进入大脑,存在安全风险; 左旋咪唑佐剂长期使用会引起腹泻[34]。开发生物来源的小肽佐剂是疫苗佐剂的研究新方向, 因其具有更高的生物安全性。目前研究证实β-防御素具有较好的免疫佐剂效果, 如人β-防御素3作为免疫佐剂可以增强金黄色葡萄球菌灭活疫苗对小鼠保护效果, 潜在机理可能是通过上调CD80/CD86和MHCⅡ表达水平[35]; 重组禽β-防御素rAvBD12613作为免疫佐剂在新城疫活疫苗和灭活疫苗中均具有良好的免疫佐剂活性[36]。本研究探究了CiBD1蛋白对嗜水气单胞菌灭活疫苗的佐剂增强效应, 各组存活率如图6B所示, 疫苗+ CiBD1组较疫苗组显著提高了草鱼存活率, 表明CiBD1可以增强疫苗免疫效果, 提高草鱼抵抗嗜水气单胞菌的感染。白细胞介素-1 (IL-1)家族成员是先天免疫系统中非常重要的炎症因子[37],IL-1包括IL-1α和IL-1β两种形式,IL-1β可以激活IL-6表达, 选择性介导对血管损伤的修复[38]。本研究发现免疫后14d, 疫苗+ CiBD1组头肾中IL-1β转录水平显著高于对照组和疫苗组; 后肠中IL-6转录水平显著高于对照组。感染后14d, 与对照组相比, 疫苗+ CiBD1组头肾中IL-1β和IL-6转录水平均有所下降。提示CiBD1可调节炎症因子表达水平。补体和溶菌酶是鱼类先天性免疫的重要免疫分子, 本研究发现,免疫后14d和感染后14d实验组血清中溶菌酶和C3含量高于对照组。以上结果提示CiBD1作为免疫佐剂可以增强疫苗对草鱼先天性免疫系统的激活。

图6 嗜水气单胞菌体外感染实验Fig.6 A.hydrophila infection in vitro
MHC II对CD4+T淋巴细胞的抗原呈递至关重要, 本研究结果显示, 疫苗+CiBD1组在感染14d后MHCⅡ显著上升, 说明CiBD1可以增强疫苗的抗原提呈, 促进适应性免疫应答的启动。IgM是硬骨鱼类血清中最主要的免疫球蛋白, 在硬骨鱼类抗感染免疫中发挥着重要作用[39], 此外, 硬骨鱼类所特有的免疫球蛋白IgZ在功能上与哺乳动物IgA类似,主要表达于皮肤、鳃等黏膜组织, 在黏膜免疫中起着重要作用。本研究发现, 免疫后14d, 疫苗+ CiBD1组头肾IgM转录水平显著高于对照组, 而后肠IgM和IgZ转录水平均显著提高。感染后14d, 疫苗+CiBD1组头肾中IgM仍维持较高水平, 而疫苗组后肠IgZ转录水平显著高于疫苗+ CiBD1组。这提示在免疫阶段IgM和IgZ在头肾和后肠中会大量表达,参与机体的抗感染免疫反应; 感染后IgM和IgZ会发挥免疫防御作用, 参与病原体的清除。以上结果提示CiBD1可以提高疫苗对适应性免疫的应答能力,具有潜在的免疫佐剂效应。
4 总结
综上所述, CiBD1 是一类高度保守的小分子阳离子抗菌肽,CiBD1呈组成型分布在草鱼各组织并高表达于一些黏膜组织, 在机体受到病原或环境刺激时, 一些与外周环境接触密切组织中的CiBD1转录水平表达更显著。CiBD1重组蛋白不仅在体外具有一定的抑菌活性, 而且对草鱼头肾淋巴系细胞和髓系细胞均表现出较强的趋化活性。CiBD1可以提高嗜水气单胞菌灭活疫苗的保护率和抗病力,具有良好的免疫佐剂效应。
