仙茅苷对抗PTSD诱导的小鼠海马炎症反应机制
2022-12-17姬曼曼张峥嵘朱国旗
姬曼曼, 张峥嵘, 朱国旗
(安徽中医药大学新安医学教育部重点实验室, 合肥 230012)
创伤后应激障碍(Post-traumatic stress disorder,PTSD),是指个体遭遇重大创伤性事件后导致个体延迟出现和(或)持久存在的一种精神障碍,PTSD患者由恐惧引发心理应激,以恐惧消退异常为典型特征[1],并伴有抑郁、焦虑等特征。世界上超过70%的成年人在他们一生中的某个时候经历过创伤事件,大约6%的创伤暴露个体会发展成PTSD[2]。目前,临床上尚无有效的治疗措施控制PTSD的发展进程,多采用以药物治疗为主,同时辅以心理治疗,但是只有少数的抗焦虑和抗抑郁药物被批准用于PTSD的治疗[3]。
适度的神经炎症有助于神经系统发育和损伤修复,过度强烈或持续的神经炎症会破坏神经结构和功能障碍[4],并参与阿尔兹海默病(Alzheimer’s disease,AD)[5]、PTSD[6]、抑郁[7-8]等疾病的发生发展。研究表明,PTSD患者的促炎细胞因子水平(IL-1β、TNF-α、IFN-γ以及炎症刺激的CRP)明显高于健康个体[9],且这些促炎标志物的严重程度和发生PTSD的可能性呈正相关。核转录因子κB(nuclear factor kappa-B,NF-κB)在神经炎症、免疫应答等过程中起关键性作用[10],也参与突触可塑性与学习记忆[8]。NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)和含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase-1,Caspase-1)在细胞凋亡和炎症中发挥重要作用[11]。NLRP3活化可激活Caspase-1,促使IL-6、TNF-α释放入血,透过受损的血脑屏障进入脑内,诱导脑内细胞凋亡,从而引发精神疾病的产生[8]。有研究表明,NF-κB可通过调控NLRP3的表达来激活NLRP3炎症小体[12]。因此,NF-κB调控NLRP3炎症小体可能是预防或治疗PTSD的重要靶点。
仙茅苷(Curculigoside,CUR)是仙茅的主要成分,现代药理学研究表明仙茅苷具有抗炎[13]、抗氧化[14]、预防骨质疏松[15],保护中枢神经细胞[16],改善学习记忆能力[13]等功效。实验室前期研究发现仙茅苷可增加BDNF/TrkB表达促进恐惧消退[17],并改善电刺激应激小鼠抑郁的症状及抑制记忆退化的作用[18]。但关于仙茅苷对小鼠PTSD样行为的影响及其作用的机制尚不清楚。因此,本实验建立改良的单次延长应激和电击(Single prolonged stress and electrical stimulation,SPS&S)小鼠模型,探讨仙茅苷对小鼠PTSD样行为的作用,以及对海马炎症方面的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
30只成年雄性C57BL/6小鼠(日龄5周;体重:20~25 g),饲养于温度为22 ℃±2 ℃,相对湿度为45%~65%的房间中,经12 h的明/暗循环,可随意饮水和摄食。实验动物购于安徽医科大学实验动物中心[许可证号:SCXK9(皖)2016-0009],实验经安徽中医药大学(中国合肥)伦理委员会批准。
1.1.2 药材与试剂
仙茅苷(HPLC≥98.0%)购自成都德思特生物技术有限公司;NF-κB、NLRP3、Caspase-1和β-Actin抗体购自Cell Signaling Technology;辣根过氧化物酶标记抗兔IgG、辣根过氧化物酶标记抗鼠IgG购自北京中杉金桥生物技术有限公司;TNF-α和IL-1β ELISA检测试剂盒购自江莱生物有限公司。
1.2 方法
1.2.1 SPS&S小鼠模型建立与分组
C57小鼠适应一周后建立SPS&S模型,实验流程如下:束缚2 h、强迫游泳20 min、休息15 min后,用异氟烷麻醉至意识模糊、重复两次,清醒后进行足部电击(2 mA,2 s)。刺激结束后将小鼠放回笼中。实验随机分为5组(n=6):正常对照组、SPS&S模型组、CUR(5、10、20 mg/kg)组。CUR组在造模24 h后开始进行腹腔注射给药(5、10、20 mg/kg,每天1次),正常对照组和SPS&S模型组腹腔注射等量的生理盐水,连续给药14 d。在最后一天给药后对小鼠进行条件恐惧、旷场和高架十字迷宫实验(图1)。

图1 实验流程Figure 1 Experimental protocol
1.2.2 条件恐惧实验
第14天给药结束1 h后,进行恐惧消退实验,条件恐惧实验分为适应期、训练期、再暴露期和消退期4个阶段。给药后开始实验:(1)第1天为适应期。每只小鼠在恐惧箱里适应5 min。(2)第2天是训练期。将小鼠置于恐惧箱中5 min,给予3次足底电击(1.0 mA,持续2 s,每次电击间隔73~74 s)。(3)第3天为再暴露。将小鼠重新放置在恐惧箱中,暴露15 min,不给予足底电击。记录每只小鼠在15 min内的凝滞时间,并统计最初5 min的凝滞时间。(4)第4天为恐惧记忆消退。小鼠放入恐惧箱中5 min,没有足底电击,记录5 min内的凝滞时间。每只小鼠测试完后,用75%乙醇擦洗恐惧箱以去除背景气味。
1.2.3 旷场实验(Open field test,OFT)
将小鼠放入旷场实验专用敞箱的中心方格内,观察实验小鼠5 min内的自发活动。使用自动分析系统(上海欣软信息科技)比较各组之间的中央区域停留时间、中央区域运动路程与运动总路程。完成每只小鼠实验后均用酒精棉球擦拭敞箱,以除去小鼠余留的信息,避免影响下次测试结果。
1.2.4 高架十字迷宫实验(Elevated plus maze test,EPMT)
将小鼠从高架十字的中央格面向开放臂放入其中,通过软件记录5 min内进入开臂、闭臂的次数和滞留时间,并计算相应的百分比,同时观察小鼠的焦虑样状态。
1.2.5 酶联免疫吸附剂测定(Enzyme linked immunosorbent assay,ELISA)
行为学结束后,将各组小鼠断头取血,离心获取血清。按照ELISA试剂盒说明书检测各组小鼠血清中的IL-1β和TNF-α的表达水平。
1.2.6 心脏灌流和HE染色
小鼠经麻醉后开胸暴露心脏,在左心室的位置插管,快速灌注PBS至流出液变清亮后换4%多聚甲醛继续灌注。完毕后,取出脑组织用4%多聚甲醛在4 ℃条件下固定过夜,用30%蔗糖溶液脱水48 h。冷冻切片(厚度:20 μm),进行常规HE染色。
1.2.7 蛋白免疫印迹(Western Blot)
选用异氟烷吸入麻醉,诱导含量为3%,麻醉完全后迅速断头取脑,在冰盘上迅速分离出两侧海马组织,加适量的RIPA研磨提取蛋白,BCA法测定蛋白浓度,Western Blot常规操作,用SDS-PAGE分离蛋白质样品并将其转移到醋酸纤维膜膜上。在室温下用5%脱脂奶粉封闭2 h,洗膜后将膜放入含有对应抗体的稀释液(1∶1 000)中,分别是NF-κB、NLRP3、Caspase-1和β-actin,4 ℃孵育过夜。洗涤后加入1∶10 000稀释的二抗孵育2 h,洗涤。ECL显色,曝光。使用Image J软件分析目标条带及内参条带的光密度值。总蛋白的相对含量用其与内参蛋白的比值表示。
1.2.8 统计分析

2 结果与分析
2.1 仙茅苷促进PTSD小鼠恐惧消退
条件性恐惧记忆实验结果表明,足底电击可诱导小鼠形成条件性恐惧记忆。选用再暴露前5 min表示小鼠的恐惧记忆,结果显示,各组之间小鼠的凝滞时间没有显著差异[图2(a),F(4,25)=0.562 7,P>0.05],表明CUR给药后不会影响小鼠恐惧记忆的形成。但是在恐惧消退24 h后(实验流程中D25),CUR(10和20 mg/kg)组小鼠的凝滞时间显著低于模型组[图2(b),F(4,25)=13.80,P<0.05]。结果表明,CUR给药促进了小鼠的恐惧记忆的消退。

(a)再暴露前5 min的凝滞时间;(b)消退24 h后的凝滞时间。#为P<0.05,vs.正常组;* 为P<0.05,vs.SPS&S组。图2 仙茅苷促进SPS&S小鼠的恐惧消退Figure 2 CUR facilitates fear memory extinction in SPS&S mice
2.2 仙茅苷改善PTSD小鼠焦虑样行为
通过旷场实验及高架十字迷宫实验测定动物的焦虑样行为。旷场实验结果显示,与正常对照组相比,SPS&S小鼠在中心区域停留时间[图3(a),F(4,25)=21.40,P<0.05]和中心区域内运动距离[图3(b),F(4,25)=9.063,P<0.05]显著减少。与SPS&S模型组小鼠相比,给予CUR的PTSD小鼠在中心区域停留时间和中心区域内运动距离显著增加(P<0.05)。CUR给药后不影响小鼠旷场实验中的总路程[图3(c),F(4,25)=9.063,P>0.05],表明CUR的抗焦虑作用与小鼠的自发活动无关。
高架十字迷宫实验中,与正常对照组相比,SPS&S模型小鼠进入开放臂次数百分比减少(P<0.05),与SPS&S组相比,给予CUR(10、20 mg/kg)的PTSD小鼠进入开放臂次数百分比显著增加[图3(d),F(4,25)=6.592,P<0.05]。

(a)旷场实验中心区域停留时间;(b)旷场实验中心区域内运动距离;(c)旷场实验运动总路程;(d)进入高架十字迷宫开放臂次数百分比。#为P<0.05,vs.正常组;* 为P<0.05,vs.SPS&S组。图3 仙茅苷改善SPS&S模型小鼠焦虑样行为Figure 3 CUR improves anxiety-like behaviors in SPS&S mice
2.3 仙茅苷改善PTSD小鼠海马CA1区神经细胞病理变化
海马CA1区HE染色显示正常对照组小鼠海马神经元细胞排列整齐,细胞膜完整,结构正常,变性细胞数量较少;而PTSD模型小鼠与正常对照组相比,海马CA1区神经元变性细胞数量明显增多,胞质溶解,排列紊乱,细胞之间距离显著增宽;CUR(20 mg/kg)给药后小鼠海马CA1区神经元变性细胞数量减少,排列较为整齐。见图4。

(a)海马组织CA1区神经细胞HE染色图;(b)海马组织CA1区变性细胞统计图(50 μm2)。#为P<0.05,vs.正常组;* 为P<0.05,vs. SPS&S组。图4 仙茅苷改善PTSD小鼠海马CA1区神经细胞病理变化Figure 4 CUR ameliorates the pathological changes in the CA1 regions of the hippocampus of PTSD mice
2.4 仙茅苷下调PTSD小鼠血清中TNF-α及IL-1β水平
与正常对照组相比,SPS&S模型组小鼠血清TNF-α[图5(a),F(4,20)=13.38,P<0.05]及IL-1β[图5(b),F(4,20)=12.81,P<0.05]水平明显升高;与SPS&S模型组相比,CUR(10、20 mg/kg)血清中TNF-α及IL-1β水平显著降低(P<0.05)。

(a)TNF-α的水平;(b)IL-1β的水平;#为P<0.05,vs.正常组;* 为P<0.05,vs.SPS&S组。图5 仙茅苷下调PTSD小鼠血清中TNF-α及IL-1β水平Figure 5 CUR reduces the levels of serum TNF-α and IL-1β in PTSD mice
2.5 仙茅苷抑制PTSD小鼠海马组织中NF-κB、NLRP3和Caspase-1表达
与对照组相比,SPS&S模型小鼠海马区NF-κB、NLRP3及Caspase-1蛋白的表达明显升高(P<0.05);与SPS&S模型组相比,CUR(10、20 mg/kg)给药后明显降低海马组织中NF-κB[图6(b),F(4,15)=4.411]、NLRP3[图6(c),F(4,15)=20.64]及蛋白Caspase-1[图6(d),F(4,15)=5.386]的表达(P<0.05)。
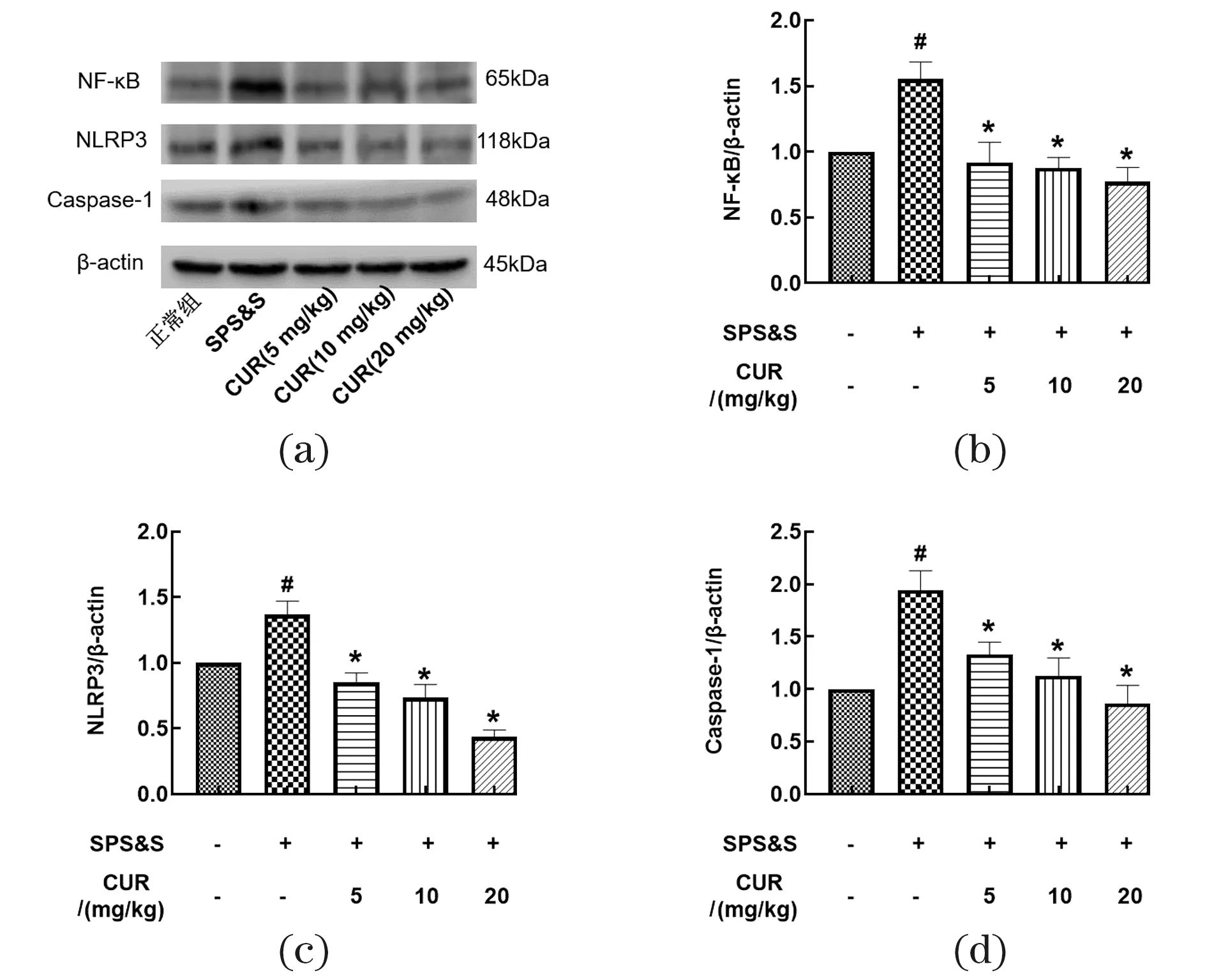
(a)代表性蛋白印迹条带;(b)NF-κB表达结果;(c)NLRP3表达结果;(d)Caspase-1表达结果。#为P<0.05,vs.正常组,* 为P<0.05,vs.SPS&S组。图6 仙茅苷抑制PTSD小鼠海马组织中NF-κB、NLRP3和Caspase-1表达Figure 6 CUR inhibits the expression of NF-κB,NLRP3 andCaspase-1 in the hippocampus of PTSD mice
3 讨论与结论
本研究采用改良的SPS模型来模拟PTSD样症状,在再暴露前5 min,CUR给药对小鼠的不动时间没有显著差异,但在消退24 h后,小鼠的凝滞时间明显减少。这表明CUR不会影响记忆形成和巩固,但是可促进恐惧记忆的消退。另外,PTSD小鼠在旷场中进入中心区域的运动距离和运动时间减少,在高架十字迷宫中进入开放臂的次数减少,而CUR给药可改善小鼠的焦虑样行为。在CUR给药组中,CUR(20 mg/kg)组的焦虑样行为改善程度最为明显。因此,在后续病理切片中只选取CUR(20 mg/kg)组进行观察。结果表明CUR(20 mg/kg)给药可改善其海马神经细胞的病理变化。同时,CUR给药能降低其促炎细胞因子TNF-α与IL-1β水平,并抑制NF-κB、NLRP3和Caspase-1的表达,说明仙茅苷可抑制PTSD小鼠的神经炎症,其焦虑样行为的改善可能与抑制NF-κB对NLRP3炎症小体的调控有关。PTSD发生的机制有很多,已有的报道包括突触可塑性的破坏和炎症反应等[19]。本研究中,低剂量CUR对炎症分子有调控,但不改善PTSD的行为功能,该结果进一步说明PTSD发病机制的复杂性。
SPS动物促炎细胞因子的表达与学习记忆的下降在精神疾病中发挥直接作用[20-22]。实验室前期采用SPS模型发现安神定志方可通过改善海马mTOR依赖性突触功能来预防SPS暴露引起的行为改变[23],并采用SPS&S模型证明了7,8-二羟基黄酮通过激活BDNF-TrkB信号通路来缓解星形细胞和突触异常,从而抑制PTSD小鼠恐惧泛化和焦虑样行为[24]。本研究表明,SPS&S导致小鼠出现PTSD样行为,且小鼠行为的改变伴随着NF-κB蛋白和促炎细胞因子的激活。
大脑神经炎性是导致PTSD病程发展的重要原因,大量神经炎症因子的释放及免疫系统细胞的激活参与神经发生、突触可塑性、神经元的存活等过程,从而影响学习记忆的形成[6,25],并伴随着抑郁、焦虑等情绪问题。在啮齿类动物体内外周注射脂多糖会导致大脑恐惧回路区域的炎症反应增加,特别是杏仁核[26]、前额叶皮质[27]和海马[28],它们是恐惧消退过程中的关键结构。已有研究证明,NLRP3炎症小体激活在调节恐惧记忆和PTSD以及焦虑症发展中的关键作用[29]。同时,NLRP3/Caspase-1炎症小体通路参与调控AD诱导的神经炎症[30]。另外,NLRP3炎症小体的激活会引起细胞焦亡相关蛋白Gasdermin D的裂解、促炎细胞因子IL-1β的产生和小胶质细胞的过度活化[31],从而导致疾病的发生。而仙茅苷具有抗炎作用,能够抑制PTSD小鼠NF-κB蛋白的表达,降低促炎细胞因子的水平。并有研究表明,经典名方二仙汤可抑制AD大鼠NLRP3/ASC/IL-1β通路相关蛋白的高表达[32]。仙茅是二仙汤的君药,而仙茅主要活性成分仙茅苷可能是降低炎症反应的主要成分。
NF-κB作为细胞中的一个转录因子家族,是机体免疫、炎症等过程的关键调节因子,可通过对免疫介质刺激因子的活化而诱导细胞因子、趋化因子和黏附分子的表达[33]。研究表明,NF-κB对小鼠的学习记忆能力发挥重要作用[11,30]。并且,通过调节NF-κB信号通路可以抑制NLRP3炎症小体的活化[34]。而仙茅苷可下调佐剂性关节炎大鼠的TNF-α、IL-1β和IL-6水平,并下调NF-κB与NLRP3的表达[13]。同时,仙茅苷可通过JAK/STAT/NF-κB信号通路在体内外均发挥抗关节炎作用[35]。并且,研究结果指出在SPS&S模型小鼠海马中NF-κB与NLRP3蛋白表达均升高。而CUR给药后能够明显抑制其蛋白表达量,降低促炎细胞因子水平。基于以上研究,表明NF-κB调控NLRP3炎症小体可能是仙茅苷预防或治疗PTSD的重要靶点。
本研究发现仙茅苷能够改善SPS&S诱导的PTSD小鼠焦虑样行为,促进恐惧记忆的消退,降低炎症因子的表达,其作用机制可能是通过NF-κB调控NLRP3炎症小体来抑制PTSD小鼠的神经炎症。本研究尚存在一定的局限性,我们只检测了海马区的炎症相关蛋白表达,并未涉及其他脑区;仙茅苷调控NF-κB的具体机制尚需进一步确认。
