不同基因型玉米品种氮积累与根区土壤氮转化过程差异研究*
2022-12-16丁凤磊王鹤鹃张丽丽李笑笑董召荣
丁凤磊,张 乐,余 磊,王鹤鹃,张丽丽,李笑笑 ,宋 贺,董召荣
(1.安徽农业大学 农学院,合肥 230036;2.合肥丰乐种业股份有限公司,合肥 230088)
玉米是中国重要的粮食作物之一,2020 年中国玉米总产量达到2.61 亿t,居于三大粮食首位[1-2]。氮素是玉米生长发育所必需的大量元素,在玉米生长发育和产量形成过程中起至关重要的作用[3-4]。中国玉米种植的当季氮肥施用量持续增长,从20 世纪70 年代的90 kg/hm2增加到21 世纪初的240 kg/hm2[5]。然而,中国玉米氮肥利用效率仅为26.1%,远低于其他国家和地区[6]。玉米的氮肥利用效率与根系氮素吸收、植株氮素同化和植株氮素积累分配密切相关[7]。不同玉米品种氮素吸收受根系构型和空间分布影响,且具有基因型差异[8-9]。米国华等[10]认为:高氮吸收玉米品种的理想根系构型为根系下扎能力强,分布深,根系活力强;王敬锋等[11]研究发现:高氮吸收效率玉米品种根系总量和深层根系多于氮低效品种,并且根系空间分布更合理。此外,玉米氮吸收能力还受土壤氮素转化的影响,但目前关于不同玉米品种根区氮素转化差异的研究较少。深入研究不同玉米品种根区土壤氮素转化差异,明确关键影响因素,对提高玉米氮肥利用效率以及氮高效玉米品种选育具有重要意义。
土壤氮素转化主要包括硝化过程和反硝化过程[12]。硝化过程是指NH3在好氧微生物的作用下氧化成,接着被氧化为的过程,其中第1 步的氨氧化过程被认为是限速步骤,由氨氧化细菌(ammonia-oxidizing bacteria,AOB)和氨氧化古菌(ammonia-oxidizing archaea,AOA)共同驱动[13-14]。前人研究表明:不同玉米品种的硝化过程存在一定差异[15]。SARR 等[16]研究发现:植株会通过影响AOA 和AOB 的丰度来影响硝化过程。硝化过程不仅受品种和氨氧化微生物的影响,还受土壤pH[17]、速效氮[18]、有机质[19]和温度[20]等土壤理化性质的影响。反硝化过程是指在厌氧条件下微生物将硝酸盐或亚硝酸盐还原成N2O、NO和N2的过程,其中第2 步还原成NO 是首次将土壤中离子态氮转化成气态氮,该过程由nirS和nirK基因编码的亚硝酸盐还原酶催化,是反硝化过程的限速步骤[21];第4 步N2O 还原为N2的过程由nosZ基因编码的氧化亚氮还原酶催化完成。这两步是土壤氮素损失的主要过程,也是目前人们关注的重点[22]。不同玉米品种之间反硝化过程也存在一定差异。前人研究表明:氮低效玉米品种T250 根际土壤norB/C和nosZ反硝化基因表达量高于氮高效玉米品种LO5[15]。尽管前人比较了不同玉米品种硝化或反硝化过程之间的差异,但由于硝化和反硝化之间相互影响,需要综合研究才能更全面地理解玉米品种氮素转化过程,然而,目前鲜有结合2 个过程的综合研究。
玉米的氮素转化还受土壤供氮量的影响,在不同含氮量下玉米对氮的需求存在一定差异,因此会反向影响土壤氮素转化。本研究设置了传统施氮处理和不施氮处理,比较不同玉米品种之间硝化和反硝化能力的差异,分析AOA 和AOB 以及nirK、nirS和nosZ型反硝化微生物的丰度差异,结合玉米氮素积累的分析,明确影响玉米氮利用的关键过程和主导因素,以期为阐明不同玉米品种氮素转化差异特点、提高玉米氮肥利用效率和氮高效玉米品种选育提供科学依据。
1 材料与方法
1.1 试验地点
试验于2018 年5—7 月在安徽农业大学生物科技楼人工气候室进行。试验用土壤取自安徽农业大学农翠园(N32°52′,E117°14′),土壤类型为黄褐土,基础理化性质为:全氮含量1.26 g/kg,全磷含量0.48 g/kg,全钾含量17.97 g/kg,有机质含量19.43 g/kg,有效磷含量11.41 g/kg,速效钾含量184.61 mg/kg,pH 值为7.37。
1.2 试验设计与样品采集
在前期14 个玉米品种筛选试验的基础上,选取了具有代表性的4 个不同基因型玉米品种作为试验材料,分别是:伟科702、隆平206、农华101 和先玉335。试验设置2 个氮素水平:0 (CK)和220 kg/hm2(N),每个处理3 次重复。根箱由PVC 管制成(直径16 cm,高30 cm,单边封口),中间用20 μm 尼龙网分成3 个隔室以确保根系无法穿过,中间隔层土壤为根区土壤。磷肥(P2O5)和钾肥(K2O)施用量分别为44.58 和46.88 mg/kg。氮、磷和钾肥分别选用尿素、过磷酸钙和氯化钾。肥料与土壤掺混均匀后放入根箱内,在中间隔室播种2 粒玉米种子,到三叶期进行间苗,每个根箱保留1 株玉米苗。人工气候室设置为:白天温度30 ℃,持续16 h;夜间温度20 ℃,持续8 h;相对湿度为70%。
在玉米生长第20 天,对根箱进行破坏性取样。将玉米植株地上部分从根箱中取出,置于烘箱中105 ℃杀青30 min,85 ℃烘干至恒质量,称量并记录植株干质量。植株样品粉碎过筛,用元素分析仪(Elementar Vario Micro Cube,德国)测定全氮含量。从中间隔层中取出土壤,去除玉米根系后过2 mm 筛。将土壤分为两部分储藏,一部分放在-80 ℃保存,用于硝化和反硝化功能基因丰度测定;另一部分土壤样品放入4 ℃冰箱保存,用于室内培养试验和土壤理化性质测定。
1.3 土壤理化性质测定
土壤pH 值由pH 计(ST3100,中国)测定,水土体积比为2.5∶1.0;称取鲜土10 g,加入1 mol/L KCl 溶液50 mL,振荡浸提30 min,过滤后使用化学分析仪(Cleverchem380plus,德国)测定土壤硝态氮和铵态氮含量;称取鲜土10 g,用0.5 mol/L K2SO4溶液振荡浸提30 min,过滤后采用有机碳分析仪(Analytik Jena,德国)测定土壤可溶性有机碳(DOC)。
1.4 硝化势测定
采用悬浮液培养法[23]。称取鲜土5 g 置于培养瓶中,加入硝化培养液(含1.5 mmol/L0.3 mmol/L KH2PO4和0.3 mmol/L K2HPO4) 50 mL,在恒温振荡器 (30 ℃,1 80 r/min) 中振荡培养48 h,分别在培养后6、12、24、36 和48 h 取样,共取样5 次。取样前摇匀,每次吸取混合液4 mL 离心后取上清液,用化学分析仪测定的含量。硝化势用单位时间内的产生量表示。
1.5 反硝化能力测定
参照ŠIMEK 等[24]的标准方法。称取2 份相当于10 g 干土的鲜土置于培养瓶中,再均匀加入42.9 mmol/L KNO3培养液5 mL,加铝盖密封;用真空泵抽真空,再用氦气反复冲洗3 次。一组向瓶中加入乙炔10 mL,其N2O 气体变化率为反硝化能力,代表单位时间内反硝化总量(N2O+N2)的产生率;另一组不作处理,N2O 气体变化率代表反硝化过程N2O 排放率。平衡大气压后,将培养瓶置于恒温培养箱静置培养48 h,期间,分别在24 和48 h 时用注射器收集气体5 mL,取样后加入等量氦气平衡大气压。采用气相色谱仪(Agilent 7890A,美国)测定N2O 含量。
1.6 土壤微生物总DNA 提取和功能基因荧光定量分析
称取土样0.5 g,使用土壤DNA 提取试剂盒(Fast DNA Spin Kit For Soil,美国)提取土壤微生物总DNA,提取总量约为80 μL。AOB 和AOA功能基因amoA的丰度采用实时荧光定量PCR 系统(StrataGene Mx3005P,美国)测定,扩增引物分别选择amoA1F/amoA2R和Arch-amoAF/ArchamoAR;反硝化菌功能基因nirK、nirS和nosZ的扩增引物分别选择nirK1F/nirK5R、nirScd3aF/nir-SR3cd和nosZ1F/nosZ1R。质粒和标准曲线的制作按照王晓辉[25]的方法。
1.7 数据统计与分析
数据采用SPSS 23 进行方差分析和相关性分析;采用Heml 1.0 软件制作热图;使用Canoco for Windows 软件(版本4.5)进行冗余分析;采用Microsoft Excel 2019 作图。
2 结果与分析
2.1 不同品种玉米根区土壤理化性质差异
由表1 可知:CK 处理下,WK702 和LP206根区土壤pH 值显著低于NH101 和XY335,XY-335 根区土壤硝态氮含量为 30.40 mg/kg,显著高于WK702 和LP206;施氮处理下,不同品种玉米根区土壤pH 值无显著差异,WK702 根区土壤中含量最低,而NH101 最高;CK和施氮处理下,不同品种玉米根区土壤可溶性有机碳含量均无显著差异,但铵态氮含量均呈LP-206<WK702<XY335<NH101 的规律,且4 个品种间的差异达到显著水平。

表1 不同玉米品种根区土壤理化性质差异Tab.1 Differences in soil physical and chemical properties in root zone of different maize varieties
2.2 不同品种玉米地上部氮素积累量差异
由图1 可知:CK 处理下,WK702 和LP2-06 地上部氮素积累量分别比NH101 高24.6%和24.4% (P<0.05),分别比XY335 高21.4%和21.2%(P>0.05);施氮处理下,WK702 和LP206 地上部氮素积累量均显著高于NH101 和XY335。

图1 不同品种玉米地上部氮素积累量差异Fig.1 Differences in aboveground nitrogen accumulation of different maize varieties
2.3 不同品种玉米根区土壤硝化势及氨氧化细菌和古菌丰度差异
由图2 可知:CK 处理下,WK702 和LP206根区土壤硝化势均显著低于XY335,且分别较NH101 低35.5%和15.6%;施氮处理下,不同品种玉米根区土壤硝化势无显著差异。
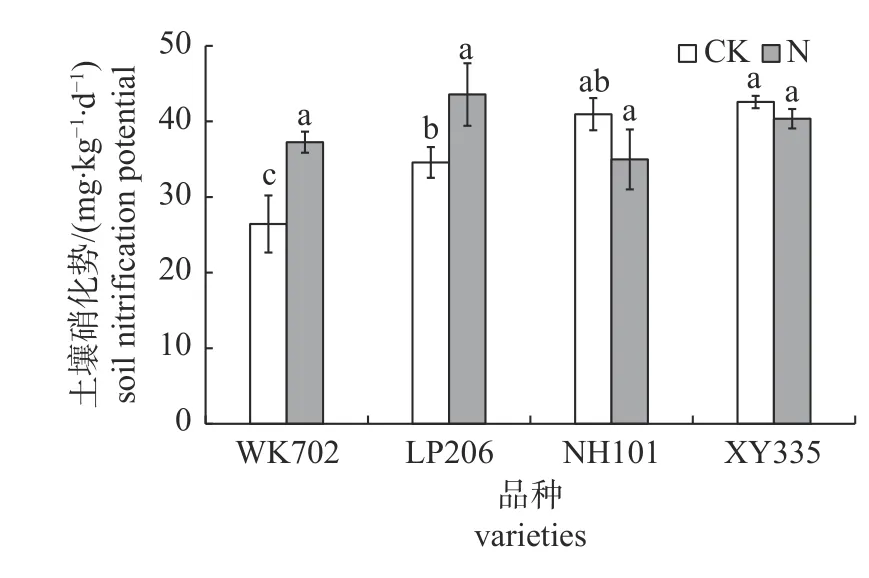
图2 不同品种玉米根区土壤硝化势差异Fig.2 Difference of soil nitrification potential in root zone of different maize varieties
由图3 可知:CK 处理下,WK702、LP206和XY335 根区土壤AOA-amoA拷贝数显著低于NH101,而WK702、LP206 和XY335 之间无显著差异;WK702 和LP206 根区土壤中AOB-amoA拷贝数显著低于NH101,XY335 根区土壤AOBamoA拷贝数分别是WK702、LP206 和NH101 的2.4 倍、2.5 倍和1.5 倍;施氮处理下,XY335 和WK702 根区土壤AOA-amoA拷贝数显著高于LP-206 和NH101,4 个品种的AOB-amoA拷贝数大小依次为XY335>LP206>NH101>WK702,且差异达到显著水平。

图3 不同品种玉米根区土壤氨氧化古菌(AOA)和氨氧化细菌(AOB)丰度差异Fig.3 Differences in the abundance of ammonia-oxidizing archaea (AOA) and ammonia-oxdizing bacteria (AOB) in root zone of different maize varieties
2.4 不同玉米品种根区土壤反硝化能力和反硝化菌群丰度差异
由图4 可知:CK 处理下,WK702 根区土壤反硝化能力显著低于NH101 和XY335,且LP206分别比NH101 和XY335 低17.8%和19.5%;施氮处理下,WK702 和LP206 根区土壤反硝化能力均显著低于NH101,且分别比XY335 低24.1%和29.5%。

图4 不同玉米品种根区土壤反硝化能力差异Fig.4 Difference of soil denitrification ability in root zone of different maize varieties
由图5 可知:CK 处理下,nirS基因拷贝数大小依次为WK702<LP206<NH101<XY335,且4 个品种间差异达显著水平;WK702、LP206 和NH101 根区土壤中nirK基因拷贝数均显著低于XY335;WK702 和LP206 根区土壤中nosZ基因拷贝数均显著低于NH101,且XY335 比NH101高2 倍;施氮处理下,WK702 和NH101 根区土壤中nirS基因拷贝数显著低于LP206,且LP206显著低于XY335;WK702 根区土壤nirK基因拷贝数显著低于其他3 个玉米品种,LP206 和NH101显著低于XY335;nosZ基因拷贝数大小依次为WK702<LP206<NH101<XY335 的趋势,且4 个品种间差异达到显著水平。

图5 不同品种玉米根区土壤nirS、nirK 和nosZ 丰度差异Fig.5 Differences in the abundance of nirS,nirK and nosZ in the root zone of different maize varieties
2.5 不同玉米品种根区土壤氨氧化微生物热度分析
由图6a 可知:不施氮条件下,AOA 的OTU1、OTU2 和OTU17 在WK702、LP206、NH101和XY335 的根区土壤中占优势地位,占比分别达到64.6%、65.8%、66.1%和64.6%;WK702和LP206 根区土壤中OTU11 和OTU19 的丰度高于NH101 和XY335;NH101 根区土壤中OTU4、OTU2 和OTU13 菌群占优;XY335 根区土壤中OUT12 和OUT14 丰度低于其他3 个品种。由图6b 可知:WK702、LP206、NH101 和XY335根区土壤中均以OTU1 为优势菌群,分别占总OUT 丰度的65.7%、72.9%、67.8%和64.1%;WK702 根区土壤中OTU6、OTU14、OTU16、OTU21、OTU22 和OTU24 菌群占优势地位;LP-206 根区土壤中OTU4、OTU6、OTU10、OTU-16、OTU19 和OTU25 的丰度低于其他3 个品种;NH101 根区土壤中OTU25 和OTU23 菌群占优势;NH101 和XY335 的OTU3、OTU9、OTU15和OTU17 菌群丰度高于WK702 和LP206。
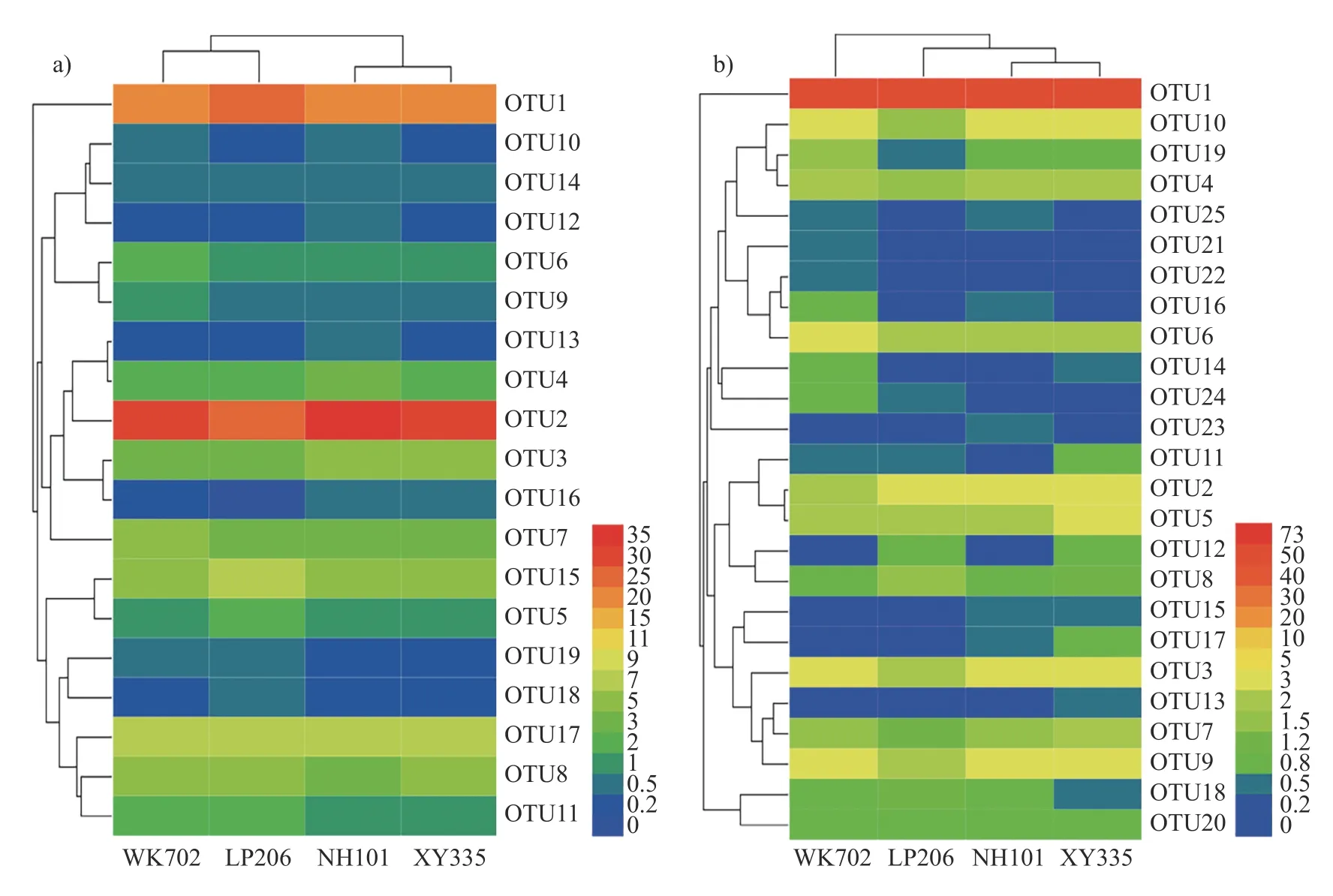
图6 CK 处理不同品种玉米根区土壤AOA (a)和AOB (b)热图Fig.6 Heat map of soil AOA (a) and AOB (b) in the root zone of different maize varieties treated with CK
2.6 不同品种玉米根区土壤AOA 和AOB 群落与环境因子冗余分析
由图7 可知:对AOA 而言,二维分析解释了36.2%的群落环境关系累积方差,AOA 群落结构与含量极显著负相关(P<0.01)、与含量显著负相关(P<0.05);对AOB 而言,二维分析解释了32.9%的群落环境关系累积方差,AOB 群落结构与根区土壤pH 值呈显著正相关(P<0.05)。LP206、NH101 和XY335 的AOA 和AOB 群落结构存在显著差异。

图7 CK 处理不同品种玉米根区土壤AOA (a)和AOB (b)群落与环境因子的冗余分析Fig.7 Redundancy analysis of soil AOA (a) and AOB (b) community and environmental factors in the root zone of different maize varieties treated with CK
2.7 不同品种玉米各因子间相关性分析
CK 处理下,不同品种玉米地上部氮素积累量与根区土壤硝化势(r=-0.608)和反硝化能力(r=-0.658)呈显著负相关(P<0.05);土壤硝化势与AOB-amoA基因拷贝数(r=0.723,P<0.01)呈极显著正相关,反硝化作用与nirS基因拷贝数(r=0.689,P<0.05)呈显著正相关;根区土壤pH 与AOB-amoA(r=0.837)和nirS基因拷贝数(r=0.816)呈极显著正相关(P<0.01),与nirK(r=0.673)和nosZ基因拷贝数(r=0.701)呈显著正相关(P<0.05);含量与AOB-amoA(r=0.789)、n irS(r=0.772)和nosZ基因拷贝数(r=0.740)呈极显著正相关(P<0.01),与nirK基因拷贝数(r=0.678,P<0.05)呈显著正相关;含量与AOA-amoA基因拷贝数(r=0.901,P<0.01)呈极显著正相关。
施氮处理下,不同品种玉米地上部氮素积累量与土壤反硝化能力(r=-0.734)和nosZ基因拷贝数(r=-0.726)呈极显著负相关(P<0.01);nosZ基因拷贝数与土壤pH (r=0.665)、(r=0.630)和含量(r=0.612)呈显著正相关(P<0.05);含量与反硝化能力(r=0.676,P<0.05)呈显著正相关。
3 讨论
3.1 不同品种玉米的氮素积累能力差异
前人研究发现:不同基因型玉米的氮素吸收速率和氮素吸收能力存在一定差异[26-27],而玉米植株在一定时期氮素的积累量从某种意义上反映了玉米的氮素吸收率和吸收能力。本研究中,无论是否施氮,WK702 和LP206 地上部氮素积累量均高于NH101 和XY335,说明WK702 和LP-206 的氮素吸收效率高于NH101 和XY335。玉米的氮素积累量反映了植株对氮素的吸收和同化能力[28],此外,有研究指出:硝化和反硝化会显著影响玉米根系对氮素的吸收[29]。本研究相关性分析发现:地上部氮素积累量与根区土壤硝化和反硝化呈显著负相关,说明不施氮处理下高氮吸收效率品种根区土壤硝化势和反硝化能力低,土壤氮素损失少,植株吸收的氮素多,地上部氮素积累量高;而在施氮处理下,地上部氮素积累量仅与根区土壤反硝化能力呈极显著负相关,推测土壤氮素充足的情况下,氮素损失主要以反硝化为主。因此,在高氮吸收效率品种选育过程中需重视根区氮素的反硝化损失。
3.2 不同品种玉米的硝化过程差异
硝化作用是土壤氮素循环的重要组成部分,与植物生长所需氮的有效性和氮素利用效率密切相关[30-31]。本研究分析了不同品种玉米在不同氮素水平下的根区土壤硝化过程差异。CK 处理下,WK702 和LP206 根区土壤硝化势和AOB 丰度均低于NH10;施氮处理下,4 个玉米品种硝化势无显著差异。AOA 和AOB 是驱动土壤硝化作用的关键微生物[32]。前人研究发现:在许多生态环境下,AOA 数量均高于AOB[33-34],AOA 也在农业土壤氨氧化过程中发挥着重要作用[35]。本研究中,CK 处理各品种根区土壤中AOA 丰度均高于AOB,这与AOA 适宜在营养贫瘠的低氮环境中生存的特性[36-37]相符。相关性分析发现:土壤硝化势仅与AOB 丰度呈极显著正相关,而与AOA 无相关性,说明AOB 在硝化过程中的作用更加重要。此外,AOB 丰度与根区土壤含量呈极显著正相关。在低pH 或低氮环境下,植物会产生一类抑制硝化作用的物质——生物硝化抑制剂[38-39],这种物质会通过抑制AOA 和AOB 丰度达到减弱硝化作用的目的[40]。本研究中,WK702 和LP206 根区土壤pH 和含量低于NH101 和XY335,可能会诱导玉米根系分泌某种生物硝化抑制剂,抑制AOB 丰度,这种物质具有减少土壤氮素损失的潜力,是未来研究的方向。不同品种玉米不仅会影响土壤氮循环微生物丰度,还会影响微生物的群落结构[15]。热图分析发现:CK 处理下各品种玉米AOB 群落结构差异较大,NH101 和XY335的OTU3、OTU9、OTU15 和OTU17 菌群丰度高于WK702 和LP206,推测这些菌群可能与不同品种的硝化作用差异有关;AOB 的OUT1 菌群占比最高,该菌群可能也与硝化作用密切相关。冗余分析发现:土壤pH是影响AOB 群落结构的重要因素,而AOA 群落结构与土壤含量密切相关。本研究发现:低氮土壤中,含量与AOA 菌群结构呈极显著负相关,而AOA 的结构反映了其优势种群的相对丰度。本研究显示:低氮环境中,含量可显著影响AOA 菌群中某种优势种群的相对丰度,如土壤含量从1.68 mg/kg 上升到2.77 mg/kg 时,OTU1 相对丰度从27.5%降低到23.4%,与VERHAMME 等[41]的研究结果类似。值得注意的是,低氮土壤中与AOA 丰度呈极显著正相关,说明土壤提供了更多的,为AOA 的生长提供了更多的能源和底物,促进了AOA 丰度的提高[42]。可见,低氮土壤中,含量会改变AOA 菌群结构,也会显著提高AOA的丰度,进而影响根区土壤氮素的转化。
3.3 不同品种玉米的反硝化过程差异
前人研究发现:不同玉米品种土壤反硝化过程存在显著差异[43]。本研究CK 处理中,不同品种玉米根区土壤反硝化能力存在一定差异,WK-702 根区土壤反硝化能力显著低于NH101 和XY-335,说明WK702 通过反硝化损失的土壤氮素较NH101 和XY335 少。反硝化作用由反硝化微生物驱动,其丰度变化会对反硝化作用产生一定的影响[43]。CK 处理下,各品种根区土壤中nirS、nirK和nosZ基因拷贝数均表现为WK702<LP2-06<NH101<XY335,且nirS基因拷贝数比nirK和nosZ基因低1~2 个数量级。nirS型反硝化菌适宜生活在有机质和营养元素丰富的环境中[44],而CK 处理根区土壤营养贫瘠,这可能是导致nirS基因拷贝数低的原因。相关性分析显示:根区土壤反硝化能力仅与nirS基因拷贝数呈显著正相关,说明nirS型反硝化菌虽然数量少,但在反硝化过程中起着至关重要的作用。前人研究发现:土壤理化性质会显著影响反硝化菌丰度[45]。本研究发现:pH 和含量显著影响nirS、nirK和nosZ基因拷贝数,且不同品种玉米根区土壤pH和含量存在差异,但彭钰洁等[46]研究表明:在85%常规施氮量下,玉米根系分泌物中苹果酸水平显著上升,说明不同品种玉米根区土壤反硝化微生物丰度出现差异可能与根系分泌的有机酸不同有关。作为反硝化作用的底物,其含量也会对反硝化微生物丰度产生影响。
4 结论
CK 处理下,WK702 和LP206 地上部氮素积累量高的原因在于硝化和反硝化造成的氮素损失量少;AOB 在硝化过程中发挥重要作用,其丰度变化与根区土壤pH 和含量有关;土壤含量是影响AOA 群落结构的重要因素;pH 和含量差异也是造成土壤nirS、nirK和nosZ基因拷贝数变化的主导因子。施氮处理下,WK702 和LP206 反硝化损失的氮素较少是导致其地上部氮素积累量高的主要原因;减少氮素反硝化损失是提高玉米氮素积累的重要途径。在未来选育高氮吸收效率玉米品种时,要注重在低氮条件下筛选。
