自修复天然高分子水凝胶的研究进展
2022-12-13曲剑波车焕洁徐建春祝晓云徐炳政王晓娟
曲剑波,车焕洁,李 静,徐建春,祝晓云,徐炳政,王晓娟
(1.中国石油大学(华东)化学化工学院,山东青岛 266580; 2. 青岛科海健堂生物有限公司,山东青岛 266000)
20 世纪60 年代,人们发现了水凝胶并将其加以生产和应用。水凝胶是一种以水为分散介质的三维交联聚合物网络体系[1],具有优异的吸水、保水性以及模拟天然细胞外基质特性等[2]优异的理化性质,在日用化工、组织工程、生物医学和传感等领域被广泛应用[3,4]。各种天然和合成的聚合物均可以通过物理缠结或共价交联来形成水凝胶[5],即天然高分子水凝胶和合成高分子水凝胶。天然高分子水凝胶具备良好的生物安全性和降解性,作为生物医学材料有着巨大的应用潜力,受到越来越多的关注[1]。近年来,各种类型的智能水凝胶,如环境响应型、自修复型、自组装导电型、形状记忆型及超分子水凝胶等得到了迅速发展,极大拓展了水凝胶的应用领域。通常水凝胶极易受到机械力的变化和化学侵蚀而产生微裂纹,这些裂纹的进一步扩展便会影响到水凝胶结构的完整性,其网络结构受到破坏,使用寿命和功能受到影响[6]。自修复型水凝胶的出现可以有效解决上述问题,这是一种可以在受到损伤后自动恢复其完整性和自身功能的一类新型水凝胶,通过愈合机制自动响应损伤[7],类似于有机体组织的愈合[8],有效提升了使用安全性,从而引起了研究者的广泛兴趣和高度关注。
自修复水凝胶的研究已成为生物医学材料领域的研究热点,人们对新型自修复天然高分子水凝胶的研究正在不断深入。本文总结了胶原蛋白、纤维素、壳聚糖以及透明质酸4 种自修复天然高分子水凝胶最新的研究进展,包括具有刺激响应性特征的自修复水凝胶,并对其未来发展方向进行了相关展望,为制备新型自修复水凝胶提供参考。
1 水凝胶自修复机理
利用动态键合成的自修复水凝胶可以通过修复裂纹形状来恢复破损变形的结构,对水凝胶的结构和功能恢复起着重要作用。目前,根据是否添加修复剂,自修复方法分为外援型自修复和本征型自修复2 种[9](Fig.1)。外援型自修复水凝胶是将愈合剂或催化剂以微胶囊、微脉管、空心纤维管等形式包含在水凝胶基质中,当使用过程中水凝胶产生裂纹时,愈合剂便从中释放出来,填充损伤区域并重新接合裂纹面,但受到微胶囊、微脉管形式以及浓度等限制,外援型自修复水凝胶通常仅适用较小创面的愈合。与之相反,完全依靠聚合物内部化学结构的性质来实现修复功能的称为本征型自修复,其依赖于水凝胶自身物理、化学和超分子相互作用来实现愈合过程[10,11]。

Fig.1 Cross-linking mechanism of self-healing hydrogels
此外,根据是否需要外来的能量或刺激响应(水、光、温度和酸碱度等)来完成修复过程,可以将本征型水凝胶分为非自主自修复水凝胶和自主自修复水凝胶[12]。相应地,获得自修复水凝胶的方法又可以分为化学交联(动态共价键)和物理交联(非共价键)。对于化学交联,常见的动态共价键有亚胺键、硼酸酯键、酰腙键、二硫键等[10]。一般而言,可逆动态共价键能赋予水凝胶很好的力学强度,但需要施加一定的外部刺激和相应的聚合条件[13]。而物理交联通常通过动态非共价键实现,例如静电相互作用、疏水相互作用、主-客体相互作用、结晶和氢键等,可以在没有任何外部因素的情况下可逆形成和快速重塑[14]。近年来,自修复水凝胶因其具有自主修复损伤、保持结构和性能完整性、长期使用功能稳定等独特优点而备受关注[15],更多研究者开始进行了相关自修复水凝胶的探索。
2 自修复天然高分子水凝胶
目前文献报道的天然高分子水凝胶材料主要包括胶原蛋白、明胶、葡聚糖、纤维素、木质素、壳聚糖、透明质酸、海藻酸钠、瓜尔胶等,研究者们以它们为基材制备了一系列具有自修复功能的天然高分子水凝胶,下面主要介绍有代表性的胶原蛋白、纤维素、壳聚糖和透明质酸4 类自修复水凝胶。
2.1 胶原蛋白自修复水凝胶
胶原蛋白是一种存在于皮肤和软骨中的常见天然纤维蛋白,其基本结构是由3 条多肽链互相缠绕形成的螺旋状纤维,是细胞外基质的主要结构蛋白[16]。胶原蛋白具有良好的生物相容性、高亲水性和低免疫原性等特点[17],可以促进细胞黏附和增殖,加速伤口愈合,广泛应用于生物医学材料领域。
Zhang 等[18]通过高碘酸钠氧化瓜尔胶得到双醛改性的瓜尔胶(DAGG),DAGG 可以与胶原蛋白上的氨基交联形成动态席夫碱,为了增强水凝胶的自愈性能,作者还在该体系中加入了硼砂,因为硼酸根离子可以与瓜尔胶/胶原蛋白分子链上的羟基形成二醇-硼酸酯键,进一步支持水凝胶的动态网络,交联机制如Fig.2 所示。这种胶原基水凝胶显示出了良好的可注射性、热稳定性和快速自愈能力(3 min),且其组织再生能力优越,可以作为伤口敷料应用于组织工程中。在此体系的基础上,Zhang等[19]加入了聚N-异丙基丙烯酰胺、氧化石墨烯和硼砂制备了新型胶原基多功能水凝胶,拉伸性能大幅度提高,可拉伸至原始长度的50 倍,同时增加了热响应、导电和近红外敏感等特性,在近红外光的照射下,水凝胶可以在600 s 内从15 ℃升高至38.2~47.6 ℃,可用作光热疗法中的伤口敷料,通过提高局部温度对细菌造成热破坏,在无创肿瘤治疗领域显示出巨大的应用潜力。

Fig.2 Construction mechanism of collagen-guar gum hydrogel, involving imine linkages, diol-borate ester bonds and supramolecular interactions[18]
Chen 等[20]使用醛基官能化的氧化葡聚糖作为大分子交联剂来增强胶原蛋白水凝胶的强度。利用席夫碱反应得到的胶原蛋白(Col)/氧化葡聚糖(DAD)水凝胶比原始纯胶原蛋白水凝胶机械强度增加接近20 倍,从Fig.3 中也可以看出,当Col/DAD比值为(50/50)时,断裂强度可进一步提高到(32.5 ±1.6) kPa,显示出更好的热稳定性和自修复性。Lei等[21]通过将单宁酸(TA)和类人胶原蛋白(HLC)加入到聚乙烯醇和硼砂体系中,通过动态交联网络来制备自修复导电复合水凝胶。硼砂作为交联剂且提供了离子导体,使水凝胶具有良好导电性,该水凝胶的电导率处于皮肤电导率的范围内(1×10−5~0.26 S/m),并且HLC 和TA 赋予水凝胶较好的抗菌、止血、抗炎和细胞增殖等特性。这种水凝胶具有良好的力学强度(弹性模量高达104Pa)和自修复性(30 min),当外界皮肤受到损伤时,可以保持水凝胶的完整性和导电性,确保伤口处细胞信号的连续性和稳定性。结合电刺激,可以有效地促进细胞间信号传递和外部电流传递,从而促进细胞迁移、增殖和伤口愈合,有望成为一种新型深度伤口创面的治疗材料。
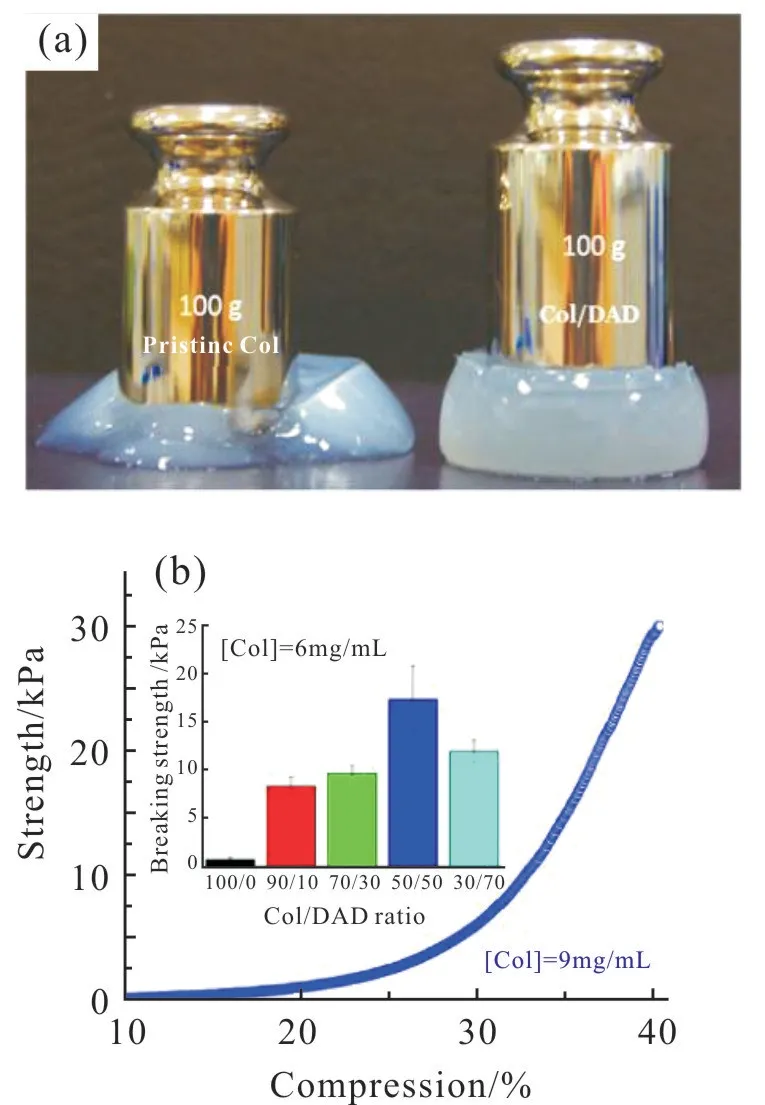
Fig.3 (a) Digital photo of pristine Col hydrogel and Col/DAD hydrogel subjected to compression by 100 g mass; (b)representative stress −compression curve of the Col/DAD hydrogel (Col/DAD = 50/50, [Col] = 9 mg/mL). Inset is the comparison of the breaking compressive strength of the hydrogels with different Col/DAD ratios([Col]=6 mg/mL)[20]
明胶是胶原蛋白在高温作用下的变性产物,具有高温溶解、低温成胶的特性,所得的水凝胶通常力学性能较差,限制了其应用领域。因此,大多将明胶进行改性或通过交联等来提高其力学性能。Banerjee 等[22]利用氧化海藻酸盐、明胶和硼砂反应生成可逆硼酸酯键和席夫碱键,制备得到一种可注射的快速自修复水凝胶。在硼砂溶液的存在下,其可以在30 s 内迅速成胶,且该水凝胶所能承受的破裂压力为(70±3) mmHg,完全可以承受骨关节在运动或静止条件下的压力,同时具有良好的生物相容性,可以促进小鼠软骨细胞的附着、迁移和增殖,用于骨关节炎的相关治疗。
2.2 纤维素自修复水凝胶
纤维素是自然界中最丰富的可再生生物资源,作为一种由葡萄糖组成的大分子多糖,具有良好的生物相容性、生物可降解性和高强度等优异的物理特征,但因溶解性相对较差[23]而限制了其应用领域。羧甲基纤维素(CMC)[24]是纤维素的一种衍生物,其分子主链上有大量的羧基和羟基,亲水性强,具有更好的溶解性[25],因此,羧甲基纤维素比纤维素的应用更为广泛。
Li 等[26]以羧甲基纤维素和多巴胺为原料,通过简单的一步法同时进行酰胺化和氧化自聚反应构建了新型互穿网络水凝胶(Fig.4)。水凝胶内的仲酰胺基团(C—N,—NH)与—OH 之间形成的动态氢键使其具有良好的愈合效率(3 h 内达到98.37%),同时,多巴胺的加入有效提高了其黏附性(黏附强度可达(427±4) kPa)和导电性,对人体的各种运动都比较敏感(灵敏度系数GF=4.71),可以有效地传递电信号,良好的自愈性解决了传统水凝胶传感器中关键的破损问题,作为仿生皮肤和柔性可穿戴电子设备材料有潜在应用。Pang 等[23]开发了一种导电性的自修复水凝胶,利用羧甲基纤维素和聚丙烯酸的氢键作用,以及Al3+和COO-的配位作用构成了自修复的交联网络,愈合效率在60 min 内达到96.3%。该水凝胶表现出优异的力学性能(拉伸强度为249 kPa),且具有较好的灵敏度,可以监测人体的细微运动,为纤维素基水凝胶可穿戴传感器开辟了新的平台。Deng 等[27]以木质素和纤维素为基材制备了多功能自修复水凝胶,其中木质素的还原官能团如甲氧基和酚羟基可以将银离子(Ag+)还原成银纳米颗粒,两者之间的络合作用形成醌/邻苯二酚结构,赋予水凝胶良好的抗菌性和重复黏附性。同时,邻苯二酚结构可以与苯基硼酸修饰的羟丙基纤维素之间形成动态可逆硼酸酯键,构建自修复交联网络。该水凝胶具有良好的抗氧化性,在伤口愈合过程中,可以清除由炎症产生的大量自由基,清除效率达到92%,有效促进上皮组织再生和胶原沉积,能够加快金黄色葡萄球菌感染创面的伤口愈合,可作为伤口敷料用于生物医学领域。
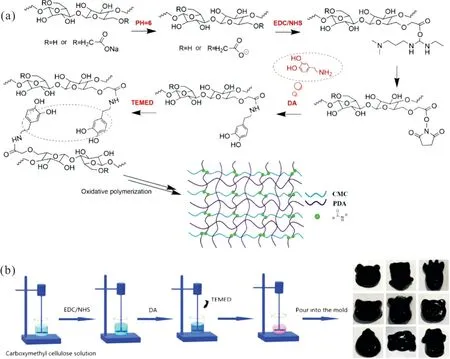
Fig.4 Design and fabrication of an all-natural interpenetrating network hydrogel
2.3 壳聚糖自修复水凝胶
壳聚糖是天然多糖甲壳素脱除部分乙酰基的产物,含有游离的氨基并呈现双螺旋结构特征[28],它是天然多糖中唯一的碱性多糖,具有广泛的抗菌性能,对真菌、细菌和某些病毒都有一定的抑制作用。壳聚糖水凝胶具有较好的生物相容性和抗菌活性[29],大多是通过共价键或一些疏水缔合等非共价相互作用制备,通常作为基因载体、抑菌剂和黏合剂等应用在医疗领域[30]。
Wei 等[30]采用壳聚糖、苯甲醛功能化的聚乙二醇,通过简单的氨基与醛基反应生成席夫碱来制备水凝胶,水凝胶可以在2 h 内很好地自愈合。同时,利用席夫碱结构在pH、酶等刺激下会发生解离的不稳定性,可以使负载在水凝胶中的药物得到快速释放,作为药物载体应用于生物医学领域。Gu 等[31]制备了基于O-羧甲基壳聚糖(O-CMCS)和β-环糊精的多功能水凝胶传感器,通过动态硼酸酯键和席夫碱键使其具有快速自愈能力,在15 s 内愈合率高达97%~103%,且对人体皮肤和器官有良好的黏附性和抗菌性,可用于监测人体的细微运动。Li 等[32]利用羧甲基壳聚糖-碳点(CMCS-CQDAG)与氧化葡聚糖反应,通过生成的动态亚胺键制备自修复水凝胶,Fig.5 为其简单的交联机理。该水凝胶可以在37 ℃下经过3 h 后充分自愈合,且其降解速度缓慢,在pH=5.5 的缓冲溶液中,9 d 后才可以完全降解,有利于细菌感染的长期治疗。另外,水凝胶中掺杂的碳点除了提供氨基参与反应外,还具有抗炎和促进伤口修复的作用:当被细菌感染时,提供的酸性条件破坏了席夫碱结构,水凝胶解离释放出碳点,从而抑制生物膜的形成,降低周围组织的感染。Guo等[33]基于接枝环糊精的季铵化壳聚糖、接枝金刚烷的季铵化壳聚糖和接枝环糊精的氧化石墨烯,通过主客体相互作用制备了一系列抗菌、自修复和导电超分子水凝胶。这些超分子水凝胶具有与皮肤相似的导电值(2.60×10−6S/m)和快速自愈行为(14 s),对大肠杆菌、金黄色葡萄球菌和耐多药细菌等具有很强的抗菌性能,具有良好生物相容性,可以作为全层皮肤修复的创面敷料。

Fig.5 Synthetic route of CMCS/ODex-CQDAG-hydrogel[32]
2.4 透明质酸自修复水凝胶
透明质酸(HA)是一种酸性黏多糖,结构简单但相对分子质量较大,是天然细胞外基质的主要成分之一,可以促进组织再生,具有多种生物学功能[34]。HA 及其水凝胶良好的吸湿性和保水性可以很好地润滑组织,因而在医疗领域应用广泛,可注射HA 水凝胶作为皮肤创伤的不规则伤口敷料,能更好地帮助伤口愈合并缓解伤口疼痛,具有良好自修复功能的HA 水凝胶则可以有效延长伤口敷料的使用寿命[35]。
Varghese 等[34]设计了一种基于动态可逆酰腙键的自修复透明质酸水凝胶。通过3-氨基-1,2-丙二醇酰胺化及高碘酸钠的选择性氧化,制备了醛改性透明质酸,与酰肼修饰的透明质酸加以混合,可以在30 s 内得到无毒、黏附性较好的水凝胶,且在生理条件下稳定性良好,能够促进骨形态发生蛋白(BMP-2)的生长,用作BMP-2 蛋白载体促进骨生长增大。Li 等[36]在酸性pH 条件下,利用二醛修饰的透明质酸(AHA)与胱胺二盐酸盐(Cys)反应形成动态希夫碱,制备了自修复透明质酸基水凝胶。该水凝胶在10 min 内愈合效率可达到100%,且随着Cys/AHA 摩尔比的增加,交联密度增加,孔径结构更加致密,成胶速度加快,力学性能提高,在药物释放和细胞封装等领域有潜在应用。Yang 等[37]利用巯基修饰的聚(γ-谷氨酸)(γ-PGA-SH)和醛基修饰的透明质酸(HA-CHO)制备得到自修复水凝胶(Fig.6),γ-PGASH 中的硫醇与HA-CHO 中的醛基进行巯醛加成反应,为水凝胶提供了动态共价网络,使水凝胶具有良好的自愈性与黏附性(黏附强度为12.36 kPa),该水凝胶还具有较好的形状自适应性,可以快速渗入覆盖不规则或倾斜的伤口,可用于生物医学领域。Liu 等[35]制备了一种新型具有抗菌性能的生物黏附性自修复水凝胶,作者将氧化的透明质酸和多巴胺接枝的ε-聚赖氨酸混合,利用辣根过氧化物酶的酶促交联和席夫碱交联形成双重网络来赋予水凝胶自修复效果。该水凝胶可以在数秒内快速成胶,5 min 内愈合,能有效杀死伤口表面的细菌,加速伤口愈合,是一种新型的仿生水凝胶敷料。

Fig.6 (a)Photographs of γ-PGA-SH solution, HA-CHO solution,and γ-PGA-SH/HA-CHO hydrogel;(b)schematic of the γ-PGA/HA- CHO hydrogel crosslinked by thiol- aldehyde addition[37]
3 刺激响应性自修复水凝胶
除了自修复功能,研究者们还赋予了水凝胶各种刺激响应功能,使其在不同的外界刺激下表现出自修复特性,可用于药物控制释放、形状记忆和分子检测等[38]。根据刺激响应类别,可分为温度响应性、pH 响应性、光响应性、电响应性、氧化还原响应性以及磁响应性等多种类型水凝胶[39]。
3.1 温度响应性自修复水凝胶
温度的变化可以影响化学基团的疏水作用和大分子链的氢键作用,水凝胶通过体积的变化来响应温度的刺激,改变水凝胶的网络结构,导致体积非连续性变化[40]。聚(N-异丙基丙烯酰胺)(PNIPAM)是一种具有低临界溶解温度(LCST)的温敏性聚合物[41],其分子中含有一定比例的亲水基团和疏水基团,在不同温度下表现出不同的溶解度。Deng 等[42]以β-环糊精(β-CD)、NIPAM、碳纳米管和聚吡咯为基质,制备了具有热刺激响应性的多功能复合水凝胶,合成路线如Fig.7 所示。NIPAM 中的异丙基在体积相转变温度时变得疏水,可以与β-CD 通过主客体相互作用形成水凝胶。该水凝胶具有良好的温度响应性、导电性和稳定性,可以在1 min 内对温度和近红外光作出快速的响应,在压力传感器和电子设备中有潜在的应用。需要注意的是,PNIPAM 的LCST(32 ℃)与人的体温相差较大,并且NIPAM 单体具有毒性,其聚合后的单体残留以及聚合物的不可降解性是限制其生物医学应用的瓶颈,采用温敏性的聚乙二醇类似物代替PNIPAM 是一个可行的思路[43]。Hao 等[44]利用疏水改性壳聚糖(hm-chitosan)、5-甲基水杨酸(5mS)和十二烷基三甲基溴化铵(DTAB)制备了一种新型热响应自修复水凝胶。DTAB 和5mS 组装体随着温度升高会发生从囊泡到胶束的结构转变,低温下(15 ℃)hm-chitosan 上的C12疏水链会插入囊泡疏水层中,囊泡在凝胶网络中起到了疏水交联剂作用;高温下(55 ℃)5mS 在水溶液中溶解度增加,囊泡变成胶束导致水凝胶变成溶胶。另外,hm-chitosan/DTAB-5mS 水凝胶在1000%应变时呈溶胶状态,应变降至5%时在10 s 内便恢复到凝胶状态,体现了快速自修复性能。该温度响应性水凝胶通过利用囊泡到胶束的转变来实现自修复,在刺激响应性自愈材料的设计和制备等领域具有潜在的应用。
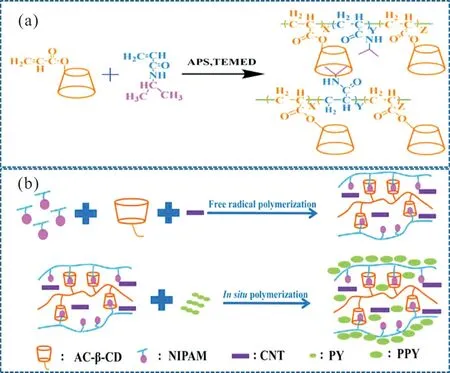
Fig.7 (a)Synthesis route of self-healing hydrogel poly(NIPAM-co- β-CD),(b)scheme of preparing conductive self-healing hydrogel poly(NIPAM-co-β-CD)/CNT/PPY[42]
3.2 pH 响应性自修复水凝胶
pH 响应性水凝胶的溶胀体积可以随着pH 值的变化而变化,可以作为药物、细胞和基因的载体,以及组织工程的支架等在医学领域广泛应用[15]。Jiang等[45]设计合成了由己二酸二酰肼接枝羧乙基纤维素和酮酯接枝聚乙烯醇构建的纤维素水凝胶,具有快速的自愈性能、pH 响应性和稳定性。由于酰腙键的可逆性,该水凝胶对pH 较为敏感,在盐酸处理后完全转变为液体,加入三甲胺中和盐酸后,可使其恢复到水凝胶状态,且由pH 介导的可逆溶胶-凝胶转变循环可持续7 次以上。Tang 等[46]在聚乙二醇端基和壳寡糖侧基上分别修饰上聚组氨酸(PHIs)和亚氨基二乙酸(IDA),在pH 为中性条件下与Ni2+进行多价配位制备了具有弱酸响应的自修复水凝胶(Fig.8)。在弱酸环境(pH=5.5)下,PHIs-Ni2+-IDA 络合结构被破坏,水凝胶会迅速水解,但在中性环境(pH=7.4)中可以保持良好的形态,其形状恢复率为90%。通过调节配体PHIs 和IDA 的比例,可以进一步调控水凝胶的稳定性和力学性能,结合刺激响应和动态自愈的特性,该水凝胶可作为用于药物控制释放的载体。pH 响应性水凝胶作为局部药物递送的生物材料,还存在pH 响应速度、药物释放速率及释放位点不理想等问题,需要在pH 应答速度和药物定点释放方面进一步开展工作。
3.3 光响应性自修复水凝胶
光可以原位施加并以特定的量精确传递,与其他水凝胶相比具有特殊的优势。Yang 等[47]利用β-环糊精(β-CD)与环氧氯丙烷聚合得到β-CD 纳米凝胶,将偶氮苯丙烯酰胺包埋于疏水空腔中,制备了含有多个双键的主客体大分子交联剂。随后,丙烯酰胺与大分子交联剂共聚得到了光响应性自修复水凝胶,反应机理如Fig.9 所示。该水凝胶通过主客体相互作用来实现自愈合,其中偶氮苯部分的光异构化现象可以改变其与β-CD 的结合力,从而可以调节水凝胶的交联密度,进一步影响自愈行为。通过光刺激来控制水凝胶自修复的开关,其愈合能力可在紫外光下失活,可见光下恢复,拓宽了水凝胶在远程遥控领域的应用。Urban 等[48]利用光化学环加成、光诱导自由基聚合、光可逆共价键的重新排列等方法设计光控自修复聚合物。凝胶网络由氧杂环己烷取代的壳聚糖前驱体加入到聚氨酯中组成。当凝胶受到机械破坏时,四元氧杂环会打开,产生2 个反应性末端。在紫外光照射下壳聚糖链发生断裂,与反应性氧杂环烷端形成交联,从而修复凝胶网络,能够在30 min 内自行修复,可用于涂层领域。光学敏感性天然高分子水凝胶在光学器件、特种药物控释器件等领域有潜在的应用价值。由于制备过程中需要对高分子进行一定的化学修饰,所需步骤较为复杂,对规模化生产工艺有更高要求,因此具有较大的工艺优化空间。

Fig.9 Synthesis of the light-switchable self-healing hydrogel and light-responsivity of the host-guest macro-crosslinke[47]
4 结论与展望
自修复天然高分子水凝胶具备了天然高分子的生物相容性好、来源丰富、价廉易得且可生物降解等优势,加上其良好的自修复性能,能够解决传统水凝胶易裂解破损问题,极大程度延长了水凝胶的使用寿命,为解决水凝胶在实际应用中的局限性开辟了新的机会。近年来,研究人员通过在天然高分子水凝胶中引入纳米粒子(石墨烯、碳纳米管、MXene 等)制备复合水凝胶、构建互穿网络结构以及引入主客体超分子相互作用等方法来进一步提高天然水凝胶的强度和韧性,增强其力学性能,从而扩展了其应用领域[1]。与传统的自修复水凝胶相比,刺激响应性自修复水凝胶具备温度、pH、光等外界环境的敏感性而引起人们的广泛关注,但仍存在一定局限,比如天然高分子自身的微观结构和理化性质在一定程度上限制了水凝胶的刺激响应强度、响应速率和临床适应性,可以采用天然高分子材料的全新改构策略,加强凝胶内部有序结构的建立,赋予材料多重刺激响应特性,进一步提高刺激响应的可控性及敏感性,制备具有多功能、多领域应用的智能天然高分子自修复水凝胶。目前,自修复水凝胶领域面临的一些挑战包括:1)自修复水凝胶的功能与种类有待丰富;2)水凝胶的力学强度和韧性仍需提高;3)关于水凝胶自愈性能的评估手段应进一步拓展;4)确保水凝胶基质中无有毒化学试剂的残留,进一步提高应用安全性。
目前,自修复天然高分子水凝胶虽受到了越来越多研究者的关注,但仍局限于组织工程、药物释放、伤口敷料等生物医学领域。未来可进一步丰富水凝胶的功能,结合光、电、磁刺激响应、形状记忆、导电性和3D 打印等特性,拓宽其在软智能机器人、仿生电子皮肤、柔性可穿戴电子设备等创新领域的应用,实现水凝胶的智能化、工业化和商业化,推动自修复天然高分子水凝胶在生物材料和智能软材料领域的发展。
