壳聚糖-马来酸/丙烯酰胺双网络型超分子水凝胶制备及应用
2022-12-13许雨芩杨建军吴庆云吴明元张建安刘久逸
许雨芩,杨建军,吴庆云,吴明元,张建安,刘久逸
(安徽大学化学化工学院安徽省水基高分子材料高性能化工程实验室,安徽合肥 230601)
水凝胶是一种具有三维网络结构的超亲水性聚合物,表现出优异的亲水性、力学稳定性和生物相容性[1]。壳聚糖(CS)是目前研究较多的抗菌性水凝胶基材,但其弱的力学韧性限制了在医学领域的应用[2]。研究发现,利用超分子相互作用的动态特性,如氢键结合[3~6]、疏水缔合[7]、离子相互作用[8,9]、主客体相互作用[10]和金属-配体相互作用[11],通过发展动态交联网络的方法可以提高水凝胶的综合力学性能。Li 等[2]在CS 中原位聚合丙烯酸(AA)和丙烯酰胺(AM)单体,高温下壳聚糖排列形成纳米纤维结构。水凝胶最大伸长率超过1600%,拉伸强度高于120 kPa,压缩应力超过120 kPa。超分子水凝胶显示出比传统共价水凝胶更大的优势。这些动态交联网络为超分子水凝胶提供了优异的强度和良好黏附能力[12,13]。
抗生素的滥用和过度使用导致了多重耐药细菌的出现[14]。受海洋生物贻贝的中邻苯二酚的启发[15,16],单宁酸(TA)是一种含有丰富邻苯二酚基团和邻苯二酚衍生物的天然多酚化合物,能抑制细菌、真菌和酵母及革兰氏阳性和革兰氏阴性细菌等多种微生物的生长[17],邻苯二酚基团中含有大量的羟基,可以产生各种强相互作用而拥有超强黏附力[18]。环糊精(β-CD)是继冠醚后第2 代超分子主体化合物,环糊精分子中因C2与C3羟基之间形成分子内氢键而导致其水溶性差,使之在许多应用上受到限制[19]。
本文采用原位共聚法和干法制备了羧甲基-β-环糊精(CM-β-CD),在壳聚糖水溶液中原位共聚马来酸酐(MAH)和丙烯酰胺(AM)形成离子配位键。再将单宁酸包合进CM-β-CD[20]中,形成包合结构负载在壳聚糖上,设计开发一种双网络型超分子抗菌水凝胶。纳米纤维结构的CS 与MAH-AM形成的双网络进一步增强了力学性能,TA-CM-β-CD 结构作为抗菌剂及其类贻贝的邻苯二酚基团提供了优异的黏附及抗菌性能。研究了水凝胶的微观形貌、抗菌性能和贴附性能等。该方法制备工艺简便,为制备超分子双网络型抗菌水凝胶提供了思路与方法。
1 实验部分
1.1 试剂与仪器
壳聚糖:脱乙酰度80.0%~95.0%,黏度50~800 MPa·s,上海强顺化学试剂有限公司;丙烯酰胺:化学纯,天津市光复精细化工研究所;马来酸酐:化学纯,天津市光复精细化工研究所;单宁酸:分析纯,上海笛柏化学技术有限公司;β-环糊精、氯乙酸(ClCH2COOH)、氢 氧 化 钠(NaOH)、无 水 乙 醇(CH3COOH):分析纯,上海阿拉丁生化科技股份有限公司;过硫酸铵(APS)、N,N’-亚甲基双丙烯酰胺(MBA):化学纯,国药集团化学试剂有限公司电子万能材料试验机:Instron5967 型,美国Instron 公司。
1.2 制备方法
1.2.1 干法制备CM-β-CD/TA 分散液:合成路线如Fig.1 所示。
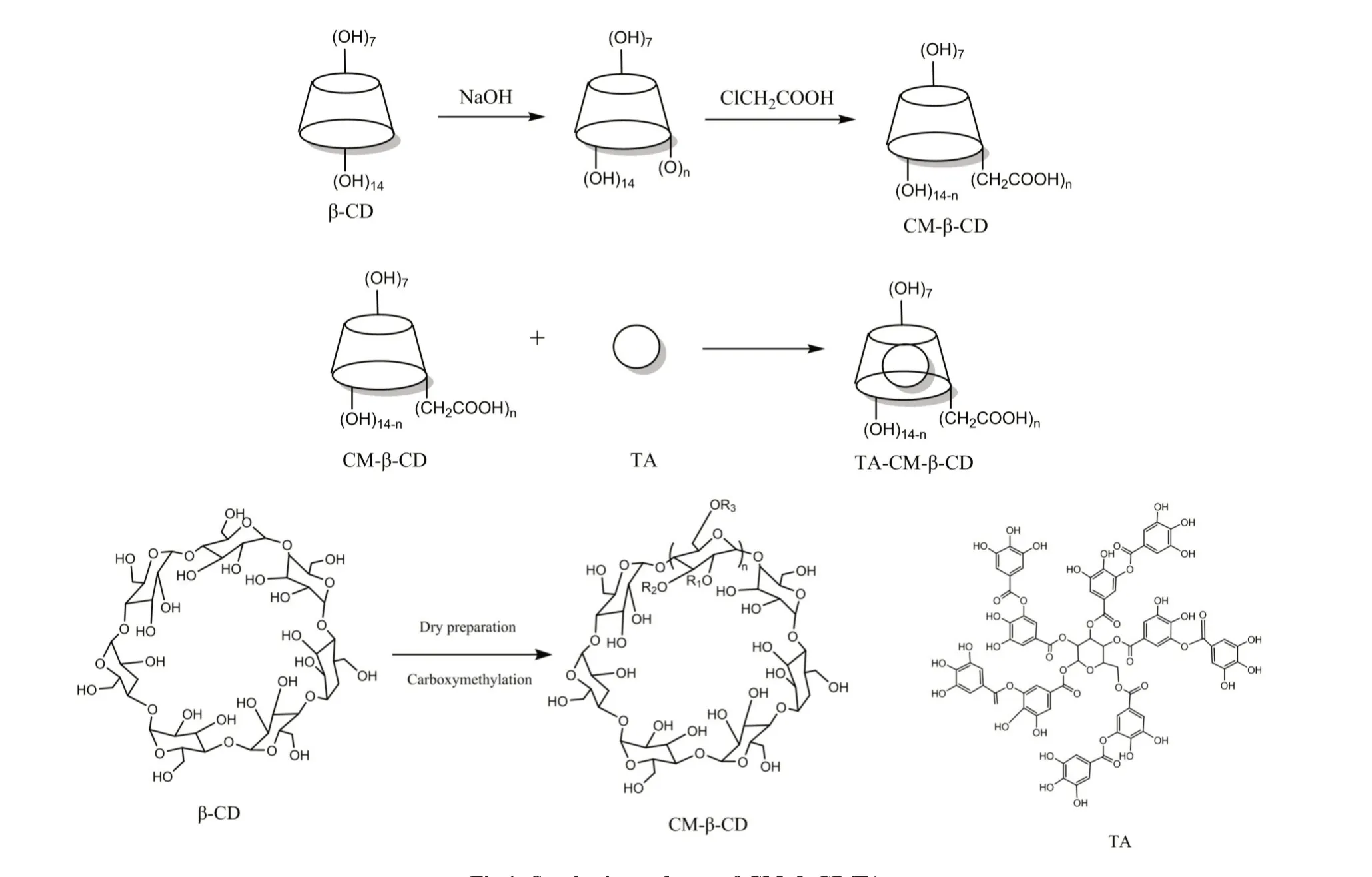
Fig.1 Synthesis roadmap of CM-β-CD/TA
取6.0 g(5.28 mmol)β-CD 于研钵中研细,加入1.26 g(31.5 mmol)NaOH 均匀混合后滴入无水乙醇和水,再加入0.08 g(0.85 mmol)氯乙酸继续研磨30 min,然后放入40 ℃烘箱中30 min,取出再次研磨30 min,如此反复进行醚化反应4 h;用乙醇洗涤2~3 次,放入60 ℃烘箱中烘干得到CM-β-CD。称取0.1 g CM-β-CD 配制成100 mg/mL 的水溶液,超声处理后形成稳定的水分散液。将50 mg(0.03 mmol)TA 倒入1 mLCM-β-CD 水溶液中进行超声处理,得到TA/CM-β-CD 分散液(TA 与CMβ-CD 的质量比分别为1∶1,1∶2 和1∶4)。
1.2.2 TA-CM-β-CD/CS/MAH-AM 双网络抗菌水凝胶的制备:称取1.0 g 马来酸酐溶于7.5 mL 去离子水(体积分数为11.7%)中,加入0.2 g 壳聚糖分散到马来酸酐水溶液中,搅拌过夜制成CS/MAH 水溶液(w=2%)。将2.0 g 丙烯酰胺加入到CS/MAH 水溶液中溶解均匀;在60 ℃加入1 mL TA/CM-β-CD 分散液(CM-β-CD 与CS 的质量比分别为1∶2 和1∶4)、0.24 mL MBA 交联剂,磁力搅拌2 h;向烧杯中加入0.6 mL APS,通入氮气,超声处理40 min。将混合溶液倒入聚四氟乙烯(PTFE)模具中,反应时间为3 h、反应温度为40 ℃,制得TA-CM-β-CD/CS/MAH-AM双网络抗菌水凝胶,合成路线示意图如Fig.2,反应机理图如Fig.3。

Fig.2 Preparation of TA-CM-β-CD/CS/MAH-AM antibacterial hydrogel
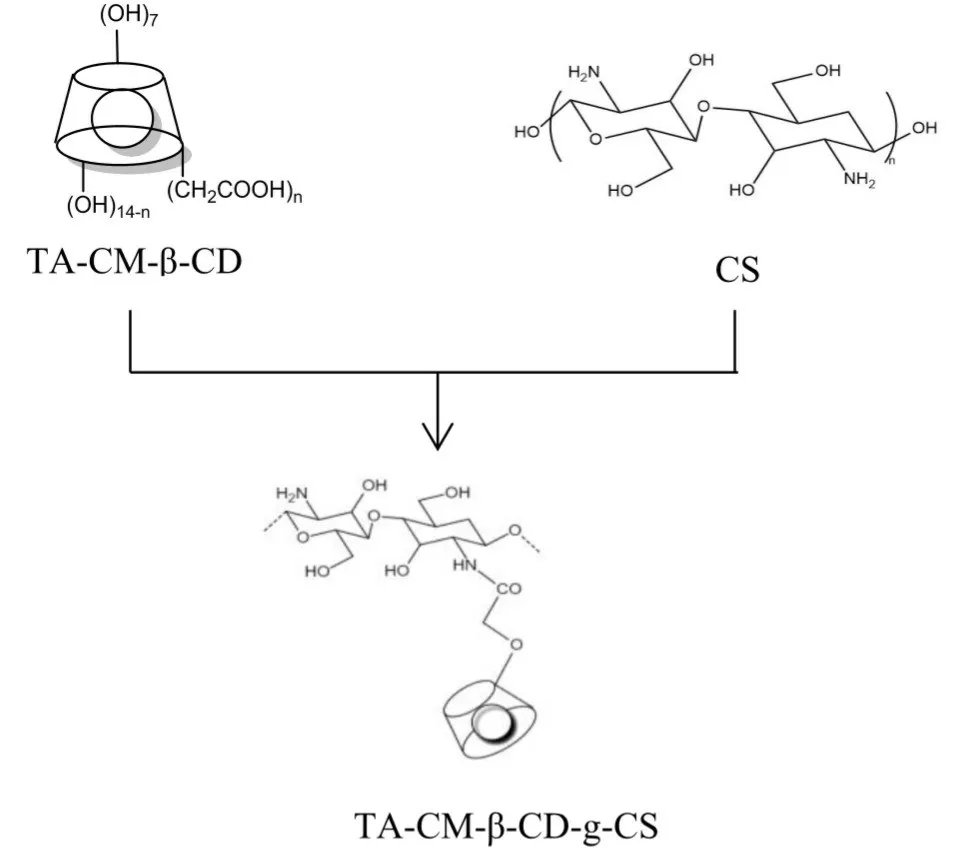
Fig.3 Schematic diagrams of reaction mechanism between TACM-β-CD/CS/MAH-AM antibacterial hydrogel
得到的产物中,m(CS)∶m(CM-β-CD)∶m(TA)分 别 为4∶1∶1,4∶2∶1,8∶4∶1,8∶2∶1,相应的TACM-β- CD/CS/MAH- AM 水 凝 胶 分 别 标 记 为PAT0.5C0.5,PAT0.5C1,PAT1C0.5和PAT1C1,组 成 成 分 及 其简称如Tab.1 所示。

Tab.1 Compositions of reaction
1.3 测试与表征
1.3.1 FT-IR 分析:采用Nexus870 型(美国Nicolet公司) 傅里叶变换红外光谱仪对冻干后的水凝胶样品进行全反射光谱扫描,扫描范围为500~4000 cm-1。
1.3.2 SEM 表征:将冻干后凝胶样品断面喷金处理后,采用Regulus8230 型超高分辨扫描电子显微镜(日本日立公司),在加速电压3 kV 下进行观察断面形貌。
1.3.3 溶胀率测试:在25 ℃,分别将干质量为mo的各凝胶样品浸没于pH=7.4 的去离子水,充分溶胀24 h 后取出,用吸水纸拭去表面多余的水分,分别对其称量记为mt。溶胀率(SR)计算公式为

式中:SR——凝胶溶胀度;mt——t时刻凝胶与吸附水的质量;mo——真空干燥至恒量时凝胶的质量。
1.3.4 保水率测试:在25 ℃,将水凝胶在去离子水中浸泡12 h 以上,然后将达到溶胀平衡的水凝胶快速转移至37 °C 的烘箱中。每隔1 h,3 h,6 h,12 h,24 h,36 h 及48 h 取出凝胶,测定水凝胶的质量(mp),直至其质量不再发生变化为止。保水率(WR)计算公式为

式中:WR——凝胶保水率;mt——t时刻凝胶的质量;mp——达到溶胀平衡的水凝胶的质量。
超声波是诊断骨盆内脏器病变最佳的辅助检查。彩色多普勒超声下输卵管癌特点:①附件区腊肠型或不规则肿物,囊性伴乳头状回声;②附件区卵巢形态完整;③附件区实性回声内血流阻力指数降低[4]。超声检查在原发性输卵管癌肉瘤与其他输卵管、卵巢良恶性肿瘤的鉴别诊断方面缺乏特异性。CT和MRI在判断输卵管周围脏器的浸润、是否有淋巴结转移及远处转移、指导选择手术方式等方面有重要参考价值。然而MRI在评估肿瘤浸润深度方面比CT更有优势。
1.3.5 黏附性测试:依据YYT-0148-2006 标准,选择猪皮作为生物体组织模型基材在恒温恒湿环境中,使用INSTRON 万能材料试验机分别测试PAT0.5C0.5,PAT0.5C1,PAT1C0.5和PAT1C1抗菌水凝胶的搭接剪切黏合性能。黏附强度通过测量的最大载荷除以黏合面积计算得到。
1.3.6 抗菌性能测试:根据GB/T20944.1—2007《纺织品抗菌性能评价第1 部分:琼脂平皿扩散法》测定水凝胶的抗菌性。将活化的大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)悬浊液稀释至106 CFU/mL后涂覆在固化的琼脂培养基上,水凝胶裁成圆形(d=20 mm)置于培养皿上37 ℃孵育24 h,观察抑菌圈大小。抑菌带宽度计算公式为

式中:W——抑菌带宽度,cm;R和d——分别为抑菌圈和样品直径,cm。
1.3.7 溶血性测试:将红细胞使用磷酸缓冲盐溶液(PBS)稀释25 倍后与水凝胶在37 ℃共培养1 h。将红细胞悬液与PBS 和去离子水共培养的组,分别作为阴性对照组和阳性对照组。共培养后的红细胞悬液用离心机在1500 r/min 的条件下离心10 min,用酶标仪测定上清液在545 nm 处的吸光度(OD)。溶血率(HR)的计算公式为
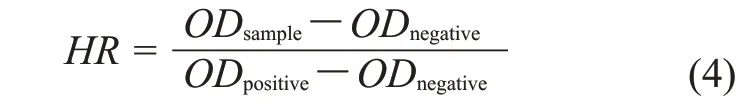
式中:ODsample,ODpositive和ODnegative——分别对应水凝胶、阳性对照和阴性对照上清液的吸光度。
1.3.8 MTT 测试:根据GB/T 1686.5—2017《医疗器械生物学评价第5 部分:体外细胞毒性试验》测定水凝胶浸提液的细胞存活率。在96 孔板培养NIH3T3 细胞,加入水凝胶浸提液的上清液(质量浓度为10 mg/L 和20 mg/L),并设置阴性空白对照。孔中加入MTT 溶液(质量浓度5 g/L 溶于PBS 中)培养4 h,吸出培养基向孔中加二甲基亚砜(DMSO)溶解甲瓒。最后测定570 nm 处孔中溶液的吸光度,同时设定630 nm 为参比波长。细胞存活率(Y)计算公式为

式中:As和Ab——分别为样品、阴性空白对照组吸光度。
2 结果与讨论
2.1 FT-IR 分析

Fig.4 FT-IR spectra of hydrogels
2.2 SEM 分析
Fig.5 为TA-CM-β-CD/CS/MAH-AM 和CS/MAHAM 水凝胶的SEM 图,TA-CM-β-CD/CS/MAH-AM 水凝胶呈现多孔互联的微观结构,其中Fig.5(c)为TACM-β-CD/CS/MAH-AM 复合水凝胶,Fig.5(d)为CS/MAH-AM 水凝胶。TA-CM-β-CD/CS/MAH-AM 水凝胶与CS/MAH-AM 水凝胶的内部为均一的多孔结构,Fig.5(c)中一整块突起为TA-CM-β-CD,旁边有链段连接说明TA-CM-β-CD 被成功引入水凝胶体系中。与Fig.5(d)相比,Fig.5(c)中水凝胶微孔结构更致密,平均直径明显缩小。
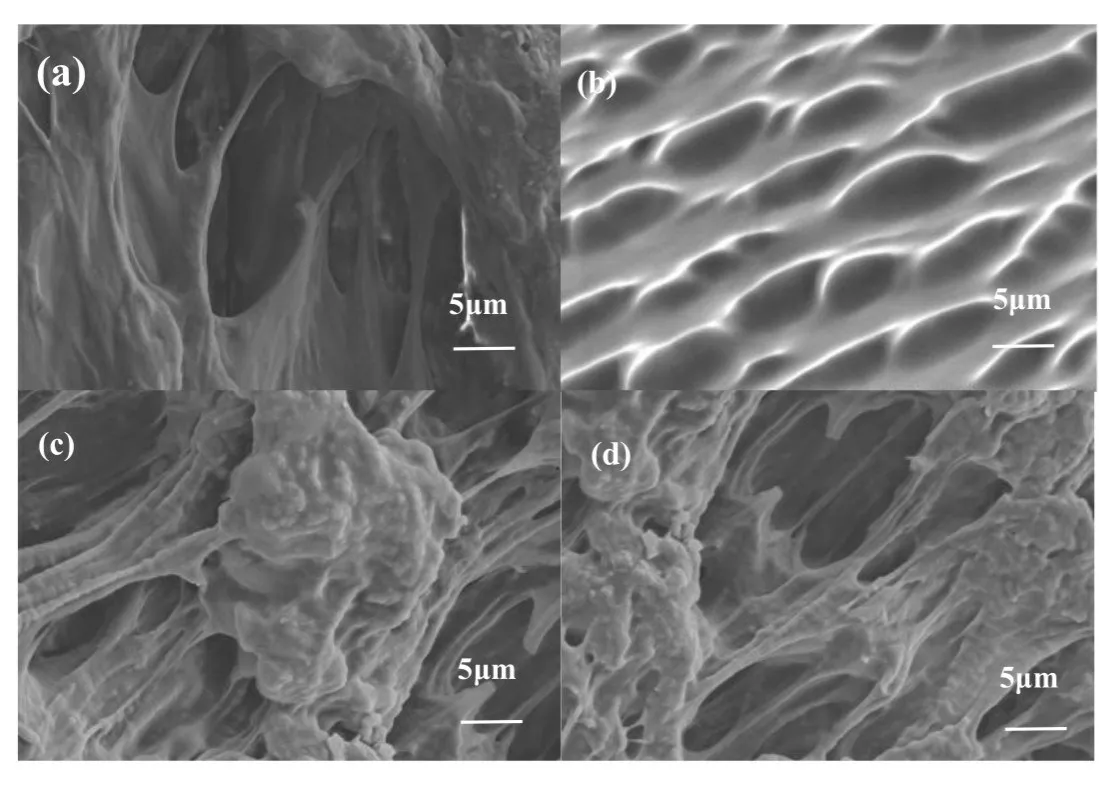
Fig.5 SEM images of hydrogels of (a)PAT0.5C0.5, (b)PAT1C1, (c)PAT1C0.5 and (d)CS/MAH-AM
2.3 溶胀性能
Fig.6 为室温下不同质量分数的TA-CM-β-CD 溶液对TA-CM-β-CD/CS/MAH-AM 水凝胶溶胀性能的影响。Fig.6 可见,水凝胶在达到溶胀平衡前其质量均随浸泡时间的增长而增加。对比PAT0.5C0.5和PAT0.5C1,在TA 含量较低的情况下,随着CM-β-CD含量的增加,PCTC 水凝胶达到溶胀平衡时间缩短且平衡溶胀率增加,这主要是羧甲基的含量起主要作用,形成更大的微观孔洞。当TA 含量增加时,随着CM-β-CD 含量的增加,水凝胶达到溶胀平衡时间变长且平衡溶胀率减少,可能是由于TA 占据主导作用,TA 上的羟基与CM-β-CD、水分子、壳聚糖分子链上的羟基形成较强的氢键相互作用,阻碍了水分子和单宁酸分子进一步向水凝胶网络渗透,导致水凝胶达到溶胀平衡的时间缩短且平衡溶胀率减小。

Fig.6 Swelling rate of hydrogels

Tab.2 Antibacterial properties of hydrogels
2.4 保水性能
TA-CM-β-CD/CS/MAH-AM 复合水凝胶保水性能如Fig.7 所示。由图可知,TA-CM-β-CD/CS/MAHAM 复合水凝胶在15 h 后仍能保留15%左右的水分。对比PAT0.5C0.5和PAT0.5C1可以发现,CM-β-CD 含量的增加会降低复合水凝胶的保水性。当TA 含量增加时,复合水凝胶的保水性增加,可能是由于TA含有大量的羧酸基团,亲水性更强导致复合水凝胶的保水性能增强。综上表明,加入TA-CM-β-CD 对水凝胶的保水率有一定程度的升高或降低,PAT0.5C0.5水凝胶的样品表现出最好的效果,在保水性能方面均优于其它几组样品。

Fig.7 Water retention rate of hydrogels
2.5 抗菌性能
采用大肠杆菌及金黄色葡萄球菌对水凝胶抗菌性能进行研究。与对照样品相比,制备的水凝胶周围形成了明显抑菌圈。从Fig.8 可以看出,水凝胶对两种细菌的都具有很好的抗菌效果,其中,对金黄色葡萄球菌的抑菌圈宽度由0.55 cm 增大到1.75 cm,对大肠杆菌的抑菌圈宽度由0.35 cm 增大到1.5 cm。结果表明,由于单宁酸具有抗生物膜特性而具有一定的抗菌效果,TA 在CMβ-CD 中占比越高,形成的包合结构越多,水凝胶的抗菌效果越好。水凝胶对金黄色葡萄球菌及大肠杆菌均具有明显的抗菌性,且对金黄色葡萄球菌的抗菌性强于大肠杆菌。证明了复合水凝胶对革兰氏阳性(阴性)菌均具有良好的抗菌性能。

Fig.8 Antibacterial effect of hydrogels against E.coli and S.aureus
2.6 黏附性能
CS/MAH-AM 中引入的包合物TA-CM-β-CD 后,由于TA 中含有类贻贝结构中的邻苯二酚基团赋予了其卓越的自粘性能,使得水凝胶可以黏附于各种材料的表面。如Fig.9 所示,TA-CM-β-CD/CS/MAHAM 水凝胶可以牢固地黏附在聚四氟乙烯(PTFE)、聚丙烯(PP)、合金、铁片、玻璃和橡胶表面,而无需使用其他黏合剂。
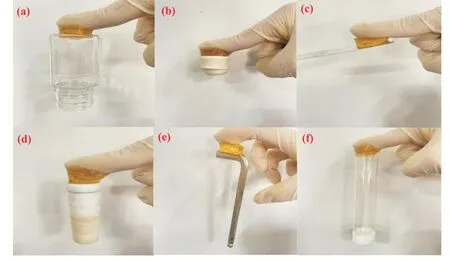
Fig.9 Adhesion of hydrogels on different substrates
通过黏附拉伸测试计算水凝胶的黏附性能,结果如Fig.10。CM-β-CD 含量不变,随TA 在水凝胶中含量的提高,TA-CM-β-CD/CS/MAH-AM 水凝胶的剪切黏附强度从4.85 kPa 增加到5.57 kPa。TA 结构中类儿茶酚的结构及与CS 中含胺基团形成的共价相互作用增强了PCTC 抗菌水凝胶的黏合力。TA含量不变,CM-β-CD 含量的增加,水凝胶的剪切黏附强度没有进一步提高,且降低到4.175 kPa。可能是由于CM-β-CD 基团的增加,接枝到壳聚糖的亚胺键降低了体系中阳离子与阴离子的离子相互作用。不含有TA 与CM-β-CD 的抗菌水凝胶的剪切强度仅有0.6 kPa。这表明CM-β-CD 与TA 的加入可以显著增强抗菌水凝胶的黏附强度。

Fig.10 (a)Stress-displacement curves of hydrogel on pigskin; (b)corresponding adhesive strength of the stressdisplacement curves
2.7 生物相容性
由Fig.11(a)可知,设置蒸馏水的溶血率为100%时,TA-CM-β-CD/CS/MAH-AM 抗菌水凝胶溶血率均在5%以下。随TA-CM-β-CD 包合结构含量的增加,复合水凝胶的溶血率逐渐减小。由Fig.11(b)可知,不同含量TA-CM-β-CD 的水凝胶浸提液中培养,测得细胞存活率均在80%以上。空白对照组的细胞存活率为101.5%±2.1%,随着TA-CM-β-CD 用量的增加,水凝胶的细胞存活率略微减小。含有TA-CM-β-CD 的实验组与不含TA-CM-β-CD 的对照组相比,细胞存活率相差不大。由Fig.11(a)和Fig.11(b)可知,TA 的引入会降低溶血率及细胞存活率。其中PAT1C1溶血率值最低,为0.35%。可以认为,TA-CM-β-CD/CS/MAH-AM 抗菌水凝胶具有较好的血液相容性,可用于作伤口敷料等医用方面。

Fig.11 Hemolysis rate of (a)hydrogel and (b)cell survival rate of hydrogel extraction liquid
3 结论
本文将羧甲基-β-环糊精嵌入单宁酸,形成包合物作为抗菌剂,利用自由基反应将壳聚糖溶解在马来酸酐溶液中,在水溶液中与丙烯酰胺发生原位共聚反应,制备了TA-CM-β-CD/CS/MAH-AM 双网络型超分子抗菌水凝胶。对其进行FT-IR、SEM、溶胀、保水测试、抗菌测试及生物相容性测试,测试结果表明:
(1)TA-CM-β-CD/CS/MAH-AM 抗菌水凝胶溶胀率最高为180%。SEM 图证明该抗菌水凝胶具有均匀孔洞结构。FT-IR 结果表明,TA-CM-β-CD 包合物成功负载在CS/MAH-AM 双网络水凝胶中。
(2)TA 的增加显著增加了水凝胶的保水性能。TA-CM-β-CD/CS/MAH-AM 复合水凝胶在15 h 后仍保留15%左右的水分,该水凝胶具有较好的黏附性,可黏附在多种材料表面,在猪皮上的剪切黏附强度可达到5.575 kPa。
(3)随着单宁酸含量的增加,TA-CM-β-CD/CS/MAH-AM 水凝胶的抗菌活性增加,PAT1C1对大肠杆菌的抑菌圈宽度为1.5 cm,对金黄色葡萄球菌的抑菌圈宽度为1.75 cm,抗菌水凝胶溶血率均在5%以下且水凝胶浸提液中细胞存活率均在80%以上。
TA-CM-β-CD/CS/MAH-AM 水凝胶具有良好抗菌性能及细胞相容性,为其在伤口敷料和生物医疗领域的应用提供了可能。
