固定化芽孢对铽离子的吸附特性
2022-12-04王慧敏宁周神徐鸿涛董伟
王慧敏, 宁周神, 徐鸿涛, 董伟*,2
(1.江西理工大学资源与环境工程学院, 江西 赣州 341000; 2. 江西省矿冶环境污染控制重点实验室, 江西 赣州 341000)
稀土被广泛应用在不同领域,是极为重要的战略材料。 但是由于不当开采方式、开采工艺以及开采流程存在缺陷,造成稀土离子流失,破坏周边的土质及生态水环境系统[1]。 稀土离子对人类、其他动物和植物存在“低促高抑”的Hormesis 现象[2],对于生态环境和人体而言, 稀土元素对其都具有潜在的危害效应[3]。稀土元素的分离回收处理日渐成为人们不可忽视的重大问题。微生物吸附技术由于投资成本低、见效快、对环境友好等特点逐渐被应用于处理水土污染中的稀土元素。 已有许多研究表明枯草芽孢杆菌对17 种稀土元素均具有吸附效果[4-6]。 但是,由于微生物在实际应用过程中存在生物活性低、单位体积内菌体密度低、稳定性差以及环境耐受性低等问题,对环境污染的修复效果仍然不佳。
固定化技术被广泛地应用于固定酶和菌株细胞,在现有的水体污染研究中大部分是用于去除重金属、脱氮、降解有机污染物[7],现在也被应用到稀土处理领域。 PHILIP 等将活性氧化铝、椰子壳、烟煤、玻璃、陶瓷材料、耐火砖、稻壳、硅胶和沙子等与培养基混合作为固定化基质,固定化的铜绿假单胞菌对几乎所有镧系元素的最大金属吸收能力均在1 mmol/g 左右[8]。郑春丽等混合巨大芽孢杆菌和胶质芽孢杆菌,以农作物副产品麦麸、 糠、 废糖蜜、 豆饼粉以及K2HPO4、MgSO4·7H2O 作为固定化载体,对土壤中稀土的吸附率达到61.84%[9]。 但上述固定化方法存在操作较复杂、操作时间较长等问题。 包埋法是一种较为简单的固定化方法,常用海藻酸钠、聚乙烯醇、卡拉胶等作为包埋材料[7,10-11]。 经载体海藻酸钠—硅藻土固定化后,巨大芽孢杆菌对La(Ⅲ)和Ce(Ⅲ)的吸附率分别提高了20.25%、20.02%[12]。 但现有固定化技术多用于细胞,很少见用于芽孢杆菌芽孢的固定化。 芽孢是芽孢杆菌在恶劣生长环境中形成的一种营养细胞的休眠体,对极端环境适应性强。 DONG 等对枯草芽孢杆菌吸附稀土离子的结果表明,其细胞与芽孢均对Tb(Ⅲ)和Dy(Ⅲ)有较高的吸附率,且芽孢的吸附能力明显更强[13-14]。 因此,开展固定化芽孢吸附剂对稀土离子吸附特性的研究,有望拓宽固定化微生物技术的应用范围,对促进水介质中稀土离子的回收或净化具有重要意义。
本文选取海藻酸钠作为固定化包埋剂,包埋了活性炭以及枯草芽孢杆菌PS832。对比固定化芽孢加活性炭、固定化芽孢以及固定化活性炭对稀土离子的吸附效果,探究不同条件对固定化吸附剂吸附稀土离子的影响, 探讨固定化芽孢对稀土离子的吸附特性,对废水中稀土离子的分离回收有重要意义。
1 材料与方法
1.1 主要试剂与仪器
实验所用试剂均为分析纯,主要有:海藻酸钠、粉末活性炭、 氯化钙、 硝酸铽六水化合物、4-(2-羟乙基)-1-哌嗪乙磺酸、2,6-吡啶二羧酸、营养肉汤、硝酸钙、葡萄糖、碘海醇等。
主要实验仪器有:超净工作台(VS-1300u)、超声波 细 胞 粉 碎 机 (JY92-IIN)、 真 空 冷 冻 干 燥 机(SCIENTZ-10N)、相差显微镜(NCY-E200)、场发射扫描电子显微镜(MLA650F)、透射电子显微镜(G2-20)、多功能酶标仪(SuPerMax300)等。
1.2 固定化吸附剂的制备方法
供试菌株枯草芽孢杆菌PS832 由美国微生物科学院院士Peter Setlow(UConn Health)提供[15],由本实验室保藏。
1.2.1 枯草芽孢杆菌芽孢的培养与收集
将活化后的枯草芽孢杆菌PS832 单菌落接入Luria-Bertani (LB)液体培养基中,在37 ℃、250 r/min条件下培养5~8 h 后, 将菌液涂布于2×Schaeffer’sglucose (2×SG)固体培养基,于37 ℃下培养3~5 d,得到平板表面菌体。冰浴中收集平板表面菌体于盛有无菌水的离心管中,然后于4 ℃下离心并去除上清与杂质后,加入无菌水重新悬浮,得到芽孢粗悬液。
将芽孢粗悬液冰浴下超声振荡后在4 ℃下离心,去除上清与杂质,然后加入20%(w/v)的碘海醇溶液悬浮菌体,振荡后再转入50%(w/v)的碘海醇溶液,继续振荡后在4 ℃条件下离心收集沉淀,无菌水反复洗涤多次, 通过相差显微镜确认95%以上为亮色菌体后(图1),即得到实验所需芽孢,放入4 ℃冰箱保存备用[16]。

图1 相差显微镜下的芽孢Fig. 1 Spores under phase-contrast microscope
1.2.2 固定化吸附剂的制备
将枯草芽孢杆菌PS832 芽孢稀释成OD600(菌液在600 nm 波长处的吸光值)=1.0、2.0、3.0、4.0、6.0、8.0 的芽孢悬液,取10 mL 按包炭量1∶30、1∶40、1∶50、1∶60、1∶100、1∶200 (活性炭质量∶溶液总质量)的比例, 分别加入0.6、0.5、0.4、0.3、0.2、0.1 g 活性炭粉末充分混匀,得到包炭后的芽孢悬液;将0.4 g海藻酸钠加热溶于10 mL 无菌生理盐水,得到浓度为0.04 g/mL 的海藻酸钠溶液, 室温下自然冷却至40 ℃左右。
将上述包炭后的芽孢悬液与海藻酸钠溶液混合均匀, 用无菌玻璃注射器缓慢滴加至冰浴中的4%(w/v)的无菌CaCl2溶液中。将形成的凝胶颗粒于室温下放置1 h 后,用无菌生理盐水冲洗2 次,再浸没于4%质量百分含量的无菌CaCl2溶液中于4 ℃下交联24 h,得到固定化芽孢加活性炭[17]。在上述过程中不加入活性炭粉末即得到固定化芽孢,若不加入芽孢悬液即得到固定化活性炭。
1.3 铽离子浓度的测定
Tb(Ⅲ)能与过量的2,6-吡啶二羧酸(DPA)结合形成配合物,在特定波长下有荧光强度且与稀土离子浓度在一定范围内呈显著线性关系[14]。取90 μL 待测液于96 孔酶标板中, 加入100 mmol/L HEPES 缓冲液100 μL、10 mmol/L DPA 溶液10 μL,在激发波长275 nm、发射波长545 nm 下测其荧光强度。 根据标准曲线计算出待测液中稀土离子浓度。按上述测定方法检测Tb(Ⅲ)荧光强度,得到标准曲线(图2)。

图2 铽离子浓度与荧光强度标准曲线Fig. 2 Standard curve of terbium ion concentration and fluorescence
1.4 吸附实验
50 mL 锥形瓶中添加1 mL 含有一定Tb(Ⅲ)浓度的溶液、2.5 mL HEPES 缓冲液、6.5 mL 无菌水,加入2.5 g 固定化吸附剂。吸附一定时间后取上清液按1.3 所述方法测稀土离子浓度,每个样设置3 个平行试验。
1.5 固定化吸附剂的显微镜观察
1)固定化吸附剂在相差显微镜下观察。将制好的固定化芽孢加活性炭、 固定化芽孢冷冻干燥后研磨,过200 目(0.074 mm)筛,取粉末制片,在相差显微镜下观察。
2)固定化吸附剂吸附Tb(Ⅲ)前后扫描电镜观察。 将吸附Tb(Ⅲ)前后的固定化芽孢加活性炭,在冷冻干燥后研磨成粉末并过0.074 mm 筛,取少量粉末粘于导电胶上,喷金后通过场发射扫描电子显微镜观察。
3)固定化吸附剂吸附Tb(Ⅲ)前后透射电镜观察。 将吸附Tb(Ⅲ)前后的固定化芽孢加活性炭,在冷冻干燥后研磨成粉末并过0.074 mm 筛, 加少量无菌水超声分散后滴在铜网上,烘干后在透射显微镜下观察。
2 结果与讨论
2.1 吸附条件变化对固定化吸附剂吸附稀土离子效果的影响
2.1.1 包炭量对吸附效果的影响
当芽孢浓度为OD600=2.0 时,在Tb(Ⅲ)初始浓度为100 μmol/L、pH=7.4、 室温的条件下吸附60 min,测定固定化吸附剂吸附后上清液Tb(Ⅲ)浓度并计算其去除率,结果如图3 所示。
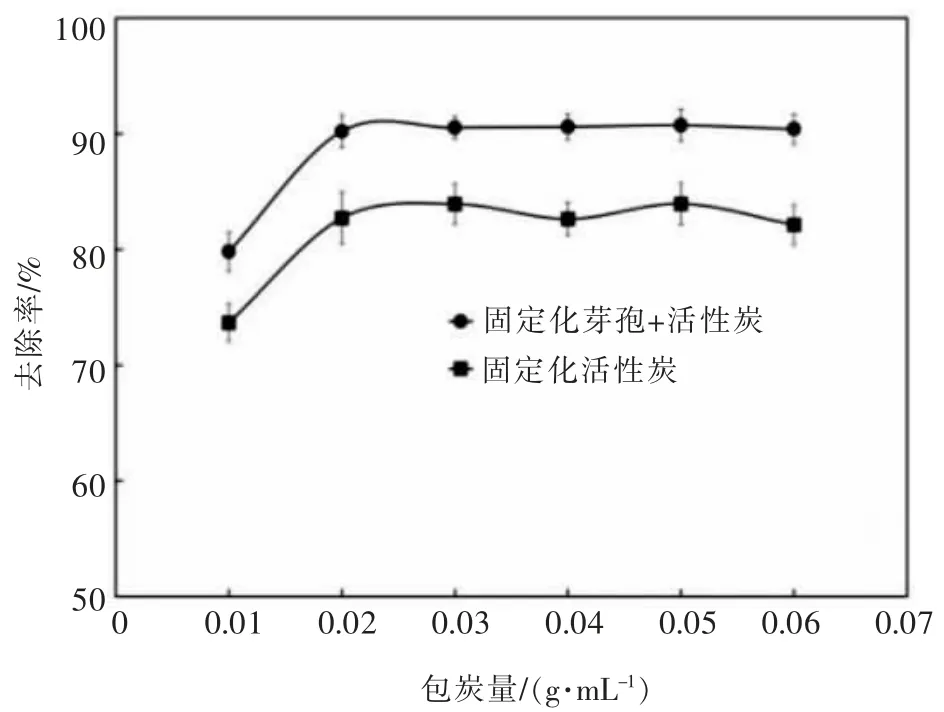
图3 包炭量对吸附效果的影响Fig. 3 Effects of carbon content onadsorption capacity
固定化芽孢加活性炭对Tb(Ⅲ)的吸附效果比固定化活性炭好,对Tb(Ⅲ)的去除率高5%~8%。 当活性炭质量为0.1 g,即包炭量为1∶200 时,固定化芽孢加活性炭、固定化活性炭对Tb(Ⅲ)的去除率分别为79.81%、73.67%。 当活性炭质量为0.2 g,即包炭量为1∶100 时,两种固定化吸附剂的吸附效果较优,其中固定化芽孢加活性炭对Tb(Ⅲ)的去除率为90.22%,固定化活性炭对Tb(Ⅲ)的去除率为82.71%。 再增加活性炭质量,吸附效果变化不大,两种固定化吸附剂对Tb(Ⅲ)的去除率分别稳定在90%、83%左右。故后续实验皆采用包炭量为1∶100 进行。
2.1.2 芽孢浓度对吸附效果的影响
当包炭量为1∶100 时, 在Tb(Ⅲ)初始浓度为100 μmol/L、pH=7.4、 室温的条件下吸附60 min,测定固定化吸附剂吸附后上清液Tb(Ⅲ)浓度并计算其去除率,结果如图4 所示。
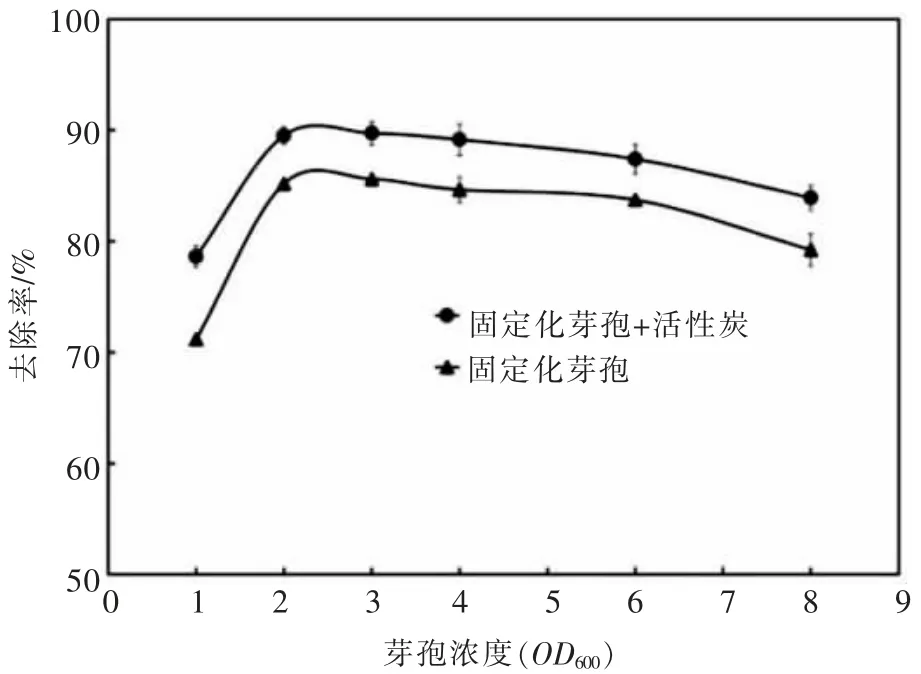
图4 芽孢浓度对吸附效果的影响Fig. 4 Effects of spore concentration onadsorption capacity
芽孢浓度对固定化吸附剂吸附稀土离子的影响较大。 当OD600=1.0 时,固定化芽孢加活性炭、固定化芽孢对Tb(Ⅲ)的去除率分别为78.63%、71.19%;当OD600增加到2.0 时,两种固定化吸附剂对Tb(Ⅲ)的去除率显著增大,此时固定化芽孢加活性炭、固定化芽孢对Tb(Ⅲ)的去除率均达到最高点,分别为89.51%、85.18%;当芽孢液的OD600从3.0 增加到8.0时,两种固定化吸附剂对Tb(Ⅲ)的去除率略有下降。由此可知,芽孢浓度的增加在提供更多吸附位点的同时也增加了各个吸附位点间的竞争作用,造成单位吸附剂对稀土离子吸附量的减少[18]。为了经济有效地运用固定化吸附剂, 在后续实验中芽孢浓度都控制在OD600=2.0。
2.1.3 稀土离子初始浓度对吸附效果的影响
在包炭量为1∶100、 芽孢浓度为OD600=2.0、pH=7.4、 室温的条件下吸附60 min, 测定吸附后上清液Tb(Ⅲ)浓度并计算其去除率,结果如图5 所示。
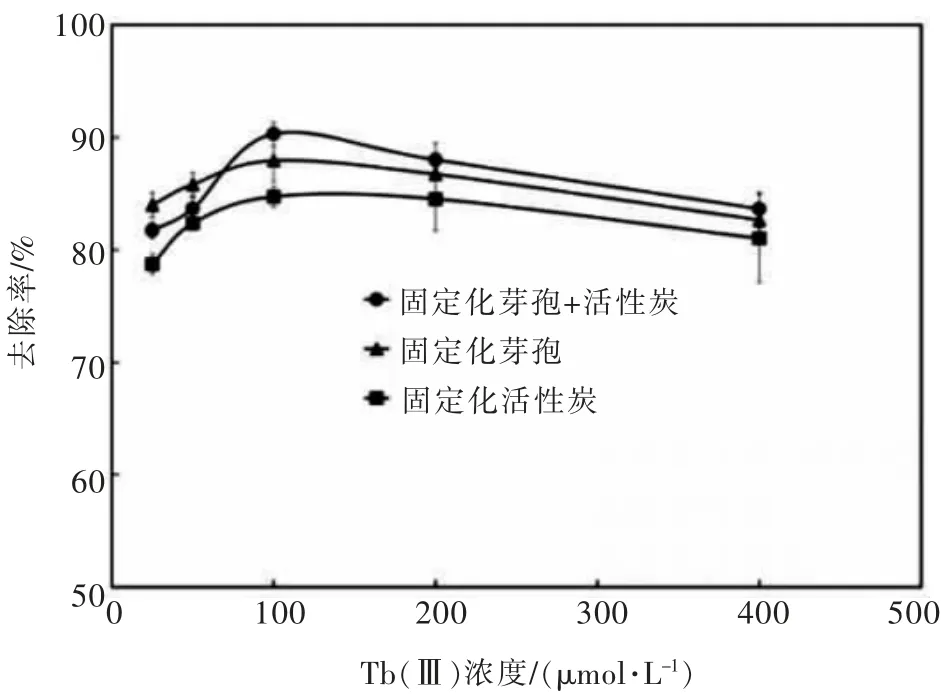
图5 Tb(Ⅲ)初始浓度对吸附效果的影响Fig. 5 Influence of initial concentration of Tb(Ⅲ)on adsorption capacity
当稀土离子浓度在25~100 μmol/L 时,固定化吸附剂对Tb(Ⅲ)的去除率不断提高。 随着Tb(Ⅲ)初始浓度的增加,稀土离子的扩散速率增加,且稀土离子与吸附剂间静电引力也在增加[19],提高了固定化吸附剂上吸附位点的利用率。 而当溶液中Tb(Ⅲ)浓度超过100 μmol/L, 去除率随着稀土离子浓度的增加呈下降趋势。这可能是因为固定化吸附剂上的总吸附位点有限,故所能吸附的稀土离子总量有限,随着稀土离子浓度的增加,吸附位点被充分利用,吸附达到饱和, 没有足够的有效吸附位点与剩余稀土离子结合,去除率呈不断降低的趋势[20]。 另一方面,随着稀土离子浓度的增加,对枯草芽孢杆菌芽孢造成的毒性也增大,使得芽孢的生物活性降低,从而导致去除率的下降[21]。
2.1.4 吸附时间对吸附效果的影响
将固定化芽孢加活性炭、固定化芽孢、固定化活性炭3 种吸附剂在包炭量为1:100、 芽孢浓度为OD600=2.0、Tb(Ⅲ)初始浓度为100 μmol/L、pH=7.4、室温的条件下吸附5~120 min, 测定吸附后上清液Tb(Ⅲ)浓度并计算其去除率,结果如图6 所示。

图6 吸附时间对吸附效果的影响Fig. 6 Influence of time on adsorption capacity
研究表明菌株对稀土离子的吸附可分为快速吸附和基本平衡的2 个过程[22]。 在快速吸附阶段,随着吸附时间的增加,3 种固定化吸附剂对Tb(Ⅲ)的吸附效果不断增强。固定化活性炭比其他两种吸附剂更早达到吸附平衡, 固定化活性炭在30 min 已达到吸附拐点, 固定化芽孢加活性炭和固定化芽孢分别在60、75 min 时达到吸附平衡。 到达拐点后继续延长吸附时间至120 min,吸附效果变化不大,此时固定化吸附剂中的吸附位点已被充分利用,这表明三种固定化吸附剂对Tb(Ⅲ)的吸附过程均为快速吸附。
2.1.5 吸附pH 对吸附效果的影响
在50 mL 锥形瓶中添加100 μmol/L 的Tb(Ⅲ)溶液1、6.5 mL 无菌水,并分别加入pH=4.5 的醋酸—醋酸钠缓冲溶液、pH=5.5 及pH=6.5 的吗啉乙磺酸缓冲溶液、pH=7.5 及pH=8.5 的HEPES 缓冲溶液各2.5 mL,加入OD600=2.0、包炭量为1∶100 的固定化吸附剂2.5 g,吸附60 min 后取上清液测Tb(Ⅲ)浓度,计算其去除率,结果如图7 所示。

图7 吸附pH 值对吸附效果的影响Fig. 7 Influence of pH on adsorption capacity
pH 对固定化芽孢的影响较大, 对固定化活性炭的影响次之,对固定化芽孢加活性炭的影响最小。 其中,随着溶液pH 值的增加,固定化芽孢对Tb(Ⅲ)的吸附效果总体呈先上升后下降的趋势;固定化芽孢加活性炭与固定化活性炭的去除率均先上升后平衡。
溶液pH 值从4.5 上升至6.5 时, 固定化吸附剂对Tb(Ⅲ)的去除率不断增加,很可能因为随着pH值的升高, 吸附剂表面的官能团如磷酸基团去质子化,而稀土离子仍以带正电的形式存在,从而使固定化吸附剂与稀土离子的静电相互作用和络合作用增强,对Tb(Ⅲ)的去除率增加[23-24]。对生物吸附剂而言,过高或者过低的pH 会影响生物活性,都不利于其吸附稀土离子, 因此当pH 值在酸性条件下不断升高时,微生物内的大多数酶活性增加,对稀土离子的载体协助运输等作用机制开始起重要的作用,对稀土离子的吸附作用也越强[25]。当溶液pH 值在6.5~8.0 之间,总体上3 种固定化吸附剂的去除率变化不大,均处于较高水平;在pH=7.5 时,固定化芽孢加活性炭、固定化芽孢、固定化活性炭对Tb(Ⅲ)的去除率较高,分别为91.43%、88.35%、85.33%。 说明这3 种固定化吸附剂更适合在中性或碱性环境中吸附Tb(Ⅲ)。
固定化芽孢加活性炭对Tb(Ⅲ)的吸附效果波动不大,总体在90%上下浮动,这是因为芽孢与固定化载体结合使得吸附剂内部结构更加稳定,降低了外部溶液对其结构的影响。含稀土浓度较高的稀土废水通常是偏酸性的,因此需要找到可以在较低pH 下起作用的生物吸附剂[26-27],而固定化芽孢加活性炭具有更广泛的pH 适用范围,实际应用性更好。
2.1.6 温度对吸附效果的影响
温度通过影响微生物的生理代谢活动和吸附热容等影响吸附效果,对于不同种类吸附剂而言,温度对它们的吸附影响也不尽相同[28]。在包炭量为1:100、芽孢浓度为OD600=2.0、Tb(Ⅲ)初始浓度为100 μmol/L、pH=7.5 条件下, 分别于5、15、25、35 ℃环境中吸附60 min,测定吸附后上清液Tb(Ⅲ)浓度并计算其去除率,结果如图8 所示。

图8 温度对吸附效果的影响Fig. 8 Influence of temperature on adsorption capacity
随着温度的上升,固定化芽孢加活性炭、固定化芽孢对Tb(Ⅲ)的去除率呈先上升后下降的趋势,可能因为芽孢在室温下保持较高的活性, 在25 ℃时达到最高值,分别为91.33%、85.00%。 而固定化活性炭对Tb(Ⅲ)的去除率则呈不断下降的趋势,在5 ℃时去除率最高,为86.20%。这是因为活性炭的吸附作用是一个放热过程,而解吸是吸热过程,温度的升高抑制了活性炭的吸附作用,同时促进了解吸作用[29]。
2.2 吸附动力学与吸附等温线
2.2.1 吸附动力学
由上述吸附条件变化对固定化吸附剂吸附Tb(Ⅲ)效果的影响结果可知,在包炭量为1∶100、芽孢浓度为OD600=2、Tb(Ⅲ)初始浓度为100 μmol/L、pH=7.5、25 ℃的条件下,固定化芽孢加活性炭对Tb(Ⅲ)的吸附效果较好。使用固定化芽孢加活性炭在此条件下吸附Tb(Ⅲ),测定0~120 min 内不同时间段的上清液Tb(Ⅲ)浓度,计算其吸附量qe(nmol/mg)。 通过3 种常见吸附动力学拟合其结果,准一级动力学模型如式(1)、准二级动力学模型如式(2)、Elovich 动力学如式(3):

式(1)—式(3)中:qe和qt分别是平衡时和时间t时的吸附量,nmol/mg;K1为准一级吸附速率常数;K2为准二级吸附速率常数;α 为初始吸附速率;β 为解吸常数。
图9 所示为固定化芽孢加活性炭对Tb(Ⅲ)的吸附动力学拟合曲线。 3 个动力学拟合的R2值分别为0.999、0.998 及0.994(表1),说明固定化芽孢加活性炭对Tb(Ⅲ)的吸附是受扩散步骤、化学吸附等一系列反应机制控制的[30]。 吸附更吻合准一级动力学,得到拟合模型qt=32.8951-e-0.039t(nmol/mg)。

图9 吸附动力学曲线Fig. 9 Adsorption kinetic curves
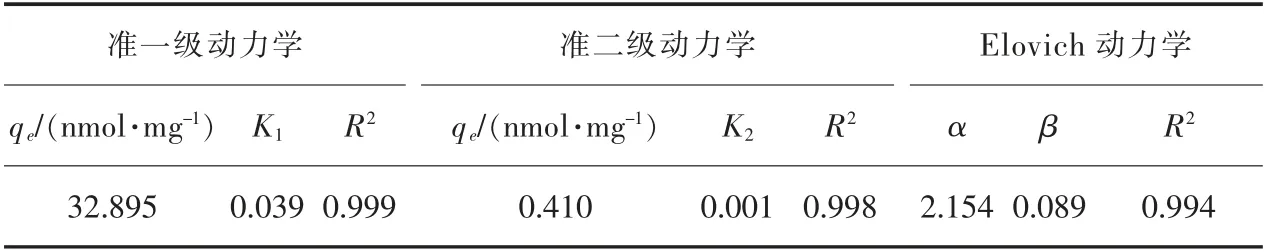
表1 固定化芽孢加活性炭的吸附动力学模型拟合参数Table 1 Adsorption kinetic model parameters of immobilized spores plus activated carbon
2.2.2 吸附等温线
将固定化芽孢加活性炭在25 ℃下分别用于吸附不同浓度的Tb(Ⅲ)溶液各60 min。 测定在0~100 μmol/L浓度下吸附达到平衡时的上清液Tb(Ⅲ)浓度,计算其吸附量qe(nmol/mg)。 通过两种常见吸附等温线拟合其结果,Langmuir 模型如式 (4)、Freundlich 模型如式(5):

式(4)、式(5)中:qe是平衡时的吸附量,nmol/mg;Ce为吸附平衡时Tb(Ⅲ)溶液的浓度,nmol/L;qmax为单层最大吸附量,nmol/mg;KL为Langmuir 吸附相关常数,KF、n为Freundlich 吸附相关常数。qe=(nmol/mg),单分子层最大吸附量qmax为151.111 nmol/mg。 观察Freundlich 等温吸附模型的参数1/n在0~1 之间,表示固定化芽孢加活性炭对Tb(Ⅲ)的吸附较为容易[31]。 说明固定化芽孢加活性炭对Tb (Ⅲ) 的吸附应该是一种可逆的吸附过程,在吸附剂表面有均匀的吸附位点[17,32]。 此外,还拟合了固定化海藻酸钠(既无芽孢也无活性炭)、固定化芽孢、 固定化活性炭的吸附等温线, 均更符合Langmuir 吸附等温线模型, 拟合的单分子层最大吸附量分别为84.415、104.760、145.452 nmol/mg。 可见固定化芽孢加活性炭的吸附容量更大。

图10 吸附等温线Fig. 10 Adsorption isotherm models

Langmuir 等温吸附模型 Freundlich 等温吸附模型qmax/(nmol·mg-1) KL 1/n KF R2 151.111 2.479×10-6 0.563 0.048 0.955 R2 0.989
2.3 固定化吸附剂的表征
2.3.1 固定化吸附剂的表面形貌
不同条件的固定化吸附剂外观形貌如图11 所示。 按1.2 所述制备的固定化吸附剂呈颗粒分明的球形结构,外观圆润饱满、大小均匀,其平均粒径为3 mm,添加了活性炭的固定化吸附剂为黑色,未添加活性炭的固定化芽孢为米白色。

图11 固定化吸附剂外观Fig. 11 Appearance of immobilized adsorbents
2.3.2 相差显微镜观察
相差显微镜下的固定化吸附剂如图12 所示。 添加了固定化芽孢加活性炭在相差显微镜下的每块碎片都有明显的亮斑,而固定化活性炭则表现为大小均匀的灰黑块状结构, 说明芽孢的固定化效果较好,与海藻酸钠、活性炭均匀地混合在一起。

图12 相差显微镜下的固定化吸附剂Fig. 12 Immobilized adsorbents under phase-contrast microscope
2.3.3 吸附前后扫描电镜观察
固定化吸附剂的扫描电镜图如图13 所示,可以看到固定化芽孢加活性炭具有多孔结构,有明显的芽孢被固定在载体中。 吸附Tb(Ⅲ)前,固定化芽孢加活性炭表面比较平滑,吸附Tb(Ⅲ)后其表面粗糙[22],有许多零散明亮的附着物,表明固定化芽孢加活性炭的吸附效果较好,且多为表面吸附[14]。

图13 扫描电镜下的固定化芽孢加活性炭Fig. 13 Immobilized spores plus activated carbon under scanning electron microscope
2.3.4 吸附前后透射电镜观察
固定化吸附剂的透射电镜图如图14 所示。 固定化芽孢在透射电镜下可看到单个芽孢(图14(a)),这是因为样品经研磨、超声分散处理,使原本固定在载体上的芽孢脱落,变成游离的芽孢。而固定化芽孢加活性炭在经相同处理后则未观察到单个的芽孢 (图14(b)、图14(c)),说明就固定效果而言,添加了活性炭的固定化芽孢加活性炭明显优于固定化芽孢。
对比固定化芽孢加活性炭吸附Tb (Ⅲ)前(图14(b))、后(图14(c)),吸附后的固定化芽孢加活性炭交联更加紧密,而且颜色更深,这是因为吸附后其表面有大量的Tb(Ⅲ)附着,使吸附剂表面厚度加深,说明固定化芽孢加活性炭对Tb(Ⅲ)的吸附效果较好。

图14 透射电镜下的固定化吸附剂Fig. 14 Immobilized adsorbents under transmission electron microscope
3 结 论
本研究对比了不同吸附条件下,固定化芽孢加活性炭、固定化芽孢、固定化活性炭对Tb(Ⅲ)的吸附效果,拟合了固定化芽孢加活性炭吸附Tb(Ⅲ)的动力学与等温线,并对吸附Tb(Ⅲ)前后的固定化吸附剂进行了电镜观察,得到以下结论:
1) 固定化芽孢加活性炭兼具包埋法和吸附法的优点,对Tb(Ⅲ)的去除率达到90%以上,最大吸附量为151.111 nmol/mg。 固定化芽孢与固定化活性炭吸附能力相当,对Tb(Ⅲ)的去除率约为85%,最大吸附量分别为104.760、145.452 nmol/mg。
2)与其他两种固定化吸附剂相比,固定化芽孢加活性炭的适用范围更广,实际应用性更强。 当包炭量为1∶100 (活性炭质量∶总溶液质量), 芽孢浓度的OD600=2.0 时,在Tb(Ⅲ)初始浓度为100 μmol/L、中性或碱性环境、 温度为15~25 ℃的条件下吸附60 min,其吸附效果较好。
3)固定化芽孢加活性炭呈颗粒分明的球形结构,具有多孔结构,固定效果良好。 其对Tb(Ⅲ)的吸附符合准一级动力学、Langmuir 吸附等温线模型,吸附速度快,受扩散步骤、化学吸附等一系列反应机制控制,是一种可逆的化学吸附过程,在吸附剂表面有均匀的吸附位点。
