制备方法对新型纳米TiO2 抑菌片抑菌活性的影响
2022-12-04龙威陈志龙刘穗汕
龙威, 陈志龙, 刘穗汕
(广东石油化工学院化学学院,广东 茂名 525000)
随着经济的高速发展,地球环境不断遭受污染及破坏,人类生存的环境质量日益变差,其中细菌、病毒等的传播对人类健康产生巨大的威胁[1]。 生存在人体周围的细菌、病毒等微观物质,通过与食物、空气等与人接触,可能传播疾病或加重病情,引发了广大科技者的关注[2]。
抑菌环保科技材料的诞生,能有效地抑制细菌,延长食品的保鲜时间, 在食品行业已得到了充分的肯定[3]。与此同时,医药行业也需要大量的抑菌材料,这不仅体现在治疗病人的手术过程中, 医院环境的治理和医务人员的防护等均离不开抑菌材料。 为了更好地促进环境的清洁卫生, 抑菌材料也广泛地运用于公共设备及百姓家庭中,如高铁、飞机、汽车等交通工具的坐垫、家庭使用的餐桌布、日用口罩、内衣物、床上用品等。 维护清洁、健康、安全的环境离不开抑菌材料[4]。
抑菌材料大致可分为3 类:天然抑菌材料[5]、有机抑菌材料[6]和无机抑菌材料[7]。 天然抑菌材料来源少,加工环节复杂,重复利用率低[8];有机抑菌材料一般为酚类或有机酸类物质,可破坏细菌中蛋白质和细胞膜的合成, 从而抑制病原微生物的生长繁殖,但长期与皮肤接触毒性大,易造成二次污染[9];无机抑菌材料合成容易,抑菌持久,对人体的毒性低,也容易清除和再生[10]。 3 种抑菌材料均为研究热点,如何方便快捷地制备抑菌效果好、成本低廉、制备工艺简单的高效抑菌材料,是未来科技领域的热门研究方向。
TiO2具有独特的性质, 在光照的辐射作用下,其氧化性受到激发而增强,对细菌产生特殊的杀菌活性。 同时,TiO2具有安全无毒、无污染、使用寿命长等优点,被广泛应用于多种抑菌材料[11]。 微观上,TiO2接受光辐射后产生大量的自由基,与细菌的细胞介质发生氧化反应后生成强氧化性基团,该基团与细胞中的有机物再次反应,最终杀灭细菌。 一方面,氧化性物质可使蛋白质中的肽键断裂和脂类中的糖分解,直接降低蛋白质活性;另一方面,强氧化性自由基(·OH,—COO·等)先穿过细胞壁,与细胞内膜或细胞内的物质反应, 导致成膜物质无法运输,菌体与外界无法进行物质交换,形成菌体空化,最终杀灭细菌[12-13]。
目前,TiO2已广泛地应用于美容护肤[14]、药物治疗[15]、环境治理与光催化[16]等领域,但TiO2自身的制备方法及内部结构有较大差异, 如TiO2的晶型有锐钛矿、板钛矿和金红石矿3 类[17],其自身的氧化能力与制备方法有关。有关抑菌活性与自身的内部结构的相关性研究,目前尚未见报道。考虑到TiO2的制备成本并不低, 本研究选择了含一定质量的TiO2抑菌片进行实验, 对比分析不同制备方法得到的TiO2内部结构与抑菌活性之间的关系,选择了大肠杆菌、金黄色葡萄球菌为研究对象,利用抑菌圈观察法[18]、最小抑菌浓度测定法(Minimum Bactericidal Concentration,MIC)[19],最低灭菌浓度测定法 (Minimum Bactericidal Concentration,MBC)[20]进行综合评价。
1 实 验
1.1 材料与仪器
主要药品有:无水乙醇、钛酸四丁酯、冰醋酸、聚乙二醇(PEG),尿素购于天津市大茂化学试剂厂,分析纯;马铃薯淀粉、氯化钠、琼脂、牛肉膏、蛋白胨购于上海麦克林生化有限公司,纯度为99%;大肠杆菌斜面二代(型号为ATCC25922)、金黄色葡萄球菌斜面二代(型号为ATCC65438)购于北京生物保藏中心;去离子水为自制。
主要仪器有:智能马弗炉(XL-1A 型),杭州卓驰仪器有限公司;恒温鼓风干燥箱(DHG-9030A 型),上海一恒科学仪器有限公司; 恒温加热搅拌器(85-2A 型), 金坛市亿能实验仪器厂; 恒温细菌培养箱(DGH 型),泸鸿仪器设备有限公司;高温高压灭菌锅(JX-18B 型),上海金鑫医疗器械有限公司;可见光分光光度计(721 型),大地自动化仪器有限公司;手动药片压片机,直径10 mm,东莞市日顺兴金属制品有限公司。
1.2 抑菌片的制备
样品1:利用溶胶—凝胶法[21],取适量的无水乙醇、冰醋酸和去离子水,混合均匀,磁力搅拌下向溶液中缓慢滴加适量的钛酸四丁酯,混合均匀后,将溶液放置过夜,烘干,冷却,将粉末用无水乙醇和去离子水洗涤数次,直至洗涤液体的pH=7,再放置在鼓风干燥箱中保持110 ℃干燥约12 h, 冷却后再将粉末转移至坩埚中, 放入马弗炉中300 ℃焙烧2 h, 研磨后即得纯净的TiO2粉末。
样品2:利用水热合成法[22],取适量的无水乙醇和冰醋酸,混合均匀,磁力搅拌下向溶液中缓慢滴加钛酸四丁酯,混合均匀,磁力搅拌2 h,将溶液转移至聚四氟乙烯内衬中,再放置在鼓风干燥箱中110 ℃连续加热15 h,冷却,抽滤,用去离子水及无水乙醇分别洗涤数次,直至洗涤液体pH=7,保持110 ℃烘干约12 h,冷却研磨得TiO2粉末。
样品3:利用溶剂热法[23],取适量的无水乙醇和去离子水, 混合均匀后, 再向溶液中加入PEG,待PEG 完全溶解后, 磁力搅拌下向溶液中缓慢滴加钛酸四丁酯,混合均匀,将溶液放置电炉上,缓慢烘干,冷却,用去离子水及无水乙醇分别洗涤数次,再放置在鼓风干燥箱中保持110 ℃烘干约12 h 后, 再将粉末转移至坩埚中, 放入马弗炉中300 ℃焙烧2 h,冷却研磨即得TiO2粉末。
样品4:利用改进后的水热合成法[24],避免过多酸的影响,取适量的无水乙醇和冰醋酸,混合均匀,再向溶液中加入PEG 及尿素,待PEG 及尿素完全溶解后,磁力搅拌下向溶液中缓慢滴加钛酸四丁酯,混合均匀,磁力搅拌2 h 后将溶液转移至聚四氟乙烯内衬中,放置在鼓风干燥箱中保持110 ℃连续加热15 h,冷却,抽滤,用去离子水及无水乙醇分别洗涤数次,直至洗涤液体pH=7, 再放置在鼓风干燥箱中保持110 ℃烘干约12 h 后冷却,转入马弗炉中保持300 ℃焙烧2 h,冷却研磨即得TiO2粉末。
上述得到的4 种TiO2粉末均按一定的质量分数与马铃薯淀粉均匀混合后,放入手动压片机进行压片,抑菌片质量控制在0.2 g,直径大小为1 cm,并分别以样品1、样品2、样品3、样品4 命名。
1.3 表征方法
BET 在贝士德仪器科技有限公司生产的3h-2000PS1 型比表面积分析仪上进行, 采用N2吸附脱附方式测定孔径孔容数据;XRD 在日本理学株式会社生产的Ultima 型X 射线衍射仪上进行,CuKα 射线,石墨单色器,管电压40 kV, 管电流30 mA,闪烁计数器记录衍射强度;IR 表征在美国热电公司生产的Thermo Scientific 型红外光谱分析仪上进行,采用KBr 压片制样,进样前将样品在自带的真空干燥箱中50 ℃干燥5 h,避免样品吸水产生干扰;SEM 利用日本电子JEQL 公司生产的JSM-6510 LV 型扫描电镜仪进行拍摄,钨丝灯作为光源。
1.4 抑菌测试法
配制固体培养基:准确称量5.0 g 蛋白胨,15.0 g琼脂粉,3.0 g 牛肉浸膏和5.0 g 氯化钠, 溶解在1 000 mL去离子水中,不断搅拌加热溶解。 煮沸5~10 min,待琼脂完全溶解,调节pH 值为7.0~7.2。然后分装到试管或锥形瓶内,试管装到1/3 处,在蒸汽消毒器内120 ℃高温灭菌20 min,冷却后放置在冰箱内冷藏备用。 已活化的菌种接种至已灭菌的无菌液体培养基中,放入培养箱中37 °C 培养18 h 后,取4 mL 菌液至比色皿中,用可见光分光光度计测量菌液在625 nm 处的浊度,通过比浊管中特定浓度菌液在可见光分光光度所测定的标准浓度曲线得到菌液的浓度。
抑菌圈测试: 将淀粉与TiO2以一定质量比混合制作成抑菌片,再将抑菌片紧密黏贴在培养基(已灭菌好)中央,放置于配有功率为3 W 的LED 光照下的细菌培养箱中连续培养,特定时间后取出,立即测量培养基上出现的抑菌环直径的大小, 通过对比不同的抑菌材料抑菌圈的大小及观察抑菌圈直径随时间的变化趋势, 可以初步得到不同抑菌材料抑菌性能的区别。
MIC 测试:利用牛肉膏、蛋白胨与去离子水配制稀溶液,再添加适量TiO2粉末,磁力搅拌形成均匀的抑菌悬浮液,再将其加入实验用菌液中,放入自带有功率为3 W 的LED 光照细菌培养箱中37 °C 进行连续培养,每隔2 h 将菌液取出摇匀后,测定625 nm 处的吸光度,得到多组数据并拟合成曲线,可以判断菌落的生长情况,曲线中吸光度不随时间变化的最低抑菌材料浓度,即为最小抑菌浓度MIC。
MBC 测试:根据MIC 的测试结果,选取配制好的菌液进行涂板,观察菌落生长情况,用生理盐水稀释菌液至浓度为10~6 倍,取0.1 mL 稀释后的菌液滴加至培养基中,涂布均匀,放入自带有功率为3 W 的LED 光照的细菌培养箱中培养, 对比不同抑菌材料浓度下的菌液的生长状况, 测得杀灭细菌的最低浓度,即为最低灭菌浓度MBC。
2 结果与讨论
2.1 抑菌圈测试结果
采用4 种纳米TiO2制备的抑菌片分别对大肠杆菌及金黄色葡萄球菌的抑菌性能进行测试,当不同方法制备的纳米TiO2的质量分数分别为10%、20%、30%时,对大肠杆菌的抑菌结果如图1 所示(培育12 h时)。 测试结果表明: 用方法2 及方法4 制备的纳米TiO2对大肠杆菌具有良好的抑菌效果, 用方法1 及方法3 制备的样品对大肠杆菌的抑菌效果欠佳。
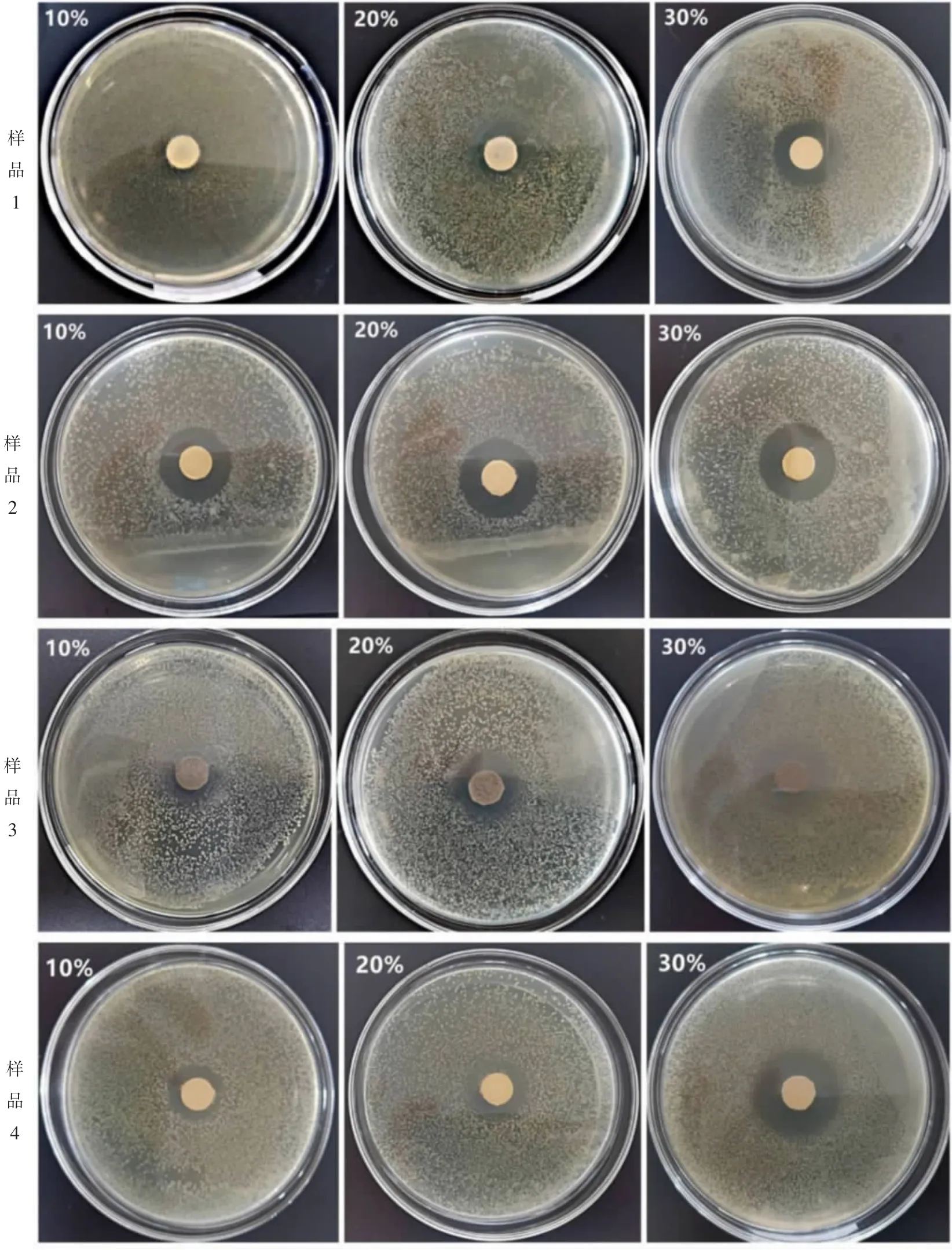
图1 不同质量分数的TiO2(4 种样品)对大肠杆菌的抑菌效果(培养12 h)Fig. 1 Antibacterial effect of different mass fractions of TiO2(four samples)on Escherichia coli (cultured for 12 h)
4 种纳米TiO2对大肠杆菌的抑菌效果均随纳米TiO2含量的增加而提高,其中,样品2 和样品4 对大肠杆菌有明显的抑菌效果,样品2 的抑菌效果比样品4更好,抑菌环清晰明显,且抑菌圈直径随时间延长而减小。 TiO2含量为10%时,抑菌环直径小,抑菌效果没有得到有效发挥;TiO2含量为20%或30%时,抑菌环直径相差不大。 考虑到成本因素,后续采用含量为20%的纳米TiO2抑菌片进行抑菌测试研究。
为了探究抑菌效果与抑菌时间的关系, 使用含量20%的TiO2(20%-TiO2)样品对大肠杆菌进行抑菌圈测试,培养了12 h,并分别于12、15、18、21、24、36 h 时记录抑菌圈直径大小,绘制抑菌圈直径—时间曲线,如图2所示, 样品1 和样品3 的抑菌圈直径分别是13 mm和12 mm,且18 h 后急剧下降;而样品2 和样品4 的抑菌圈直径分别是21 mm 和15 mm,且能24 h 内保持稳定,时间继续延长至36 h,样品2 抑菌圈仅出现轻微缩小,而样品4 抑菌圈直径急剧下降。
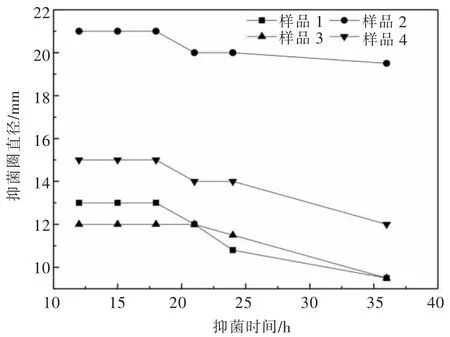
图2 20%-TiO2 抑菌片对大肠杆菌的抑菌圈直径对时间的变化趋势Fig. 2 Variation trend of inhibition diameter of 20%-TiO2 antibacterial tablets against Escherichia coli over time
采用4 种纳米TiO2样品对金黄色葡萄球菌的抑菌性能进行测试, 当不同方法制备的纳米TiO2的质量分数分别为10%、20%、30%时,对金黄色葡萄球菌的抑菌结果如图3 所示(培育12 h)。 测试结果表明:用方法2 及方法4 制备的纳米TiO2对金黄色葡萄球菌具有良好的抑菌效果,用方法1 及方法3 制备的样品对金黄色葡萄球菌的抑菌效果欠佳。

图3 不同质量分数TiO2(4 种样品)对金黄色葡萄球菌的抑菌效果(培养12 h)Fig. 3 Antibacterial effect of different concentrations of TiO2(four samples) on Staphylococcus aureus (cultured for 12 h)
为了探究抑菌效果与抑菌时间的关系, 使用20%-TiO2样品对金黄色葡萄球菌进行抑菌圈测试, 培养了12 h,并分别于12、15、18、21、24、36 h 记录抑菌圈直径大小,绘制抑菌圈直径—时间曲线,如图4 所示,样品1 的抑菌圈直径在21h 内保持13mm 以上,而后迅速下降;样品2的抑菌圈直径在24h 内能保持18mm 以上, 而后也出现减小趋势;样品3 和样品4 的抑菌圈直径则只能维持18 h稳定,分别是12 mm 和15mm,而后呈现明显减小趋势。

图4 20%-TiO2 抑菌片对金黄色葡萄球菌的抑菌圈直径对时间的变化趋势Fig. 4 Variation trend of inhibition diameter of 20%-TiO2 antibacterial tablets against staphylococcus aureus for time
由图4 可见,样品2 在TiO2质量含量为20%时所制得抑菌片的抑菌效果远优于其他3 组样品,12 h 时抑菌圈直径达20 mm,15 h 后抑菌圈直径开始减小,24 h后降至18 mm, 样品3 和样品4 的抑菌圈只能持续18 h。样品3 的抑菌效果最差, 这可能与制备过程中没有添加冰醋酸,表面不含有羧基有关。
2.2 MIC 测试结果
通过测定样品2 及样品4 的最小抑菌浓度数值,进一步对比纳米TiO2的抑菌性能。 纳米TiO2对大肠杆菌的MIC 测试的吸光度数据列于表1 和表2 中。

表1 不同浓度的样品2 对大肠杆菌MIC 测试的吸光度数值Table 1 Absorbance values of different concentrations of sample 2 for MIC test to escherichia coli
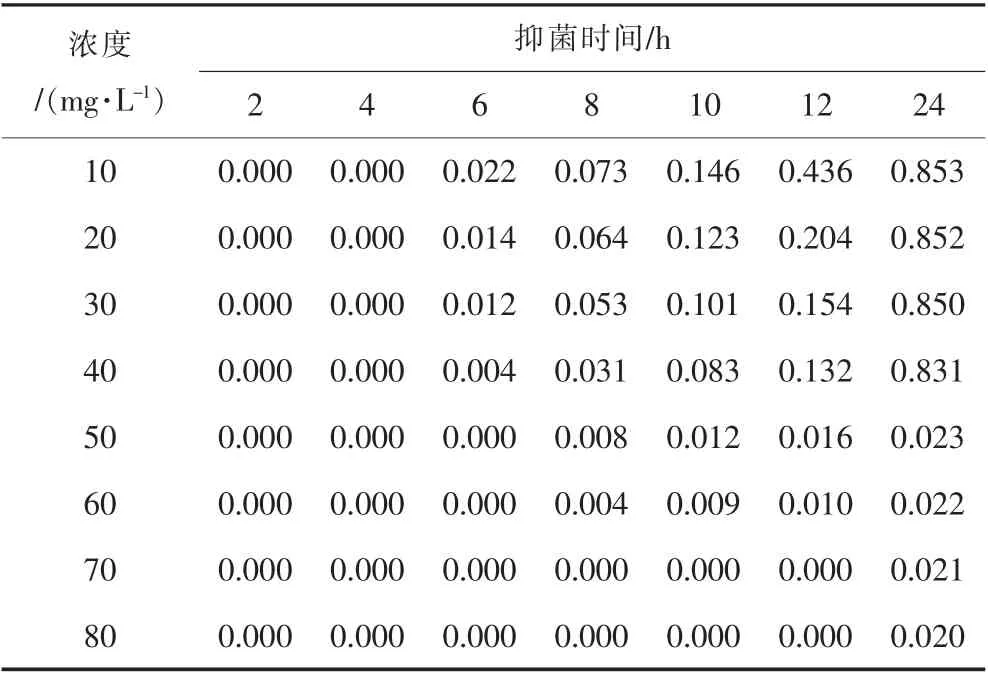
表2 不同浓度的样品4 对大肠杆菌MIC 测试的吸光度数值Table 2 Absorbance values of different concentrations of sample 4 for MIC test to escherichia coli
表1 中样品浓度为0 mg/L 即为不加抑菌粉条件下, 培养液中大肠杆菌自由生长导致吸光度的数值变化情况,可体现出溶液吸光度呈快速增长现象,符合菌落的对数生长规律。 菌落培养的过程发现,样品2 浓度大于50 mg/L 的试样在前12 h 时间内吸光度为0,表明该浓度样品2 很好地抑制了大肠杆菌的生长, 当样品2 浓度低于50 mg/L 时,试样的吸光度在12 h 内出现数值,表明在指定时间段内,大肠杆菌并未得到完全抑制,因此样品2 对大肠杆菌的MIC 为50 mg/L。类似地,样品4 浓度大于70 mg/L 的试样在前12 h 时间内吸光度为0, 表明该浓度样品4 很好地抑制了大肠杆菌的生长,当样品4 浓度低于70 mg/L 时,试样的吸光度数值在12 h 内出现数值, 表明在指定时间段内,大肠杆菌并未得到完全抑制, 因此样品4 大肠杆菌的MIC 为70 mg/L。类似地,纳米TiO2对金黄色葡萄球菌菌液的MIC 测试结果列于表3 和表4 中。

表3 不同浓度的样品2 对金黄色葡萄球菌MIC 测试的吸光度数值Table 3 Absorbance values of different concentrations of sample 2 for MIC test to staphylococcus aureus
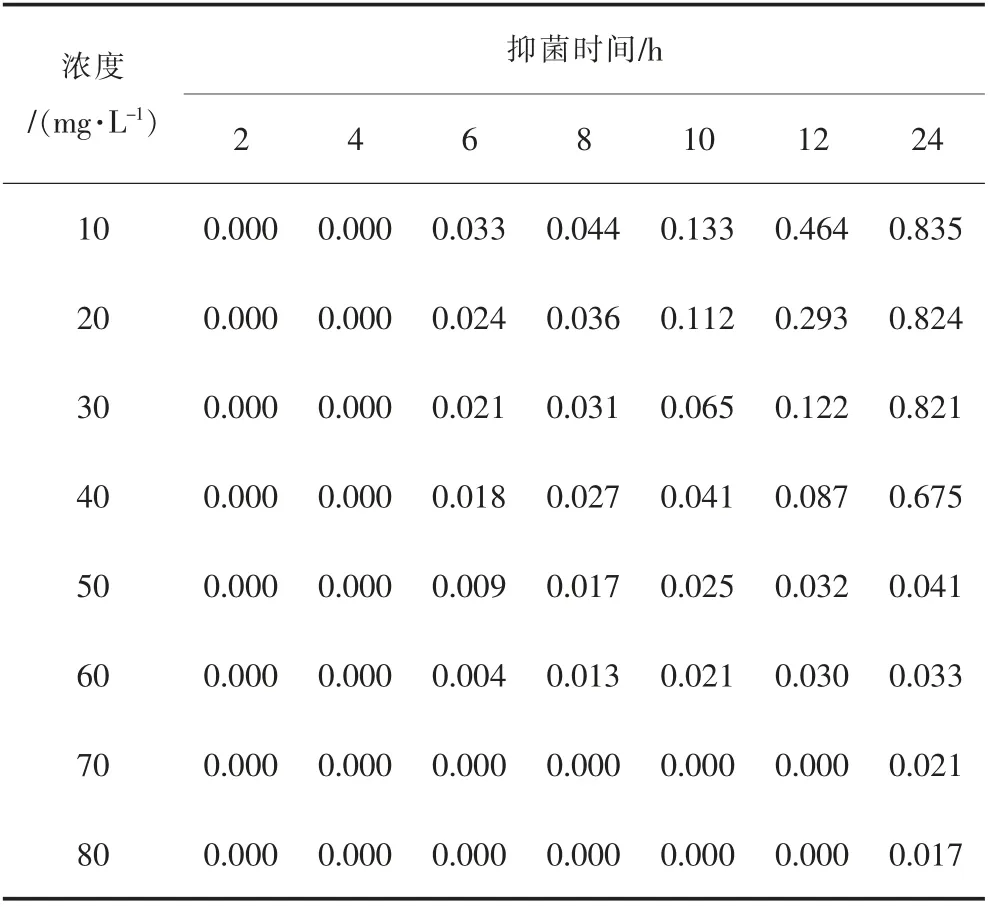
表4 不同浓度的样品4 对金黄色葡萄球菌MIC 测试的吸光度数值Table 4 Absorbance values of different concentrations of sample 4 for MIC test to staphylococcus aureus
表3 中样品浓度为0 mg/L 即为不加抑菌粉末条件下,培养液中金黄色葡萄球菌自由生长导致吸光度的数值变化情况,可体现出溶液吸光度呈快速增长现象,符合菌落的对数生长规律。菌落培养的过程发现,样品2 浓度大于50 mg/L 的试样在前12 h 时间内吸光度为0,表明金黄色葡萄球菌的生长受该浓度样品2抑制,当样品2 浓度低于50 mg/L 时,试样的吸光度数值在12 h 内出现数值,表明在指定时间段内,金黄色葡萄球菌并未得到完全抑制,因此样品2 对金黄色葡萄球菌的MIC 为50 mg/L。 类似地,样品4 浓度大于70 mg/L 的试样在前12 h 时间内吸光度为0,表明金黄色葡萄球菌的生长受该浓度样品4 抑制,当样品4 浓度低于70 mg/L 时,试样的吸光度数值在12 h 内出现数值,表明在指定时间段内,金黄色葡萄球菌并未得到完全抑制,因此样品4 对金黄色葡萄球菌的MIC 为70 mg/L。 无论是大肠杆菌,还是金黄色葡萄球菌,样品2 的MIC 数值均低于样品4,表明样品2的抑菌性能更强。
2.3 MBC 测试结果
为了进一步评价样品的抑菌性能,采用平板菌液计数法测量样品的MBC 浓度,样品2 及样品4 对大肠杆菌的MBC 测试结果如图5 所示。 图5 中a1—a4中分别为样品2 试样浓度为20、30、50、70 mg/L 时情况,其中a1—a3 均可见到菌落,表明此时细菌未完全杀灭。a4 中无菌落生长,菌落数为0,即该浓度的样品2 可以完全杀灭细菌, 样品2 对大肠杆菌的MBC 约为70 mg/L。 同理,图5 中b1—b4 分别与样品4 浓度为20、30、50、70 mg/L 相对应,其中b1—b3 均可见到菌落,表明此时细菌未完全杀灭;b4 中无菌落生长,菌落数为0,即该浓度的样品4 完全将细菌杀灭,样品4对大肠杆菌的MBC 约为70 mg/L。 样品2 及样品4 对金黄色葡萄球菌的MBC 测试结果如图6 所示。

图5 样品2 与样品4 对大肠杆菌的MBC 测试Fig. 5 MBC test of sample 2 and sample 4 against escherichia coli (a1—a4:sample 2;b1—b4:sample 4)

图6 样品2 与样品4 对金黄色葡萄球菌的MBC 测试Fig. 6 MBC test of sample 2 and sample 4 against staphylococcus aureus
图6 中c1—c4 中分别与样品2 试样浓度为20、30、50、70 mg/L 相对应,c1—c3 均可见到菌落, 表明此时细菌未完全杀灭;c4 中无菌落生长,说明菌落数近似为0, 即该浓度的样品2 达到杀灭细菌的效果,样品2 对金黄色葡萄球菌的MBC 约为70 mg/L。d1—d4 中分别与样品4 浓度为20、30、50、70 mg/L相对应,图6 中d1—d3 均可见到菌落,表明此时细菌未完全杀灭,d4 中无菌落生长, 菌落数近似为0,即该浓度的样品4 达到杀灭细菌的效果,样品4 对金黄色葡萄球菌的MBC 约为70 mg/L。 MBC 数值一致,表明样品2 和样品4 的抑菌性能相当。
综合分析可知,样品2 对大肠杆菌和金黄色葡萄球菌的抑菌效果均优于其他样品,抑菌片的抑菌效果随纳米TiO2质量分数的增加而提高。 样品4 抑菌效果次于样品2,对大肠杆菌和金黄色葡萄球菌的MIC为70 mg/L,明显高于样品2。样品1 及样品3 对大肠杆菌及金黄色葡萄球菌的抑菌效果弱。
3 表征分析
3.1 BET 表征分析
将不同的样品进行了BET 表征分析, 探究不同方法制备的TiO2样品的物理结构性质, 其数据结果列于表5。 表5 中数据表明, 溶胶—凝胶法制备的TiO2的比表面积最大, 溶剂热法制备的TiO2的比表面积最小,利用聚乙二醇和尿素改进后的水热合成法制备的TiO2的比表面积, 孔容, 孔径均有所增加;BET 分析得到的4 种样品的TiO2均具备大孔,介孔,微孔的复合型结构,样品1 的平均孔径最小,样品3的孔容较小,均可能是影响TiO2的抑菌活性的因素;样品2 的平均粒径最小,只有63.2 nm,样品3 的平均粒径最大,高达81.3 nm,其平均粒径大小顺序为:样品2>样品4>样品1>样品3,这与抑菌圈直径大小及抑菌圈大小随时间变化的趋势关系一致。

表5 不同TiO2 样品的物理结构性质Table 5 Physical structure and properties of different TiO2 samples
3.2 IR 分析
样品1—样品4 的傅里叶红外光谱如图7 所示,由于TiO2属于无机材料,红外振动峰较少,且样品的红外光谱曲线出现了大致相同的特征。 其中,650.3 cm-1处的微峰是归属于Ti-O-Ti 伸缩振动,在1 420.6 cm-1和1 580.2 cm-1的两小峰归属于-COOH特征峰,1 700.4 cm-1的微峰归因于TiO2表面吸附微量空气中CO2导致,3 000.2~3 560.3 cm-1对应的宽峰归属于-OH 振动。 c 曲线中由于样品制备未加入冰乙酸,1 420.6 cm-1和1 580.2 cm-1的峰形明显减弱,而出现的毛刺杂峰可能是由于聚乙二醇焙烧后还有残余,d 曲线中未出现聚乙二醇的峰, 可能是受-COOH,-OH 强特征峰的覆盖。 通过傅里叶红外光谱可知,样品2 及样品4 中含有Ti-O-Ti、-COOH 和-OH 键较明显, 因为溶剂无水乙醇及抑制剂冰醋酸会在TiO2上引入-OH 和-COOH 官能团,这些官能团可能会增强TiO2的抑菌性能。 因此,结合BET 表征结果可知,加入聚乙二醇和尿素,仅改变了TiO2的内层孔道结构,并未改变表层官能团种类及性能。
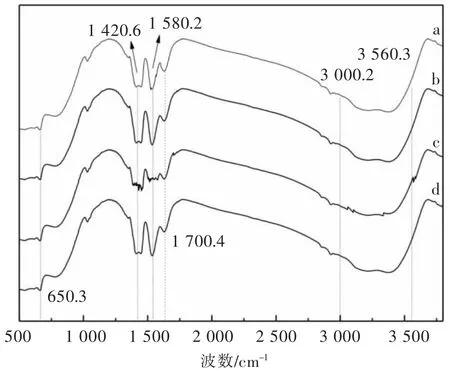
图7 纳米TiO2 抑菌剂的红外表征结果Fig. 7 Infrared characterization results of nano-TiO2 antibacterial agent
3.3 XRD 分析
纳米TiO2自身对细菌有直接氧化作用, 然而纳米TiO2表面上的-COOH 和-OH 基团也能发挥协同促进作用,这可加快细菌的新陈代谢减缓或停止的过程,从而发挥更佳的抑菌效果。除此之外,由于制备方法的差异,纳米TiO2内部的晶型结构有所不同,这对抑菌作用的发挥可能产生影响,因此,对样品分别进行XRD 表征,结果如图8 所示。

图8 样品的XRD 表征结果Fig. 8 XRD characterization of the samples
全部样品均显示出锐钛矿型 (ICDD PDF #21-1272)的特征衍射峰[25-26],a 与d 较为相似,b 和c 较为相似,e 为锐钛矿TiO2的标准卡信号。 2θ 为27.51°处出现了TiO2晶面[110]的特征衍射峰,归属于锐钛矿型TiO2的特征衍射峰,d 在此处衍射峰非常尖锐明显,表明其结晶度高。 只有b 在2θ 为46.32°处出现了TiO2晶面[112]的特征衍射峰,归属于金红石型TiO2的特征衍射峰, 可推出样品2 中的TiO2为锐钛矿与金红石型混合相,且所有衍射峰比较弥散,表明样品中结晶度低,分散性好。2θ 为36.06°、41.72°、54.24°和56.41°处的峰归属于TiO2晶面[101]、[111]、[211]和[204]的特征衍射峰,属于锐钛矿型TiO2的衍射峰;2θ为64.18°、69.04°和69.90°处的微峰归属于TiO2晶面[310]、[221]、[301] 的特征衍射峰, 也属于锐钛矿型TiO2的衍射峰, 样品3 和样品4 的TiO2近似为纯锐钛矿型单一相态[27],仅样品2 即b 中的金红石型TiO2含量相对较多。
3.4 SEM 表征分析
对纳米TiO2样品2 和样品4 进行了SEM 表征,扫描电镜结果如图9 所示。 图9 中a1、a2 分别样品2 为放大倍数分别为3 000 和5 000 时观察的结果,可见水热合成法制备的纳米TiO2的外貌形态为碎片形,且表层比较光滑。微观形貌上,纳米TiO2样品没有出现团聚,排列欠整齐但分布较为均匀。 b1、b2 分别为样品4 在放大倍数为3 000 和5 000 时观察到的结果,可见纳米TiO2的外观形貌呈珊瑚球状散乱分布,球状颗粒中还掺杂了一些形状不规则的纳米TiO2,这种球状颗粒的散乱分布使纳米TiO2的表面积增加,可能是聚乙二醇和尿素共同作用的结果,球状微观结构虽然有利于纳米TiO2在抑菌片中分散, 但球形的TiO2颗粒中已出现一定程度的团聚, 不利于内部的TiO2发挥抑菌活性。

图9 样品2 和样品4 的SEMFig. 9 SEM of sample 2 and sample 4
3.5 晶型结构分析
TiO2的不同晶型存在着明显的结构差异,锐钛矿和金红石晶型都属于四方晶系,但晶胞和晶胞体积不同,如图10 所示。 锐钛矿TiO2晶胞由4 个分子组成,晶胞呈长方体特征, 晶格常数为0.38 nm×0.38 nm×0.95 nm;金红石TiO2晶胞由2 个分子组成,中心为钛原子, 周围的6 个氧原子位于八面体的棱角处,晶格常数为0.46 nm×0.46 nm×0.30 nm。

图10 TiO2 的不同晶型结构Fig. 10 The unit cell structures of TiO2
相同质量的TiO2由于晶型的差异将会具备不同的空间大小, 这种明显的差异性导致了金红石TiO2可以使更多的高氧化数钛原子与微生物直接接触,有利于发挥抑菌性能, 这与BET 表征结果中样品2 的平均粒径相对最小相一致。因此,纳米TiO2的内部晶型对抑菌效果有间接影响,在锐钛矿晶型中混合适当的金红石矿TiO2,有利于内部结构的调整,金红石矿TiO2体现出更强的抑菌活性。
综上所述,溶胶凝胶法制备的样品1 的比表面积最大, 但在性能测试中并未体现最好的抑菌效果,而水热合成法制备的样品2 的抑菌效果较优。添加聚乙醇和尿素的水热合成法制备的样品4, 比表面积,孔径、孔容、微观结构均有优势,也确保了TiO2内部晶型的纯度,抑菌效果次之。 制备过程中添加冰醋酸,纳米TiO2的表层增加了许多-COOH 官能团, 抑菌性能优于未加冰醋酸的样品3, 表明表面官能团的引入可协助发挥抑菌活性,这与文献[28]的结论相一致。
因此, 纳米TiO2抑菌片的抑菌活性与纳米TiO2的制备过程、表面的官能团种类及数量、微观结构等有关联,调节相应的制备工艺,将使得纳米TiO2抑菌片对大肠杆菌和金黄色葡萄球菌发挥更优的抑菌效果, 这可为高效TiO2抑菌片的制备发挥积极的指导作用。
4 结 论
以钛酸四丁酯为钛源,采用溶胶—凝胶法、水热合成法、溶剂热法及改性水热合成法制备了4 种纳米TiO2样品,并与马铃薯淀粉混合制备成抑菌片。 通过对比不同纳米TiO2抑菌性能及对样品进行表征,得到如下结论:
1)通过抑菌圈实验可得,抑菌片的抑菌性能大小顺序为:样品2>样品4>样品1>样品3,增加抑菌片中纳米TiO2含量可提高抑菌活性,样品2 的抑菌圈直径在20 mm 处可持续24 h,样品2 对大肠杆菌和金黄色葡萄球菌的MIC 都为50 mg/L, 样品4 对大肠杆菌和金黄色葡萄球菌的MIC 均为70 mg/L,样品2 和样品4 对大肠杆菌和金黄色葡萄球菌的MBC 均为70 mg/L。
2)4 种方法制备的TiO2样品的抑菌活性相差较大,通过水热合成法制备的样品2 具有较好的抑菌活性,归因于晶型结构的不同与表面官能团种类及数量差异,而比表面积和孔道结构影响较少。
3)通过物理结构表征发现冰醋酸会在TiO2上引入-COOH 官能团, 对抑菌活性的发挥有益, 加入聚乙二醇和尿素可改善比表面积、孔容及孔径,可适当提高抑菌活性, 但TiO2自身的晶型影响更为显著。
综上所述,纳米TiO2抑菌性能与制备方法、醋酸的投入、晶型的构成有关,这对后续继续改进TiO2抑菌材料的设计与制备具有重要的指导作用。
