骨肉瘤转移的风险因素和患者预后的研究以及临床预测模型的开发和验证
2022-11-30罗三彤梁伟明
罗三彤 梁伟明
骨肉瘤是最常见的原发性恶性骨肿瘤,约占总病例的 35%[1],主要起源于骨中的原始恶性间质细胞[2],可产生骨样物质[3]。手术切除加术前术后化疗是目前该病的治疗标准,包括手术和肿瘤治疗[4]。 以往的研究讨论了骨肉瘤的预后因素,包括是否存在人口学特征和病理学因素,如患者年龄[5-6]、肿瘤部位[7-9]、肿瘤大小[10-11]、远处转移[12-14],以及手术[15-16]、化疗[14,17]和放疗[11,18-19]等治疗方式,都有相关研究报道其影响患者的预后。鉴于骨肉瘤的临床独特性,无疑迫切需要新的预后工具来准确预测骨肉瘤患者的生存情况。列线图是一种可视化的数学模型,可以个性化地计算骨肉瘤患者的生存率。它已成为一种可靠、方便的风险量化工具,被广泛用于预测癌症预后,在临床上具有重要价值[20]。总生存期 (overall survival,OS)是一个值得关注的终点。OS 被定义为从诊断出所有可能的死亡原因的时间。最后一次随访时还活着的患者被认为是被审查的数据。作者认为肿瘤特异性生存率 (cancer-specific survival,CSS)是另一个感兴趣的终点,并将其定义为从诊断到死于癌症的时间。
在研究队列中纳入足够数量的患者是相当具有挑战性的。因此,本研究使用监测、流行病学和最终结果 (Surveillance,Epidemiology,and EndResults,SEER)数据库进行分析,该数据库是美国权威的癌症统计数据库,记录了美国部分州和县的数百万恶性肿瘤患者的发病率、病死率和患病情况等信息。SEER 数据库是美国一个权威的癌症统计数据库。它可以为临床研究提供依据。
在这项研究中,根据 SEER 数据库中骨肉瘤患者的数据,确定了转移的危险因素和 OS 与 CSS 的预后因素,并开发了一个预测骨肉瘤患者 OS 和 CSS 的列线图。
资料与方法
一、纳入标准与排除标准
本研究所有数据来自 SEER 数据库。使用 SEER*STAT (8.3.5 版)软件,提取患者的人口统计学特征、临床病理治疗和患者治疗 (手术、放疗和化疗)信息等数据。
1.纳入标准:(1)原发性恶性肿瘤的骨肉瘤,国际肿瘤疾病分类 ICD-O 编码。9180、9181、9182、9183、9184、9185、9186、9187、9192、9193、9194 或 9200;(2)2004 - 2015年诊断的患者,2004年以前的临床病理信息大多不完整,肿瘤分期和大小等变量不清楚;(3)骨肉瘤是第一且惟一的原发性恶性肿瘤;(4)完整的临床信息,包括诊断时的年龄、性别、种族、原发部位、肿瘤大小、肿瘤扩展、远处转移、肿瘤定向手术以及是否进行了放疗和化疗;(5)诊断来自存活的患者,不包含尸体;(6)有完整的随访信息;(7)已知死因和诊断后的生存时间。
2.排除标准:(1)不完整的临床病理和生存信息;(2)未知的肿瘤大小、分期和种族;(3)空缺的数据。
二、预测变量
患者的年龄、性别、种族、民族、肿瘤分期、肿瘤部位、肿瘤大小、使用手术、放疗、化疗和生存时间。采用 X-TILE 程序将患者的年龄和肿瘤大小分层为 3 组,以获得最佳分界点 (图1),其中年龄分为 < 25 岁组、25~60 岁组和 > 60 岁组;肿瘤大小分为 < 9.6 cm 组、9.6~17.0 cm 组和 > 17.0 cm 组。此外,由于 SEER 数据库中没有记录骨头的确切位置,作者将受影响的四肢分为上肢骨、下肢骨以及口腔、面部和中轴骨骼。根据 SEER 程序编码和骨肉瘤分期手册[21],SEER 分期分为局限性 (局部,局限于骨膜)、区域性 (从骨膜延伸到周围组织,但没有远处转移)和远处 (远处,诊断时有远处转移)。局部和区域分为非转移性 (non-metastatic), 远端分为转移性 (metastatic)组。手术分为不手术 (no surgery)、局部切除 (local resection)和根治性切除 (radical resection)组,放疗和化疗分为接受 (yes)和不接受 / 未知 (no / unknown)。
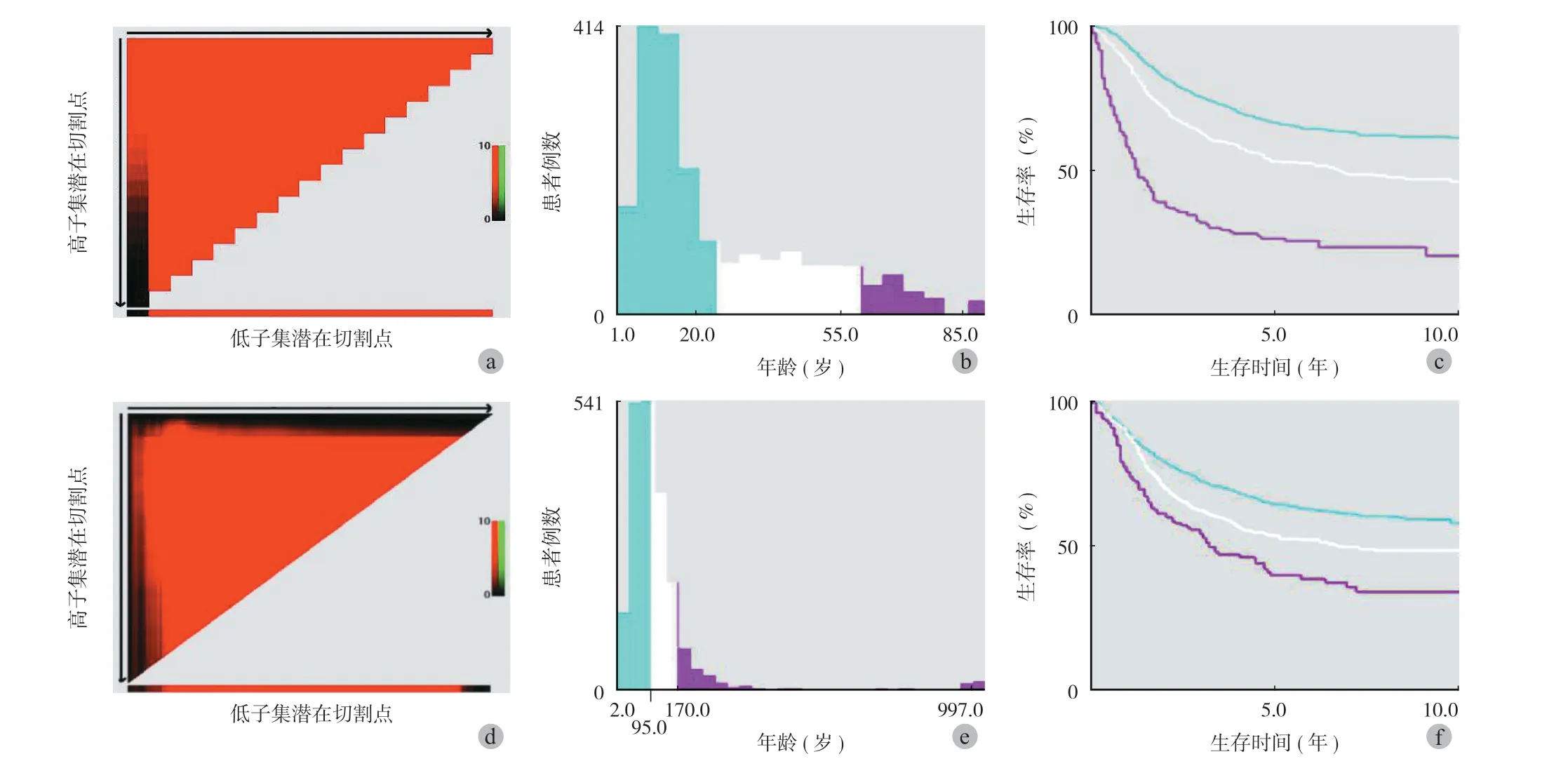
图1 a~f:显示了通过 X-Tiles 分析确定的年龄和肿瘤大小的最佳截止值。(a,d)中的黑点表示年龄和肿瘤大小的最佳截止值已经确定。直方图(b,e)和 Kaplan-Meier (c,f)是根据确定的截止值构建的。根据生存率,年龄和肿瘤大小的最佳截止值分别为 25 岁和 60 岁,以及 9.6 cm 和 17.0 cmFig.1 a - f: The best cut-off values for age and tumor size determined by X-Tiles analysis.The black dots in (a, d)indicated that the optimal cutoff values for age and tumor size had been determined.Histograms (b, e)and Kaplan-Meier (c, f)were constructed based on the determined cut-off values.The optimal cut-off values for age and tumor size according to survival were 25 and 60 years, 9.6 cm and 17.0 cm, respectivelyand Kaplan-Meier (c, f)analysis based on the cut-off values of the age and tumor size
三、数据的分析
1.转移的风险因素:本研究选择了 5 个人口统计学特征和临床病理变量作为代理危险因素:年龄 (诊断时年龄)、性别、种族、原发部位和肿瘤大小。采用单因素逻辑回归选择变量作为与诊断时转移相关的可能风险因素,然后采用多因素逻辑回归确定单变量回归中选择的风险因素。ROC 曲线显示了单个风险因素和联合模型的预测能力,并给出了曲线 AUC 值。此外,本研究还提出了额外的治疗信息,包括手术、放疗和化疗。用χ2检验来比较非转移组和转移组在 5 个风险因素组合中的差异。使用 IBM SPSS version23.0 软件进行χ2检验、单程和多程逻辑回归分析,P< 0.05 被视为差异有统计学意义。ROC 图和 AUC 计算由 Graphpad prism 8.0 制作。
2.生存分析:在预后分析中,采用 Kaplan-Meier 估计各变量的生存曲线,并采用 Log-rank 检验来确定生存曲线之间差异的意义。采用单变量 Cox 回归分析,筛选出可能与 OS 和 CSS 相关的预后因素,然后采用多变量 Cox 回归分析,选择 OS 和 CSS 的独立预后因素。使用 SPSS 23.0 版软件进行对数检验和 Cox 回归分析,P< 0.05 为差异有统计学意义。
3.列线图的开发及验证:本研究的目的是构建一个预测骨肉瘤患者的 OS 和 CSS 概率的列线图。所有患者按 7∶3 的比例随机分为训练组和验证组,并根据训练组的数据绘制列线图。使用一致性指数 (C-index)来评估列线图的预测能力。C-指数值为 0.5~1.0,0.5 表示完全随机化,1.0 表示完全校正的区分。并使用校准图将列线图的预测结果与实际观察到的生存结果进行了内部和外部的比较。列线图是由 R 3.5.1 版本 (http://www.rproject.org/)开发和验证的。
结 果
一、基线病例特征
基于 SEER 数据库,收集了 2004 - 2015年,所有骨肉瘤患者的信息,共 3315 例。最终本研究纳入 1807 例。
患者的人口统计学和临床病理学特征见表 1。根据有无转移本组 1807 例分为转移组和非转移组,非转移者 1547 例,占 72.8%,转移者为 260 例,占 27.2%。1807 例中,年龄 < 25 岁者 1180 例,占 59.5%。非转移组年龄 > 60 岁者比例高于转移组 (P< 0.0001)。男 1080 例,占 54.40%,女 904 例,占 45.60%。1984 例中,1497 例为白种人,占 75.50%。上述人口基线数据与以往流行病学调查基本一致[5]。而且非转移组和转移组在种族和性别差异无统计学意义 (P> 0.05)。骨肉瘤最常见的原发部位是下肢 (n= 1266,63.80%),其次是口腔、面部和中轴骨骼 (n= 468,23.60%)。非转移组中,病变发生在口腔、面部和中轴骨骼的比例高于转移组 (P< 0.0001)。骨肉瘤的传统治疗方法是手术和化疗,两组患者中仅有不到 10% 的患者未接受手术,其中非转移组中更多的患者未接受手术 (P< 0.0001)。本组 1620 例患者接受化疗,占 81.70%;无论是否存在转移,转移组与非转移组的患者接受化疗的比例差异无统计学意义 (P= 0.332)。两组患者中只有 199 例接受了放疗,占 10%;而未有转移的患者接受放疗的比例更高 (P< 0.001)。
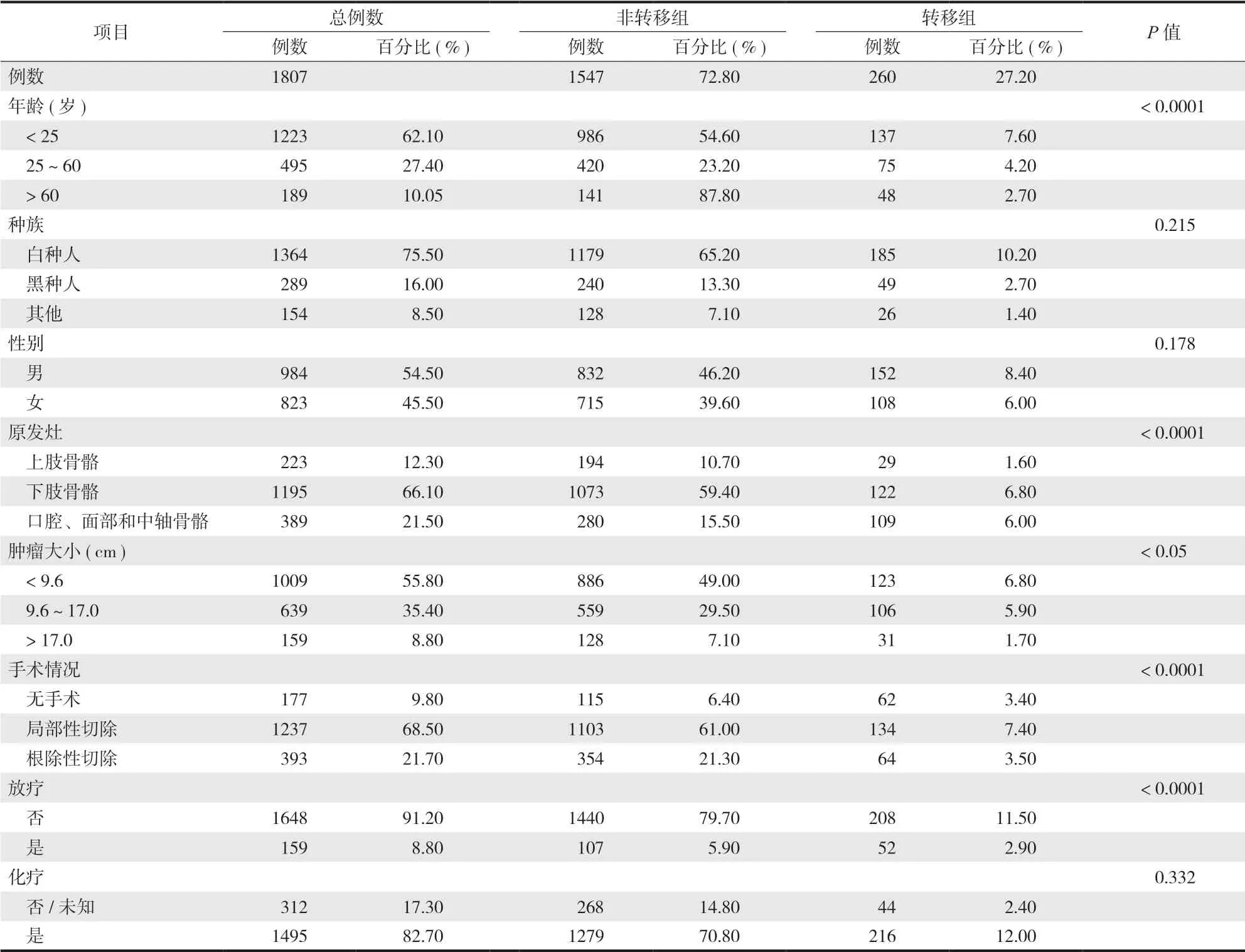
表1 转移组和非转移组患者的基线人口学和临床病理学特征Tab.1 Baseline demographic and clinicopathological characteristics of all patients (metastatic and non-metastatic groups)
二、骨肉瘤患者出现转移的风险因素
Logistic 回归结果 (表 2)显示,年龄、原发部位和肿瘤大小与诊断时的远处转移有关 (P< 0.05)。OR(优势比)显示诊断时有转移的相对风险。在多因素逻辑回归分析中,老年患者的风险高于 10 岁以下的患者,表明 60 岁以上的患者在诊断时更容易发生转移。此外,肿瘤较大的患者 (9.6~17.0 cmOR= 1.76,95%CI1.329~2.33,P< 0.0001;> 17 cmOR= 2.343,95%CI1.523~3.603,P< 0.0001)转移的风险较高。相对于四肢,口腔、面部和中轴骨骼的病变转移风险更高 (OR= 3.291,95%CI2.098~5.163,P< 0.0001)。
年龄、性别、种族、原发部位和肿瘤大小的 ROC 曲线显示如下 (图2)。联合模型是一个多因素的逻辑回归函数,包括年龄、原发部位和肿瘤大小。联合模型的 AUC 值最高 (AUC 0.688,95%CI0.653~0.722),表明联合模型是诊断时转移的更好预测指标。
三、影响骨肉瘤患者生存的预后因素
对癌症患者的治疗和管理的最终目的是提高患者的生存率。Kaplan-Meier 生存曲线显示 OS、CSS 和各种因素间存在关联,CSS 结果显示与 OS 一致 (图3、4)。除了种族 (race)和化疗 (chemotherapy), 其它都与 OS 相关 (P< 0.05)。
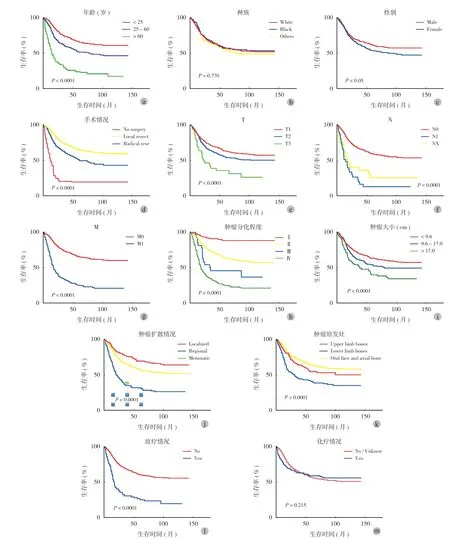
图3 骨肉瘤患者 OS 的 Kaplan-Meier 曲线。根据 a:年龄 (age);b:种族 (race);c:性别 (sex);d:手术情况 (surgery);e~g:疾病分期 (TNM);h:肿瘤分化程度 (stage group);i:肿瘤大小 (tumor size);j:肿瘤扩散情况 (extension);k:肿瘤原发灶 (prima site); l:是否放疗 (radiation);m:是否化疗 (chemotherapy)来评估患者的 OSFig.3 Kaplan-Meier curve for overall survival (OS)of patients with osteosarcoma.Evaluate the overall survival rate of patients with osteosarcoma based on age, race, sex, primary site, surgery, TNM, stage group, tumor size, extension, radiation and chemotherapy
在排除了 KM 分析中没有统计学差异的种族和化疗后,用单变量 Cox 回归分析其余因素是否与生存期有关,然后用多变量 Cox 回归分析来确定该变量是否是独立的预后因素。OS 和 CSS 的结果基本一致 (表 3、4)。Cox 回归分析显示,年龄较大 (age)、肿瘤体积较大 (tumor size)、肿瘤分期较高 (stage group)、诊断时有转移 (extension)、未接受手术治疗与预后较差有关 (P< 0.05)(表 3、4),这些因素均为独立预后因素。
四、列线图的开发和验证
列线图是一种对 Logistic 和 Cox 回归结果进行量化和可视化的方法[22]。在这项研究中,本组 1807 例,按 7∶3 的比例随机分配到训练集 (1268 例)和验证集 (539 例)(表 5),然后结合多变量 Cox 回归分析中与 OS 及 CSS 相关的独立危险因素,制定 3年和 5年 OS (图5)和 CSS (图6)概率方面的列线图,并绘制校准曲线,评估预测结果和观察的实际结果之间的一致性。内部和外部验证的 OS 的 C-指数分别为 0.785 和 0.788 (图7);内部和外部验证的 CSS 的 C-指数分别为 0.797 和 0.788 (图8)。
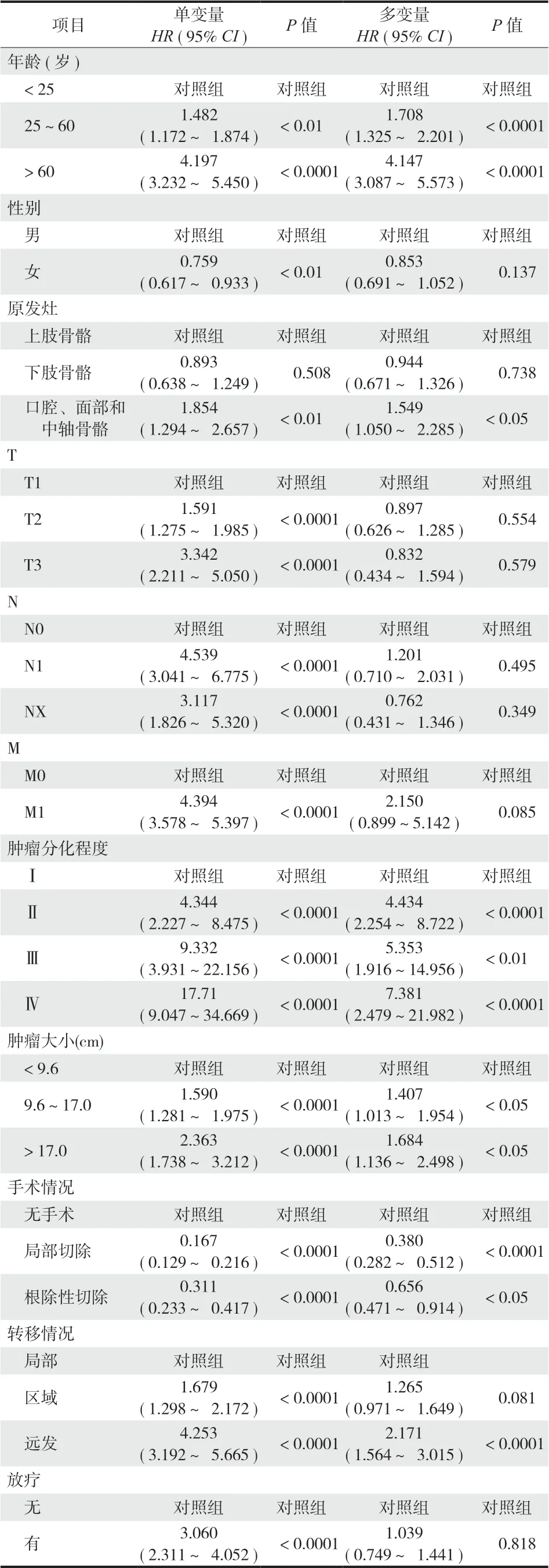
表4 骨肉瘤患者特异性生存的单变量和多变量的 Cox 回归分析Tab.4 Univariate and multifactorial Cox regression analysis of patient-specific survival of patients with osteosarcoma
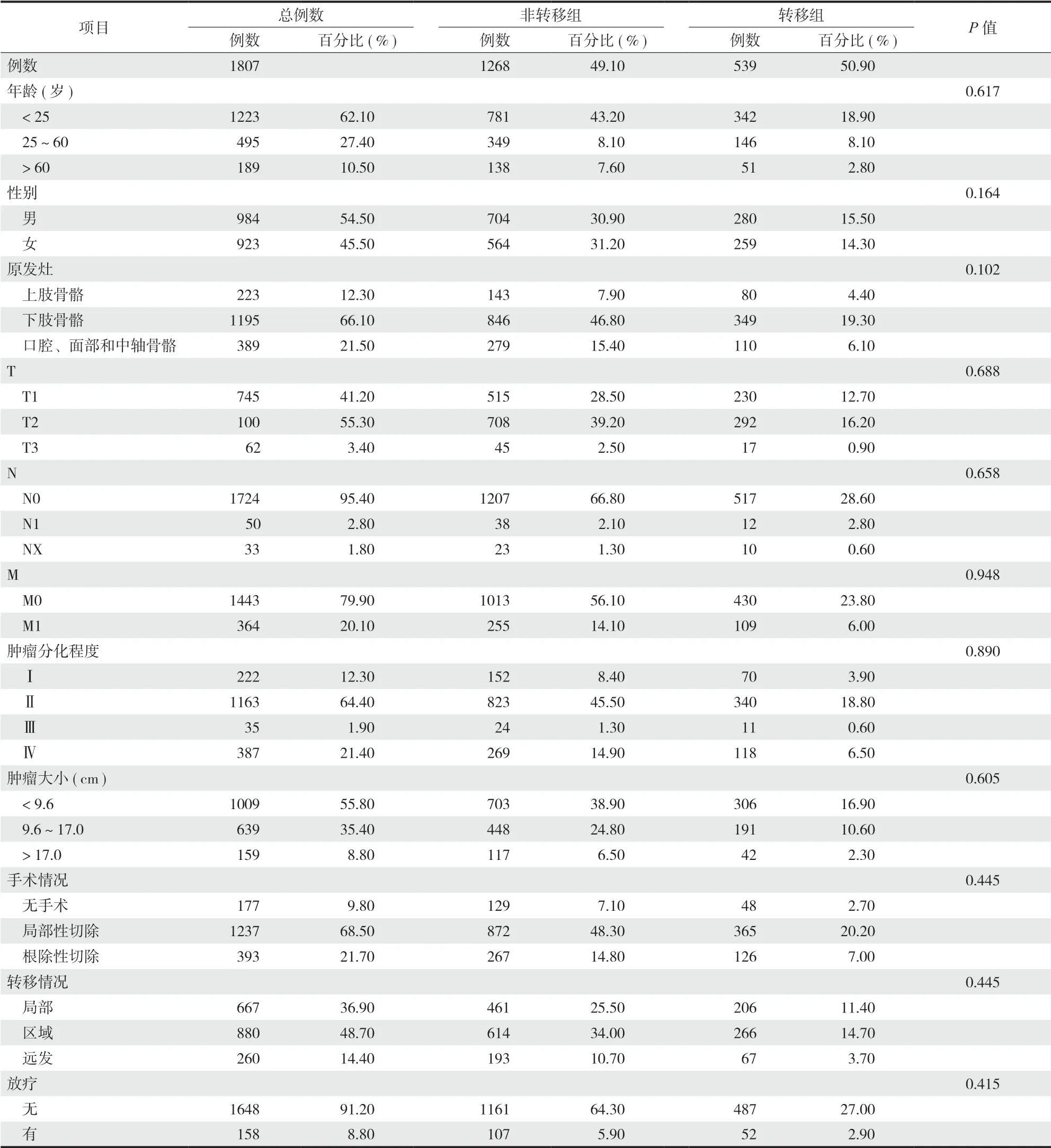
表5 训练集和验证集的特征Tab.5 Characteristics of the training and validation sets
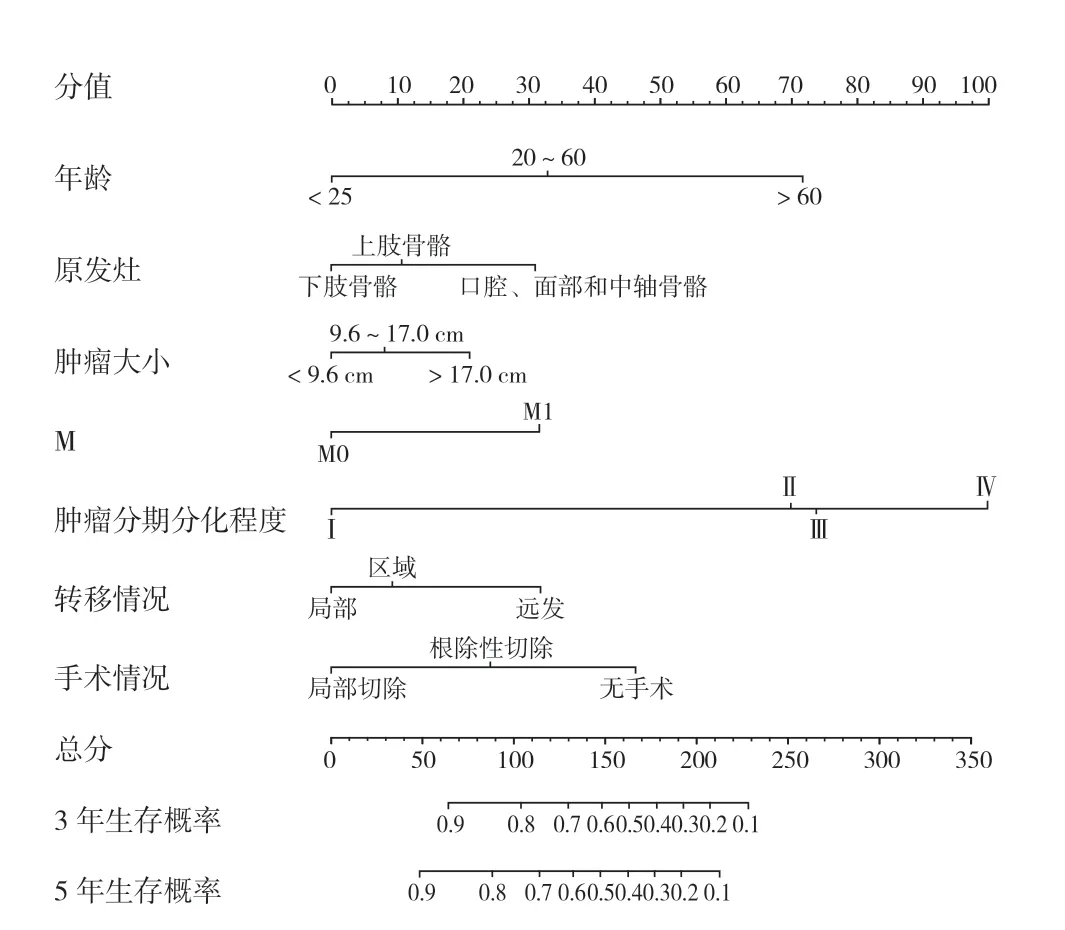
图5 预测 OS 的列线图Fig.5 Nomogram to predict the probability of OS
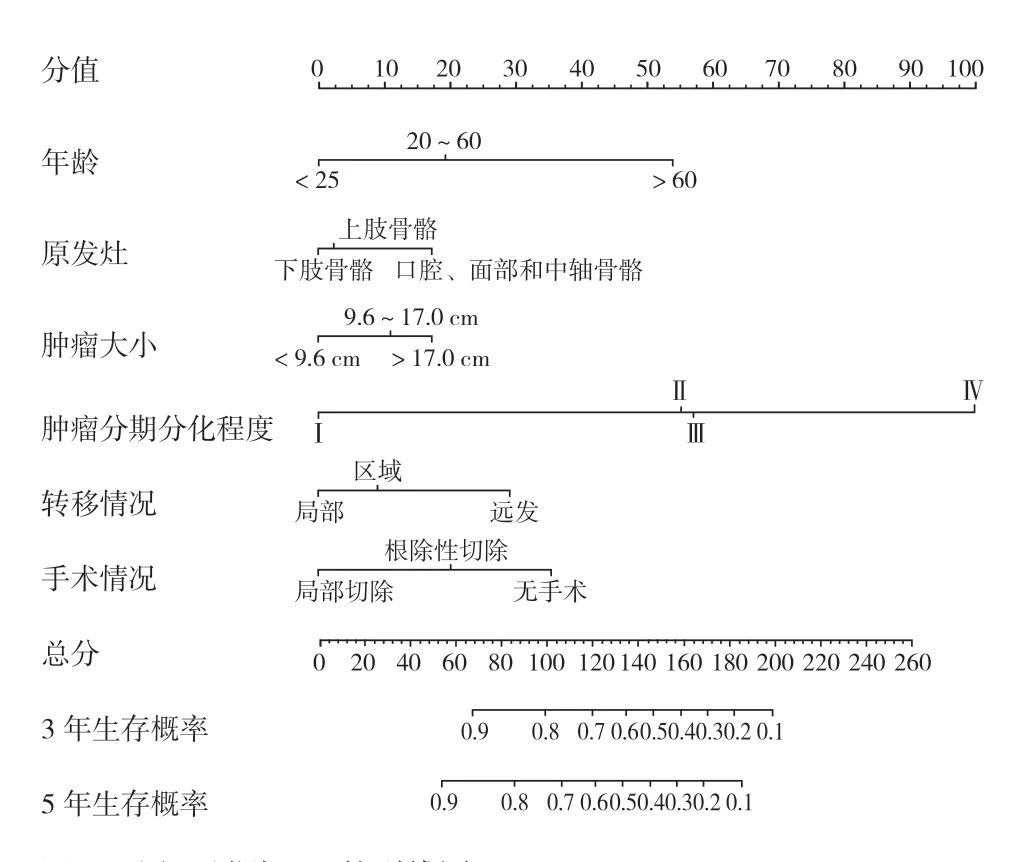
图6 用于预测 CSS 的列线图Fig.6 Nomogram to predict the probability of CSS
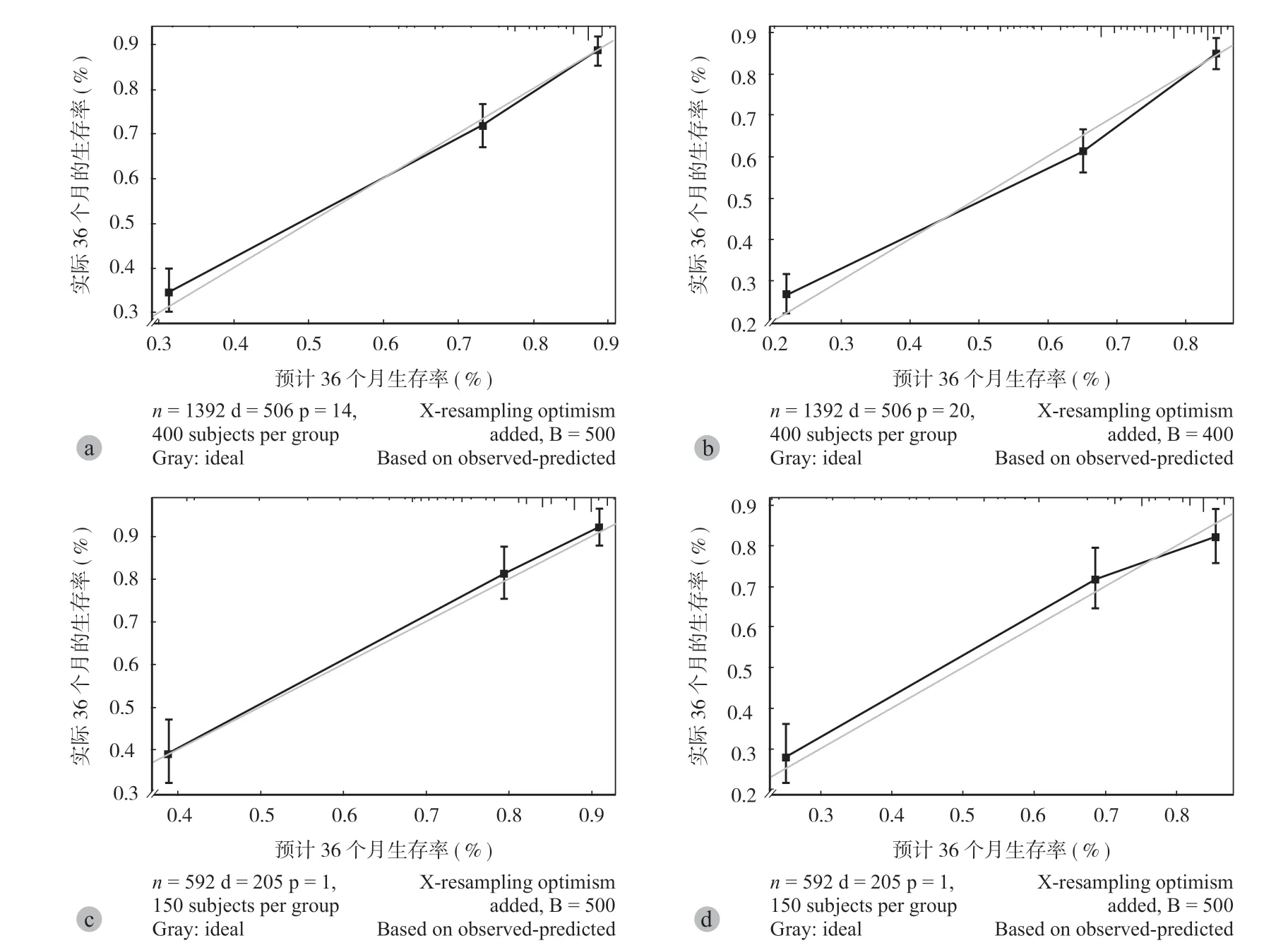
图7 列线图预测 OS 的验证校准图a、b:显示 3年和 5年总生存率的内部验证校准图;c、d:显示 3年和 5年总生存率的外部验证校准图Fig.7 Validation calibration plots for Nomogram to predict OS a - b: Internal validation calibration plots for 3- and 5-year overall survival; c - d: External validation calibration plots for 3- and 5-year overall survival
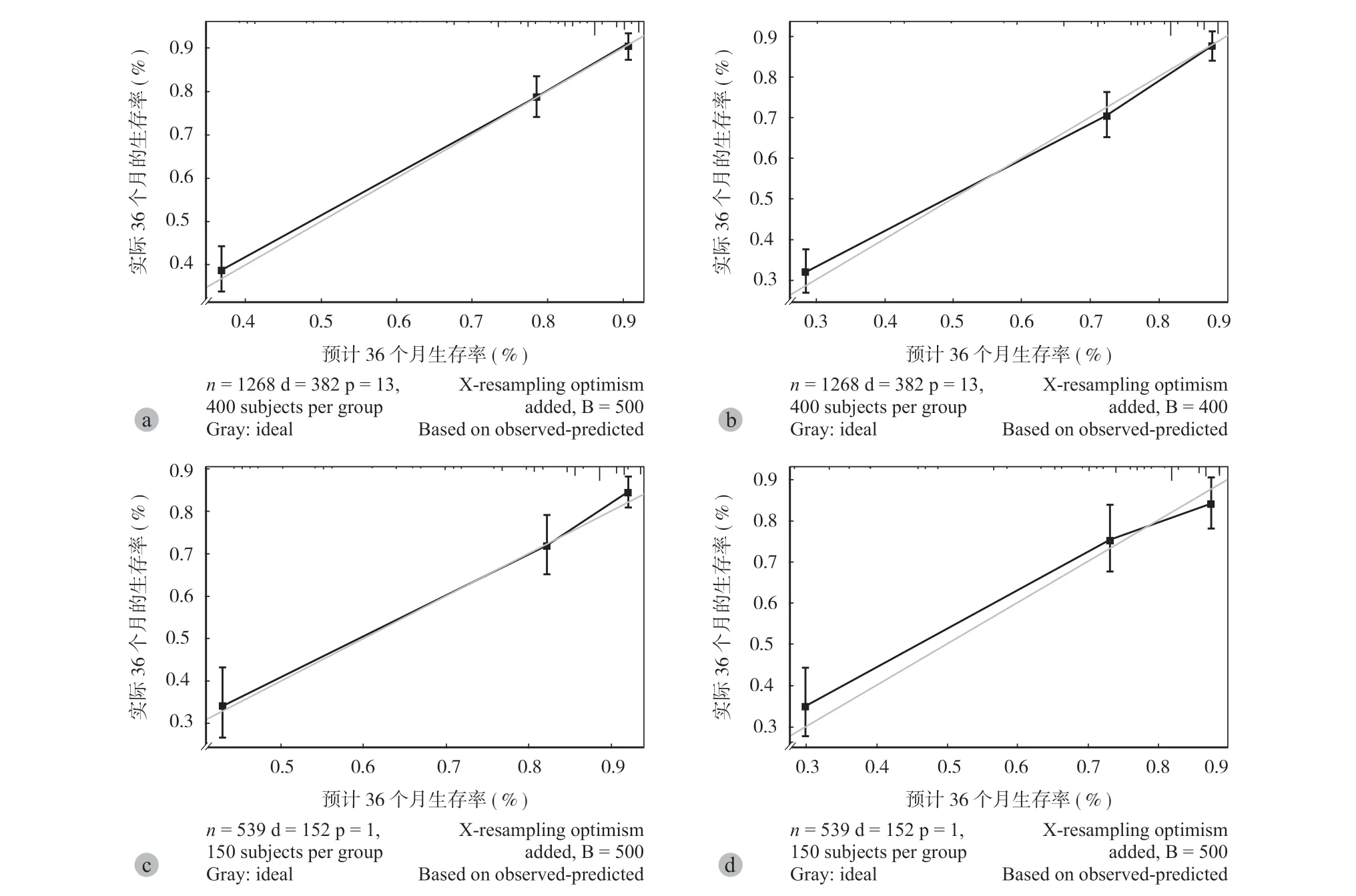
图8 预测 CSS 的列线图的验证校准图a、b:显示 3年和 5年 CSS 的内部验证校准图;c、d:显示 3年和 5年 CSS 的外部验证校 准图Fig.8 Validation calibration plots for the Nomogram to predict CSS a - b: Internal validation calibration plots for the 3- and 5-year CSS; c - d: External validation calibration plots for the 3- and 5-year CSS
讨论
骨肉瘤是最常见的骨骼原发性恶性肿瘤,多见于儿童和青少[2]。自 20 世纪 80年代中期以来,随着治疗的标准化和辅助化疗的使用,骨肉瘤患者的 5年生存率已提高到约 65%[23]。然而,骨肉瘤是一种侵袭性和播散性肿瘤,具有很高的局部复发和远处转移的倾向,大约 20% 的患者在最初发病时,
临床已经发现转移[23-24],大约 30% 的患者在诊断后 1年内出现肺转移[25]。绝大多数患者最终死于肺转移,早期发现高危转移的患者有助于进一步改善骨肉瘤患者的整体预后。表 1 中比较转移组和非转移组的结果显示,转移组的病例比非转移组的病例年龄更大,肿瘤尺寸更大。对于发生转移的患者,医师一般选择更积极的治疗方案,如更彻底的手术方案,更倾向于使用放疗,但在使用化疗方面没有明显差异,这可能与化疗已被纳入骨肉瘤的常规治疗有关。表 2 显示,发病时年龄越大[7,26],肿瘤体积越大[27-28],原发部位为中轴骨骼的肿瘤[7,9,29],诊断时发生远处转移的机会越大。图2 中的 AUC 值为 0.688,提示该模型对肿瘤发生转移的概率有很好的预测能力。但大量研究表明,骨肉瘤的转移与基因、转移机制、蛋白质和 RNA 有关[30-32],而 SEER 数据库并不包含相关数据,因此该模型的预测能力还有很大的提升空间。
现有的骨肉瘤临床分期系统,如 AJCC 分期[33]和 Enneking 分期[34],只能根据最初的临床特征大致评估骨肉瘤的临床风险,对患者的个体化预测和临床医师的医疗决策没有明显帮助。列线图是当今广泛使用的预测特定事件发生和估计医疗预后的工具,特别是在临床肿瘤学中。列线图通过整合不同的预测变量和决策变量来生成临床事件个体的概率,其可视化和量化的优势在临床实践中同样具有很大的实用价值[35]。在本研究中,开发了预测 OS 和 CSS 概率的列线图,该图将预后风险因素可视化,区分高危例群,然后预测具有不同临床病理特征的患者的预后情况。在临床实践中,具体患者的预后很难预测,目前国内还没有大规模的骨肉瘤患者的预后统计。此外,大多数预后研究只显示了风险因素和预后间的相关性,而没有对结果进行量化和可视化。本研究模型整合了多种统计学、临床病理学和治疗方式,为临床医师提供了预后参考,有助于在最初诊断时预测复发和总生存期并指导后续治疗。如果预测患者有较早的复发风险,医师会考虑更密切的随访和监测。在使用列线图时,每位患者的分值位于每个变量轴上,找出每个变量的对应得分,将所有变量的得分相加,最后找出总得分位于总分数点的数轴,并向下绘制一条向下到生存轴的线,从而预测患者 3年和 5年生存和复发的可能性。尽管这项研究显示了良好的校准结果,但如果应用于不同的队列,其判别能力会有所不同,这仍然需要用其他患者队列进行进一步验证。
图3 和图4 的 KM 分析结果显示,化疗的 KM 曲线在 OS 和 CSS 上都有交叉。考虑到本研究为回顾性,可能存在数据缺失和偏差,无法进一步进行 Cox 分析。在 Cox 生存分析中 (表 3,4),年龄 > 25 岁,肿瘤位置在中轴骨骼,没有手术治疗,肿瘤分期 Ⅱ、Ⅲ、Ⅳ 期,肿瘤体积 > 9.6 cm、手术和远端转移都是预后的相关独立危险因素 (多因素 Cox 分析的P< 0.05)。放疗没有显示出独立的预后价值,考虑到放疗都是局部控制的治疗,其疗效取决于肿瘤大小、原发部位和肿瘤范围,可以作为一个混杂因素,甚至提示放疗的预后因素较差[24]。由于大多数患者都不接受放疗,与手术治疗和化疗相比,只有更大、更广泛的肿瘤患者才可能接受放疗,这一患者群体的基线特征可能比不接受治疗的患者更差[36-37]。
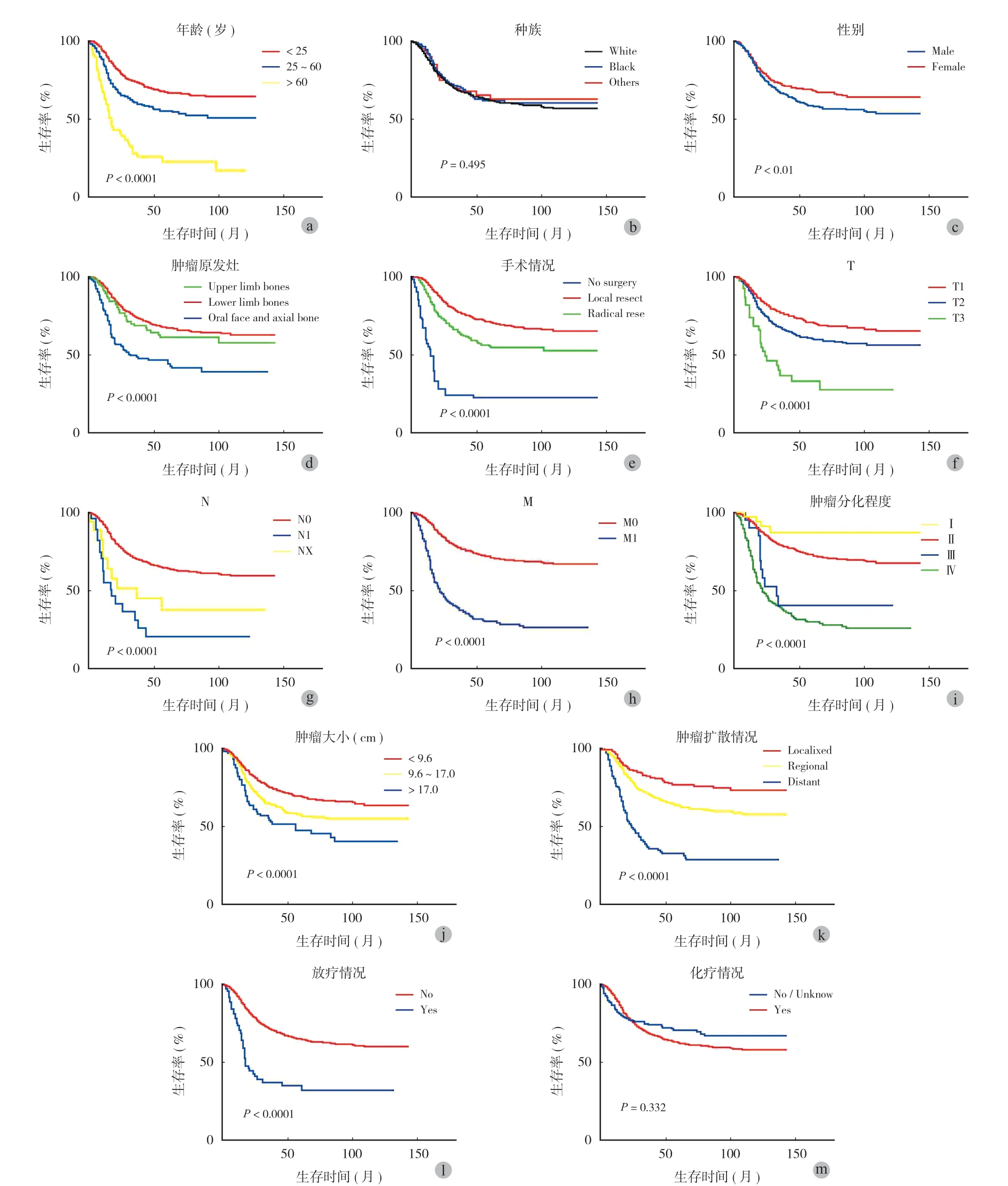
图4 骨肉瘤患者的 CSS 的 Kaplan-Meier 曲线。根据 a:年龄 (age);b:种族 (race);c:性别 (sex);d:肿瘤原发灶 (primary site);e:手术情况 (surgery);f~h:疾病分期 (TNM);i:肿瘤分化程度 (stage group);j:肿瘤大小 (tumor size);k:肿瘤扩散范围 (extension);l:是否放疗 (radiation);m:是否化疗 (chemotherapy)来评估患者的 CSSFig.4 Kaplan-Meier curve for tumor-specific survival (CSS)of patients with osteosarcoma.Evaluate the tumor-specific survival rate of patients with osteosarcoma based on age, race, sex, primary site, surgery,TNM, stage group, tumor size, extension, radiation and chemotherapy
骨肉瘤患者的年龄分布是双峰的[5],第一个高峰发生在 10~14 岁年龄段,与青春期生长相吻合,表明青春期生长高峰与骨肉瘤之间有密切关系。第二个骨肉瘤高峰发生在 65 岁以上的成年人,其更可能代表第二种恶性肿瘤,通常与佩吉特氏病有 关[38-39]。骨肉瘤是一种侵袭性的恶性肿瘤,出现在轴位的骨肉瘤患者的生存预期较差,这可能与轴位的肿瘤与四肢部位的肿瘤相比,在手术中更难完全切除有关。较大的肿瘤体积使手术切除更难将肿瘤边缘切除干净,这也与以前的研究结果相似[40]。
SEER 数据库在数据量方面都带来了无可比拟的优势,但也出现了相应的局限性。以往的研究表明,不同的化疗方案、强度、持续时间、周期数和治疗反应也是临床实践中与预后相关的重要因素。然而,这些精确的记录是很难收集的。此外,SEER 数据库中缺少更完整的遗传和治疗数据,研究人员应收集相关数据,然后探索最佳的个体化精准治疗,以改善骨肉瘤患者的生存状况。此外,与肿瘤大小、分期和治疗数据有关的记录标准仍然存在差异。最后,手术方法的改进、新的化疗药物和方案以及化疗的方式也与预后有关,但这在 SEER 数据库中很难捕捉到,作者只能将分析简化为已治疗或未治疗。在考虑将这一预测模型用于临床时,有必要根据实际情况进行一些调整。
本研究的局限性如下。(1)SEER 数据库中的主要数据来自于北美,因此,在使用该模型之前,可以通过使用当地数据进行外部验证,进一步提高模型的准确性。(2)该模型基于回顾性数据,不可避免地存在固有的偏差。
本研究分析了影响骨肉瘤患者发生转移的风险因素以及与患者预后相关的人口统计学、临床病理学和治疗方式。年龄、肿瘤大小、肿瘤位置在口腔、面部和轴性骨病变是发生转移的高风险因素。在生存分析中,年龄、肿瘤在口腔、面部和轴性骨病变的位置、肿瘤分期肿瘤大小、手术和转移范围是影响预后的相关独立因素。本研究建立的预测模型与国内外实际观察结果吻合,可以帮助医师在实际临床工作中预测特定患者的预后,有助于指导治疗、随访,提高治疗的准确性和个体化。
