纯氧及气调无水保活下珍珠龙胆石斑鱼存活情况比较及机理分析
2022-11-30黄湘湄秦小明范秀萍
黄湘湄,黄 和,秦小明,范秀萍
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东 湛江 524088)
珍珠龙胆石斑鱼(♀Epinephelus fuscoguttatus×♂Epinephelus lanceolatus)是一种生长速度快、抗病力强且养殖产量高的暖水性海水经济鱼类,具有胶原蛋白含量高、肉质纤维细腻等优点[1]。传统珍珠龙胆石斑鱼鲜活运输过程中常因水质恶化、缺氧、振动等不利因素产生应激反应,导致其剧烈挣扎,极易相互扎伤造成死亡[2-4]。提高存活质量已成为珍珠龙胆石斑鱼保活运输的核心关注点。无麻醉剂添加的低温休眠无水保活运输是一种低成本、高存活率、高运载量、品质变化小的绿色安全新型活体流通模式,具有广阔的应用前景[5]。氧化应激和免疫防御失衡是生物体应对环境胁迫时的应答反应,鱼类在不适环境下触发氧化应激,引起免疫系统失衡,甚至造成组织损伤,进而影响保活效果[6-8]。
气调包装是将一种或多种气体充入包装袋中以维持新鲜度与品质,进而延长食品货架期的技术[9],在黑鲷[10]、泥蚶[11]、鲫鱼[12]、海湾扇贝[13]、黄颡鱼[14]、大菱鲆[15]、凡纳滨对虾[16]、花鲈[17]等水产品保活中已得到初步研究,但气体比例研究范围过于宽泛,主要聚焦于纯氧;而珍珠龙胆石斑鱼鲜见气调包装相关的报道。本研究旨在探讨珍珠龙胆石斑鱼在纯氧和气调无水环境下保活运输的存活情况以及应激水平、血清生化指标、物质代谢、抗氧化能力的响应机制,解析珍珠龙胆石斑鱼气调无水保活存活机理,为其气调无水保活运输的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
珍珠龙胆石斑鱼(1 龄,平均体质量(529.8±15.4)g,平均体长(31.65±2.89)cm,购自广东湛江市东风水产品批发市场,加水充氧运输至实验室。挑选大小均匀、体表无损伤、健康无病害的石斑鱼,在暂养池(119 cm×89 cm×32 cm)中暂养24 h用于后续实验。暂养池条件:采用新鲜过滤海水,盐度20‰~24‰、水温18~20 ℃、溶解氧量6.5~8.5 mg/L、pH(7.2±0.5)、鱼密度为85 g/L。
A045-3总蛋白(total protein,TP)、C013-2-1尿素氮(urea nitrogen,BUN)、C012-2-1尿酸(uric acid,UA)、C011-2-1肌酐(creatinine,CREA)、C010-2-1谷草转氨酶(aspartate aminotransferase,AST)、C009-2-1谷丙转氨酶(alanine aminotransferase,ALT)、A110-1-1甘油三酯(triglyceride,TG)、A111-1总胆固醇(total cholestol,TC)、A043-1-1糖原、A019-2-1乳酸、A020-2乳酸脱氢酶(lactate dehydrogenase,LDH)、A060-2酸性磷酸酶(acid phosphatase,ACP)、A059-2碱性磷酸酶(alkaline phosphatase,ALP)、A084-1-1过氧化物酶(peroxidase,POD)、A006-2-1还原型谷胱甘肽(glutathione,GSH)、A003-1丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)、A015-2-1总抗氧化能力(total antioxidant capacity,T-AOC)、A001-3总超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒 南京建成生物工程研究所;鱼皮质醇酶联免疫分析试剂盒江苏酶免实业有限公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司。
1.2 仪器与设备
CK-901冷却机组 深圳祎祎科技有限公司;GXZ-280D智能型光照培养箱 宁波市科技园区新江南仪器有限公司;Cary紫外-可见分光光度计 美国安捷伦科技有限公司;Varioskan Flash全自动酶标仪 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 保活效果气体环境的确定
参照徐德峰等[16]的方法,珍珠龙胆石斑鱼经停食暂养24 h后,采用梯度降温模式[3](20~15 ℃、2 ℃/h,15~10 ℃、1 ℃/h)冷驯化至休眠。将休眠状态的20 尾珍珠龙胆石斑鱼用海绵包裹保持鱼体湿润,迅速放于双层自封袋内,向袋中分别充入纯氧或85%氧气+15%氮气,用橡皮筋扎紧袋口,置于15 ℃培养箱中静态模拟运输,记录存活时长。以放入水环境可恢复至正常游动状态为有效保活,并计算存活率。
1.3.2 实验设计
珍珠龙胆石斑鱼经停食暂养24 h后,挑选60 尾大小均一、行为活动正常、无机械性损伤的珍珠龙胆石斑鱼模拟无水保活运输,将其随机分为10 组,每组6 尾。分别于暂养24 h后直接取样,记为正常对照组(NC组);暂养后按照1.3.1节进行休眠,取样,记为休眠组(DC组);将休眠后鱼体装入自封袋中分别充入纯氧或85%氧气+15%氮气,无水保活2、6、10 h,并在10 h后于室温海水复苏6 h,取样,其中充入85%氧气+15%氮气组记为气调组(AC组),无水保活2、6、10 h以及复苏6 h组分别记为AC 2 h、AC 6 h、AC 10 h、AC 10 h+R 6 h组;以纯氧组(PC组)为对照,参照AC组的分组分别记为PC 2 h、PC 6 h、PC 10 h、PC 10 h+R 6 h组。
1.3.3 血清生化指标的测定
参照刘骁等[18]的方法,用200 mg/L MS-222快速麻醉鱼体,10 mL注射器插入尾静脉取血,全血不加抗凝剂,4 ℃静置2 h,待血液明显分层后以3 000 r/min、4 ℃离心20 min取血清,-80 ℃冻存待测。血清皮质醇含量通过相应试剂盒采用酶联免疫吸附试验法测定;TP、葡萄糖、BUN、UA、CREA、TG、TC、POD、AST、ALT、ACP、ALP水平均采用相应试剂盒进行测定。
1.3.4 肌肉和肝脏物质代谢及抗氧化指标的测定
参照李卢等[19]的方法,取背部肌肉和肝脏,用预冷至4 ℃的无菌生理盐水洗净表面血迹并用滤纸吸干表面水分,绞碎分装,液氮速冻后于-80 ℃下冻存待测。糖原、乳酸、LDH、GSH、MDA、SOD、T-AOC、CAT水平测定均严格按照相应试剂盒说明书进行。
1.4 数据处理与分析
采用JMP Pro 14.0软件对实验数据进行统计及显著性分析,结果以平均值±标准差表示。在单因素方差分析基础上,结合Tukey检验进行Duncan多重比较,P<0.05表示差异显著。采用Origin Pro 8.5软件绘图。
2 结果与分析
2.1 纯氧与气调环境对珍珠龙胆石斑鱼无水保活过程中存活率的影响
如图1所示,保活过程中无水环境协同低温胁迫下珍珠龙胆石斑鱼陆续死亡。气调组生存时间((13.88±1.00)h)显著长于纯氧组((10.90±0.66)h)。可能由于休眠状态的珍珠龙胆石斑鱼呼吸频率减缓,新陈代谢水平降低,且低温环境能够大大降低机体的耗氧量,只进行微弱呼吸作用即可满足其生理需求;而高浓度氧气增加了氧自由基含量[17],造成鱼体细胞损伤,因此85%氧气环境更有利于珍珠龙胆石斑鱼的无水保活。

图1 纯氧与气调环境对珍珠龙胆石斑鱼无水保活过程中存活率的影响Fig. 1 Effects of pure oxygen and controlled atmosphere environment on survival rate of grouper during waterless live transportation
2.2 气调无水保活过程中珍珠龙胆石斑鱼应激水平的变化
鱼体发生应激反应时生命活动剧烈、新陈代谢旺盛,不仅导致血糖水平变化,还会引起各项激素水平变化。皮质醇作为反应链分泌的最后一种激素,其含量随应激强度的增大而升高,因此皮质醇、血糖水平通常被用作评价鱼类应激反应程度的指示性指标[4,20]。如图2A所示,纯氧组和气调组珍珠龙胆石斑鱼血清皮质醇浓度均先上升后下降,并在保活6 h达到峰值,分别为(154.90±5.26)mmol/L和(147.68±9.49)mmol/L,显著高于其余保活组(P<0.05)。推测原因可能是包装袋中氧气的消耗以及二氧化碳的积累造成生存环境恶化,从而引起鱼体应激,逐渐适应环境后皮质醇含量有所下降。但保活10 h复苏后珍珠龙胆石斑鱼皮质醇浓度仍显著高于NC组,表明应激反应没有完全消除。由图2B可知,与NC组对比,其余组血糖浓度均显著增加(P<0.05)。休眠过程冷应激导致鱼体血糖水平急剧升高,血糖浓度达到(5.45±0.15)mmol/L。保活初期鱼体适应低温及无水环境,体内糖原转化为葡萄糖供给能量维持机体功能运作;随后饥饿胁迫或环境应激导致鱼体代谢活动增强,鱼体所需能量增多,糖原分解加速使血糖浓度增加。复苏阶段鱼体饥饿并不断消耗能量,血糖不断被分解供给机体能量,故其浓度较复苏前显著下降。
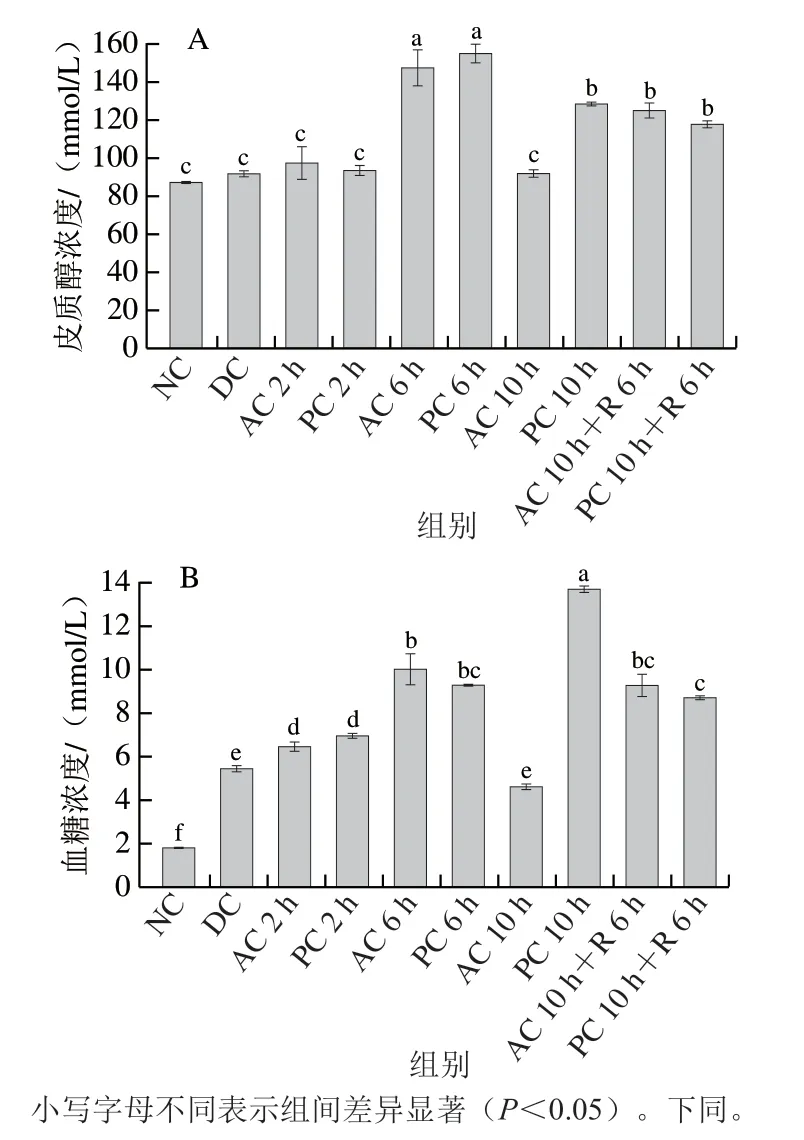
图2 气调无水保活过程中珍珠龙胆石斑鱼应激水平的变化Fig. 2 Changes in stress levels in grouper under modified atmosphere during waterless live transportation
2.3 气调无水保活过程中珍珠龙胆石斑鱼血清生化指标的变化
如表1所示,冷胁迫休眠DC组血清BUN、UA、CREA浓度与NC组无显著差异(P>0.05),随无水保活时间的延长三者含量均呈上升趋势,复苏后有所下降;且纯氧组上升幅度明显高于气调组。冷胁迫休眠DC组AST、ALT活力均较NC组显著上升(P<0.05),无水保活阶段AST、ALT活力均稳步上升,PC 10 h组达到峰值,分别为(262.22±1.54)、(232.05±1.87)U/L,显著高于AC 10 h组(P<0.05)。无水保活过程中ACP活力逐渐上升,且在气调环境中可维持于较高水平。ALP、POD活力随无水保活时间的延长整体呈降低趋势,复苏6 h后均有所上升。TG、TC浓度在保活过程中逐渐降低,且在纯氧和气调环境中变化幅度差异不明显。
低温及无水环境胁迫下,鱼体能量消耗增加,神经激素分泌减少,消化酶活性降低,代谢分泌系统受损,导致鱼类代谢紊乱[21]。BUN、UA、CREA均由肾脏代谢排出,是反映肾功能的重要指标。肾脏损伤引起功能衰竭、炎症时血液BUN水平增加[3]。肾脏功能衰退时UA、CREA水平也会升高[14]。随着无水保活时间的延长,BUN、UA、CREA浓度均呈上升趋势,可能是由于低温及无水环境胁迫下鱼体应激强烈,皮质醇分泌增多刺激血清BUN水平上升,同时鱼体肾脏损伤,发生UA、CREA滤过或渗出障碍,进而造成血清中UA、CREA浓度升高。复苏后鱼体血清BUN、UA、CREA浓度升高有所缓解,但三者浓度均显著高于NC组(P<0.05),这可能是珍珠龙胆石斑鱼无法进行长时间无水运输的原因。此外,气调环境下BUN、UA、CREA浓度的增加幅度明显低于纯氧环境,说明气调环境可减缓珍珠龙胆石斑鱼肾脏损伤的程度。
AST、ALT是鱼类重要的转氨酶,主要存在于肝脏和心肌细胞中,血清中含量极低;当肝细胞受损时,AST和ALT被释放到血液中,因此血清AST和ALT活力的增加被认为是评价肝功能损伤最具特异性和广泛使用的指标[22]。冷胁迫下,AST、ALT活力较NC组显著上升(P<0.05),鱼体肝细胞受到一定程度损伤。随着无水保活的进行,AST、ALT活力均稳步上升,复苏6 h后两者活力有所下降,但仍处于较高水平。这可能是长时间处于低温无水环境,机体代谢逐渐以无氧呼吸为主,体内抗氧化系统失衡,导致珍珠龙胆石斑鱼肝脏出现不可逆损伤。且PC 10 h组AST、ALT活力显著高于AC 10 h组(P<0.05),说明纯氧环境鱼体肝脏受损较严重,这可能是导致纯氧环境无水保活时间较短的主要原因。
溶酶体可通过水解细菌细胞壁组分清除细菌,因此常用作指示水生生物功能防御和健康状况的标志物。溶酶体膜通透性降低会释放ALP、ACP等酶类,ALP和ACP可直接参与鱼体中磷酸基团的转移及钙磷代谢,还能够改变病原体的表面结构以增强机体对病原体的识别和吞噬能力[23-24]。POD是免疫相关酶,可将超氧自由基转化为无毒的水和氧,以避免细胞损伤,POD水平可间接反映机体免疫水平[25]。无水保活过程中ACP活力逐渐升高,且在气调环境下维持在较高水平,这是由于生存环境胁迫刺激珍珠龙胆石斑鱼免疫应答,引起ACP活力增强,进而增强机体免疫防御能力。ALP、POD活力随无水保活时间的延长而降低,复苏6 h后有所上升,表明低温无水环境胁迫下鱼体机体代谢活动下降或免疫能力降低,复苏6 h并不能使鱼体恢复正常的代谢和免疫能力。
TG和TC是动物细胞储藏脂质的主要形式,也是细胞膜的重要组成部分[26]。无水保活过程中,血清TG、TC浓度下降的原因有两方面:一是未进食条件下鱼体内能量物质的消耗;二是生存环境胁迫下肝脏损伤阻碍了肠-肝循环的正常运行。复苏阶段TG、TC浓度较复苏前显著上升(P<0.05),可能是水体环境使鱼体恢复活力状态,TG通过肠-肝循环被肝脏重吸收导致。

表1 气调无水保活过程中珍珠龙胆石斑鱼血清生化指标的变化Table 1 Changes in serum biochemical indexes of grouper under modified atmosphere during waterless live transportation
2.4 气调无水保活过程中珍珠龙胆石斑鱼物质代谢的变化
鱼体在逆境条件机体应激,能量消耗增加,导致能量代谢酶活性和代谢模式改变,从而引起机体内呼吸与能量代谢变化以维持稳态[2]。糖原主要存在于肌肉和肝脏中,是重要的能量来源,可作为反映动物生命代谢能力的重要指标。由图3A、B可知,冷胁迫休眠下DC组肌糖原、肝糖原含量分别较NC组显著下降了17.65%、27.34%(P<0.05)。推测原因是冷胁迫导致皮质醇释放,加快糖原分解,以满足机体快速代谢需求,导致糖原含量显著下降。随着无水保活时间的延长,糖原含量进一步降低,且纯氧环境下降幅度大于气调环境,这可能是饥饿或环境胁迫导致鱼体代谢活动增强,促进能量消耗,使鱼体糖原进一步分解,复苏后鱼体游动正常消耗能量。表明气调环境下珍珠龙胆石斑鱼对环境的适应能力明显优于纯氧环境下,与张玉晗等[17]研究结果基本一致。
乳酸是反映生物体能量代谢水平的重要指标[18],作为糖原酵解的代谢产物,短时蓄积会阻碍ATP合成,降低机体运动能力,其含量与肌糖原含量呈负相关[19,27]。低温休眠DC组肌肉、肝脏乳酸含量显著高于NC组(P<0.05),表明此时机体有氧代谢水平降低,无氧代谢水平升高。随着无水保活时间的延长,乳酸含量明显增加,复苏后鱼体进行正常呼吸,血清乳酸含量恢复到正常水平。无水保活10 h纯氧环境乳酸积累量显著高于气调环境(P<0.05),乳酸积累阻碍了ATP的合成,造成代谢紊乱,从而对鱼体造成一定程度损伤,这也可能是气调环境保活时长高于纯氧环境的重要原因。
LDH在糖代谢中催化丙酮酸无氧代谢生成乳酸,其活性主要取决于机体细胞内氧分压[28]。如图3E所示,肌肉LDH活力呈波动变化,其余组与NC组对比LDH活力均有所上升,可能是细胞内氧分压降低时,LDH合成加快,导致其活力增强。如图3F所示,肝脏LDH活力随保活时间的延长而显著上升(P<0.05),表明保活过程中氧气充足,但鱼体细胞内氧气与血红蛋白的结合受到影响,鱼体主要以无氧代谢供能。各保活阶段气调环境中LDH活力明显低于纯氧环境,进一步验证了气调环境更有利于珍珠龙胆石斑鱼的无水保活。
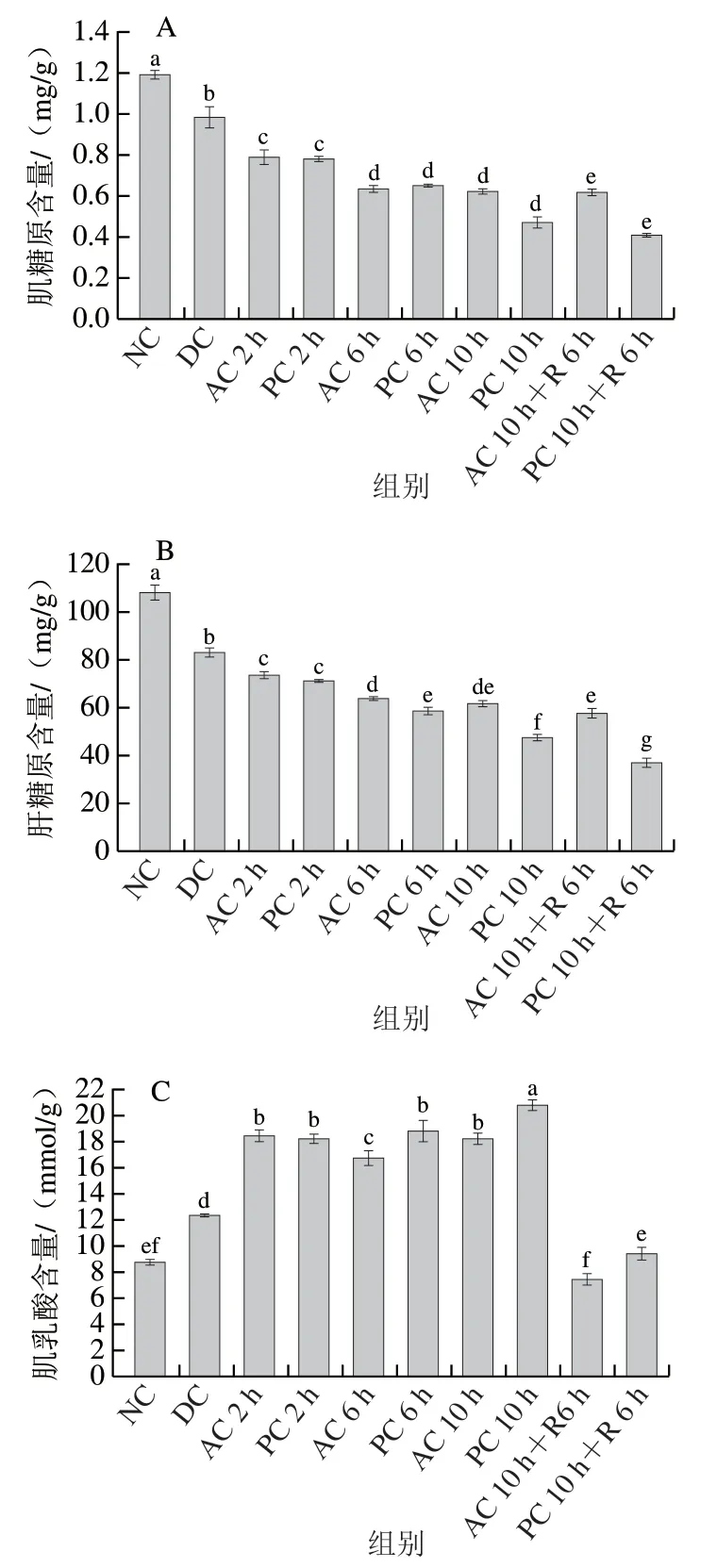

图3 气调无水保活过程中珍珠龙胆石斑鱼肌肉和肝脏糖原含量(A、B)、乳酸含量(C、D)、LDH活力(E、F)的变化Fig. 3 Changes in glycogen content (A, B), lactic acid content (C, D)and LDH activity (E, F) in muscle and liver of grouper under modified atmosphere during waterless live transportation
2.5 气调无水保活过程中珍珠龙胆石斑鱼抗氧化能力的变化
低温协同无水环境胁迫过程中鱼体产生氧化应激引发体内自由基异常增多,该过程体内活性氧会不断积累进而诱发脂质过氧化[2]。MDA是脂质过氧化的重要产物之一,其可破坏组织细胞膜的流动性、通透性和完整性,使鱼体肝脏细胞膜系统、渗透压调节等功能出现故障,甚至导致鱼体死亡[29]。如图4A、B所示,无水胁迫过程中,MDA含量呈上升趋势,且各实验组均显著高于NC组(P<0.05),可能是由于抗氧化酶受到抑制,清除自由基能力有限,致使MDA含量上升。肌肉、肝脏中MDA含量在纯氧环境无水保活10 h时达到峰值,分别为(7.98±0.05)、(32.97±0.30)nmol/mg,显著高于气调组(P<0.05),说明高氧环境下珍珠龙胆石斑鱼肌肉和肝脏氧化应激损伤较为严重。复苏阶段MDA含量显著下降,可能是由于抗氧化系统被激活,过多的MDA被清除从而维护体内氧化-抗氧化系统的平衡。
环境胁迫下鱼类产生大量氧自由基造成氧化胁迫,机体内抗氧化酶基因转录水平随之升高,抗氧化酶活力增强,以清除氧自由基,保护机体免受胁迫损伤[2]。CAT、SOD活力、T-AOC和GSH含量均可反映机体的氧化防御机能[17,30]。如图4C~J所示,肌肉CAT活力随保活时间的延长显著增加(P<0.05),肌肉SOD活力、T-AOC、GSH含量有所上升,复苏后均显著下降。冷胁迫休眠下肝脏CAT、T-AOC、SOD水平均与NC组无显著差异(P>0.05),GSH含量显著高于NC组(P<0.05)。随着低温无水环境胁迫时间的延长,肝脏CAT、SOD、T-AOC、GSH水平均呈逐步上升趋势,且纯氧环境中上升幅度明显高于气调环境,PC 10 h组4 项指标均达到最大值。这可能是低温胁迫无水保活应激刺激鱼体产生氧自由基,导致机体抗氧化系统激活,抗氧化酶活性增强以减轻运输应激对机体的损伤;高氧导致鱼体产生过多的氧自由基,抗氧化酶处于抗逆性较强的水平,具体机制有待后续研究。复苏6 h后,由于鱼体通过自身调节抗氧化系统基本恢复至正常水平,提示珍珠龙胆石斑鱼可通过提升体内抗氧化酶活性以抵抗氧化损伤。过高的氧气浓度会导致鱼体出现过多的氧自由基,细胞内自由基不能被及时清除,攻击生物细胞中蛋白质、脂肪和核酸等,为抵御攻击机体抗氧化防御体系受到激发,引起抗氧化酶活力的变化[17]。


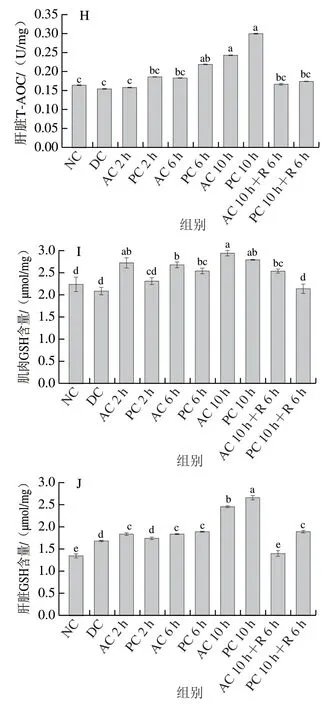
图4 气调无水保活过程中珍珠龙胆石斑鱼肌肉和肝脏MDA含量(A、B)、CAT活力(C、D)、SOD活力(E、F)、T-AOC(G、H)、GSH含量(I、J)的变化Fig. 4 Changes in levels of MDA (A, B), CAT (C, D), SOD (E, F),T-AOC (G, H) and GSH (I, J) in muscle and liver of grouper under modified atmosphere during waterless live transportation
3 结 论
气调环境下珍珠龙胆石斑鱼无水保活时间为(13.88±1.00)h,显著长于纯氧环境。血清皮质醇浓度均呈先上升后下降的趋势。与NC组对比,保活过程中其余各组血糖浓度均显著增加(P<0.05)。BUN、UA、CREA浓度在冷胁迫休眠下与NC组无显著差异(P>0.05),随无水保活时间的延长,三者浓度均呈上升趋势,复苏6 h后有所下降;且纯氧环境上升幅度明显高于气调环境。无水保活阶段AST、ALT、ACP活力均稳步上升,ALP、POD活力随胁迫时间的延长降低,复水6 h后均有所上升。TG、TC含浓度在保活过程中逐步降低,且在纯氧和气调环境中变化趋势无明显差异。随着无水保活时间的延长,肌糖原、肝糖原含量逐步减少,且纯氧环境下降幅度高于气调环境。肌肉、肝脏乳酸含量随着无水保活时间的延长而明显增加,复苏后恢复至正常水平。各保活阶段气调环境中肝脏LDH活力均显著低于纯氧环境(P<0.05)。无水胁迫过程中肌肉和肝脏MDA含量呈上升趋势,均显著高于NC组(P<0.05)。肌肉中CAT活力随保活时间的延长显著增加(P<0.05),SOD、T-AOC、GSH水平有所上升,复苏后均显著下降。冷胁迫休眠下肝脏CAT、SOD活力、T-AOC均随低温无水环境胁迫时间的延长呈逐步上升趋势,且纯氧环境中上升幅度明显高于气调环境。综上,低温无水胁迫下珍珠龙胆石斑鱼触发应激反应,造成氧化应激和免疫系统失衡,组织器官出现不可逆损伤;相比较于纯氧环境,气调环境可有效减轻无水保活过程中珍珠龙胆石斑鱼肾脏、肝脏的氧化应激损伤程度,机体能量物质代谢、抗氧化系统及免疫防御系统调控能力较强,可在低温无水胁迫环境下较好地维持机体正常生理代谢,更有利于珍珠龙胆石斑鱼的无水保活。
