贝莱斯芽孢杆菌菌剂对花生白绢病的田间防效及作用机理研究
2022-11-29潘梦诗郭文阳周留柱邓丽苗建利徐宏光张宗源亓兰达
潘梦诗,郭文阳,周留柱,邓丽,苗建利,徐宏光,张宗源,亓兰达*
(1.河南省科学院生物研究所,郑州 450008;2.开封市农林科学研究院,河南 开封 475004)
花生(Arachis hypogaeaLinn.)是一年生豆科草本植物,是我国食用植物油的重要来源和休闲食品。随着花生种植规模的扩大,气候变化、不合理的耕作模式等导致花生病害愈发严重[1]。其中,白绢病作为一种土传真菌病害,在世界花生主产区普遍发生,在中国近年来发生日益猖獗,分布区域逐年扩大;主要危害植株根茎、果柄及荚果,造成根茎褐腐、荚果腐烂,严重影响了花生的产量和品质,造成巨大的经济损失[2-3]。
花生白绢病病原菌(Sclerotium rolfsii)为半知菌亚门无孢菌目齐整小菌核属,该菌产生的菌核可在土壤中存活多年,造成土传病害,且防治困难。目前多采用化学药剂进行防治,如戊唑醇、五氯硝基苯、噻呋酰胺等,但化学药剂的长期使用易导致白绢病菌产生抗药性,且不符合绿色、安全、环保的防治理念[3]。生物防治是花生白绢病绿色防控的有效手段。研究发现,假单胞菌(Pseudomonas)[4]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[5]、链霉菌(Streptomyces)[6]等均可抑制花生白绢病病原菌的生长,破坏其菌丝结构,抑制菌核形成,对花生白绢病具有一定的防治效果。
本研究团队在前期拮抗试验中筛选出一株贝莱斯芽孢杆菌(Bacillus velezensis),对花生白绢病病原菌具有良好的拮抗效果[7]。因此,本研究以该菌株为供试菌,制备生防菌剂,开展花生白绢病防治的田间试验,拟为花生白绢病生防菌剂的研发和应用提供理论依据,推动花生产业的绿色健康发展。
1 材料与方法
1.1 试验材料和供试菌剂
供试花生品种为“鲁花14”,由山东省花生研究所选育,属于连续开花亚种中间型,为花生白绢病易感品种。
贝莱斯芽孢杆菌BS-1菌株由本实验室从花生根际土壤中分离纯化获得,保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC 20662。贝莱斯芽孢杆菌经LB培养基活化12~16 h后获得种子液,利用产孢优化后的发酵培养基进行2次发酵后获得生防菌剂。田间试验菌剂芽孢数量为108cfu·mL-1。
1.2 试验区域
试验地点位于河南省开封市尉氏县鸡王村(36°19′N,111°49′E),供试土壤为沙土,地势平整,水肥条件良好,常年种植花生,重茬导致花生白绢病发病严重,为花生白绢病病害地。
1.3 试验设计
试验共设4个处理,包括清水处理(CK)、噻呋酰胺化学药剂阳性处理(YX)、菌剂拌土处理(BT)和菌剂叶面喷施处理(PS),YX处理的药剂及BT、PS处理的菌剂施用量均为500 L·hm-2。其中,BT处理为播种前翻土后进行菌剂拌土处理,YX和PS处理为花生出苗后1周进行叶面喷施处理。每个处理3个重复,共12个小区,各小区采用完全随机排列的方式,小区之间设置保护行分隔,每个小区面积为20 m2(12.5 m×1.6 m)。2021年6月初播种,常规田间管理,同年9月中旬收获。
1.4 测定方法
1.4.1 花生生长指标测定利用5点采样法在试验区内采集1 m×1 m样方的花生植株,带回实验室进行花生生长指标的测定,包括株高、整株鲜重;收集花生果实,计算单株结果数;将花生果实自然风干,去壳后测定百仁重。观察植株茎基部,统计花生病情指数。花生病情指数的评价分级主要观察花生茎基部病斑数,标准如下:0级,无病斑;1级,1~3个病斑;3级,病斑较多,面积占茎和根的1/4~1/3;5级,病斑面积占茎和根的1/2~3/4;7级,病斑成片,有烧茎现象,根部坏死。

1.4.2 根际土采集和处理于花生收获时,小心地拔起花生根系,并去除根部大颗粒土块,然后抖动花生根部收集根际土壤,低温运输至实验室,-80℃保存,用于土壤微生物多样性分析。
1.4.3 微生物多样性分析利用FastDNA Spin Kit for soil DNA抽提试剂盒(MP Biomedicals,美国)提取采集根际土壤基因组总DNA,DNA含量高于20 ng·mL-1且OD260/280为1.8~2.0视 为 合 格DNA。合格的DNA置于-80℃保存,用于PCR扩增。
细菌的16S rDNA基因的扩增引物采用338 F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806 R(5’-GGACTACHVGGGTWTCTAAT-3’),扩增真菌的ITS基因的引物采用ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)。采用Illumina Miseq 2×300测序平台对PCR产物进行双端测序,由上海美吉生物医药科技有限公司完成。测序完成后,使用软件根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类并剔除嵌合体。将优化后的序列进行OTU聚类分析,对OTU进行多样性指数分析及各个分类水平上的群落结构分析。
1.4.4 花生根系防御酶活性的测定将花生植株的根系用自来水冲洗干净,去除土粒,小心用纸吸干根系表面的水分,收集所有的须根装入自封袋中,于-80℃保存,用于植株防御酶活性的测定。苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)均采用相应的植物用酶活试剂盒进行测定(南京建成生物工程研究所)。
1.5 数据处理
采用Excel 2016和SPSS 20.0软件进行数据统计和分析。
2 结果与分析
2.1 贝莱斯芽孢杆菌菌剂对花生生长指标的影响
株高和植株鲜重是花生重要的农艺性状,如表1所示,与CK相比,处理组花生的株高都有所降低,植株鲜重有所增加,但组间差异均不显著。有效结果数和百仁重是影响花生产量的重要指标,经药剂处理后花生的单株结果数和百仁重在一定程度上均有所提高,其中,BT处理花生的单株结果数最高,可达12.91;PS处理花生的百仁重最大,为69.41 g,但组间差异仍未达到显著水平。这说明使用微生物菌剂后可以一定程度上提高花生产量。
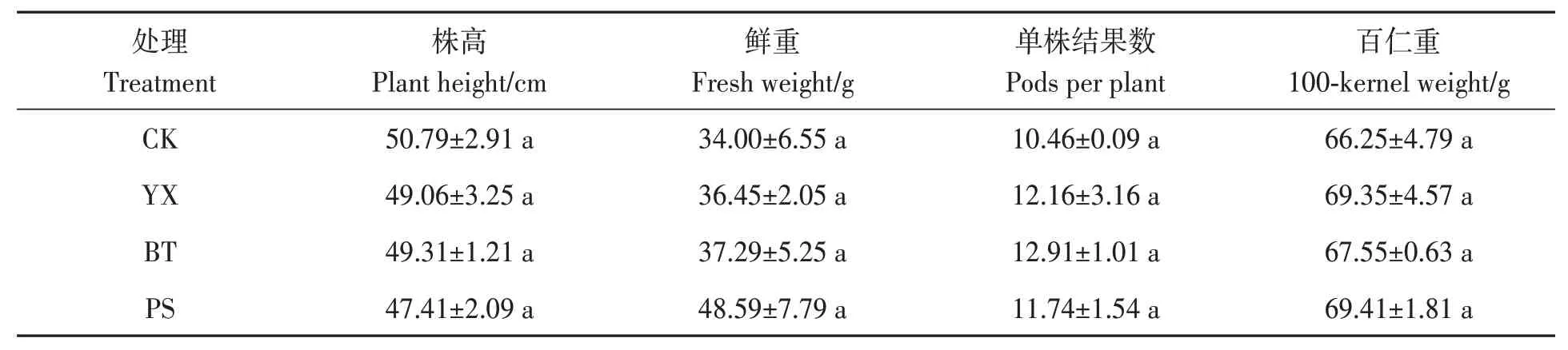
表1 不同处理下花生的生长指标Table 1 Growth indexs of peanut under different treatments
2.2 贝莱斯芽孢杆菌菌剂对花生病害指数和产量的影响
花生白绢病作为花生常见的土传病害可阻碍花生的生长,导致花生减产,严重时造成巨大的经济损失。从表2可以看出,CK处理的病情指数为4.13,花生主茎可见褐色病斑,部分出现根腐,植株受花生白绢病病原菌侵害严重;YX、BT和PS处理均可降低花生的病情指数,其中,YX处理的病情指数显著低于CK(P<0.05),防治效果最好,防效为25.92%;BT处理次之,防效为18.82%。综合考虑花生出仁率、种植密度等因素计算花生产量,YX处理花生的产量最高,较CK增产26.66%;BT处理的增产效果优于PS处理。结果表明,贝莱斯芽孢杆菌菌剂可抑制花生白绢病的发生,降低病情指数,提高花生的产量,其中菌剂拌土处理优于菌剂喷施处理。化学药剂处理降低花生病害的效果最显著,但增产效果与菌剂拌土处理相似,说明微生物菌剂可有效防治病害,不影响花生的生长。

表2 不同处理下花生的病情指数和产量Table2 Disease index and yield of peanut under different treatments
2.3 贝莱斯芽孢杆菌菌剂对微生物多样性的影响
2.3.1 对土壤真菌群落多样性的影响在97%相似水平上对土壤真菌群落进行Alpha多样性分析,包括Shannon、Simpson、ACE和Chao 1指数,其中,Shannon和Simpson指数为物种多样性指数;ACE和Chao 1指数为物种丰富度指数。Shannon指数越大,Simpson指数越小,说明物种多样性越高;ACE和Chao 1指数越大,说明物种数量越多[8]。从表3可以看出,真菌群落多样性指数表现为BT>YX>PS>CK。与CK相 比,BT处 理 的Shannon指数显著升高,Simple指数显著降低,说明菌剂拌土后花生根际土壤真菌群落多样性显著升高(P<0.05);YX和PS处理也提高了花生根际土壤真菌群落的多样性,但与CK差异不显著。由Ace和Chao 1指数可知,3种处理均可一定程度上增加土壤真菌群落的丰富度。由此表明,微生物菌剂处理可影响花生根际土壤真菌群落多样性。

表3 不同处理下土壤真菌群落的多样性Table3 Diversity of soil fungi community under different treatments
2.3.2 对土壤细菌群落多样性的影响 不同处理对土壤细菌群落多样性的影响如表4所示,各处理对花生根际土壤细菌群落的多样性无显著影响。与CK相比,各处理土壤细菌群落的多样性和丰富度略有降低。
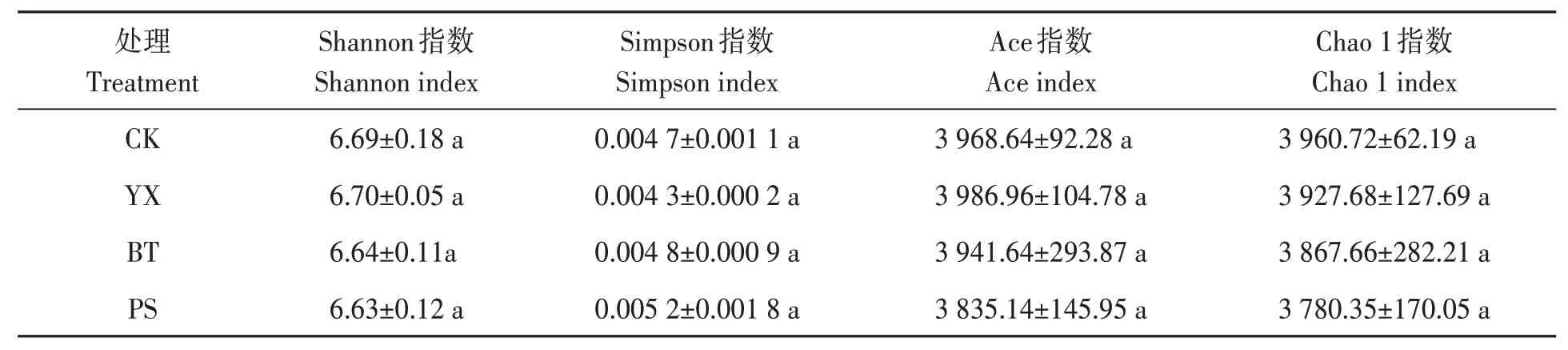
表4 不同处理下土壤细菌群落的多样性Table 4 Diversity of soil bacterial community under different treatments
2.3.3 对土壤真菌群落结构组成的影响在门水平上对OUT进行聚类分析(图1),各处理花生根际土壤真菌的优势菌门(相对丰度>1%的门)均为子囊菌门(Ascomycota)、丝孢菌门(Mortierellomycota)、unclassified_k_Fungi、担子菌门(Basidiomycota)和壶菌门(Chytridiomycota),其中子囊菌门的占比最高,为85.32%~88.02%,与其他一些农田土壤生态系统的研究结果一致[9]。处理组均降低了子囊菌门的相对丰度,提高了丝孢菌门的相对丰度。与CK相比,BT处理提高了担子菌门的相对丰度,降低了壶菌门的相对丰度。这说明微生物菌剂处理可影响花生根际土壤真菌的群落结构。

图1 不同处理土壤真菌门水平群落组成Fig.1 Fungi community composition of soil at phylum level under different treatments
2.3.4 对土壤细菌群落结构组成的影响 如图2所示,各处理在门水平上的细菌群落结构组成大体相同,但丰度不同,花生根际土壤细菌的优势菌门为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)和粘球菌门(Myxococcota),相对丰度分别为22.7%~24.2%、18.3%~21.5%、13.0%~15.6%、10.9%~15.8%、10.3%~13.3%和4.3%~4.7%,其他菌门比例相对较低。较CK相比,BT处理降低了变形菌门和厚壁菌门的相对丰度,提高了酸杆菌门和绿弯菌门的相对丰度。其中酸杆菌门作为一类新划分出的细菌类群,能够降解复杂的木质素与纤维素,进而提高土壤养分[10]。

图2 不同处理土壤细菌门水平群落组成Fig.2 Bacterial community composition of soil at phylum level under different treatments
2.4 贝莱斯芽孢杆菌菌剂对植株防御酶活性的影响
苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)是植物体内重要的防御酶,参与植物体内抗性物质如酚类、木质素、植保素等的生物合成,可清除活性氧,抵御活性氧和自由基对植物细胞膜系统的损伤,增强植物对病虫害的抵抗能力[11]。不同处理对花生根系防御酶活性的影响如表5所示,PS处理组的PAL酶活较CK组显著提高(P<0.05),但各处理组花生根系的PPO酶和POD的活性并无显著差别(P>0.05)。总体来说,微生物菌剂处理对植物的抗性提高并无明显作用。
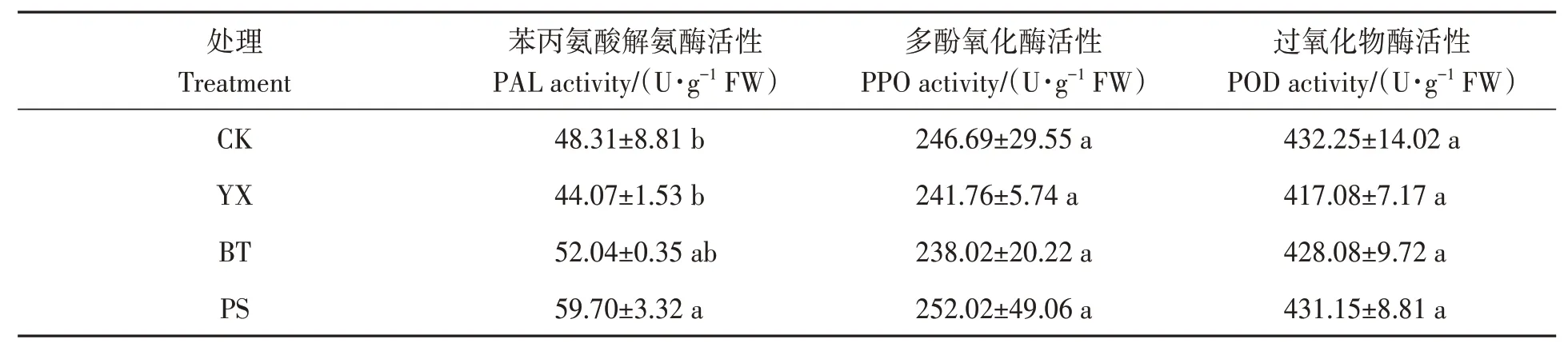
表5 不同处理下的花生的防御酶活性Table 5 Defense enzyme activities of peanut under different treatments
3 讨论
生防菌剂用于植物病害的防治已获得共识[12],其具有可持续、绿色、高效等防治特点,国内外已有多种微生物菌剂的生物农药产品获批,实现了商品化[13]。生防菌的初筛一般在实验室条件下进行,但有些实验室条件下的有效生防菌一旦投入田间应用,其防治效果并不理想,这与生防菌的定植、土壤理化性状、外界环境等因素有关[14]。因此,积极开展田间试验验证生防菌剂的防治效果,对微生物农药的开发和利用具有重要的指导意义。本研究以前期筛选到的抗花生白绢病生防菌——贝莱斯芽孢杆菌为供试菌,开展了微生物菌剂的田间试验,研究表明,贝莱斯芽孢杆菌菌剂可降低花生白绢病害的发生,增加花生的结果数和百仁重,从而提高花生产量,呈现良好的应用前景;且菌剂拌土处理优于菌剂喷洒处理,这可能与菌剂的有效定植和较低的外界环境影响有关。生防菌剂的生防效果及其商业化应用需要进行长期多地的大田试验,同时应考虑生防菌与作物品种特性的关系。因此,应继续探究贝莱斯芽孢杆菌菌剂对更多花生品种的长期生防效果,以期为花生白绢病的生物防治提供坚实的理论基础。
探究微生物菌剂的生防机制,了解其作用机理,可为菌剂的高效利用提供科学依据。生防菌对植物病害的防治机制主要包括以下几个方面:通过空间定植和营养竞争,抢占资源,优化土壤微生物群落结构[15];固氮溶磷,促进植株生长,增强相关防御酶活性,诱导植物抗性[16];产生水解酶、嗜铁素、脂肽等次级代谢产物,发挥拮抗作用[17]。生物防治机制是个复杂的过程,可能是一种作用机制起作用也可能是多种作用机制共同作用,从而直接、间接或协同促进植物生长。本研究发现,贝莱斯芽孢杆菌菌剂处理可一定程度上提高花生根系土壤真菌群落多样性,影响真菌群落结构,但对细菌群落多样性和结构无显著影响。生防菌对土壤微生物菌群的影响与其使用量、土壤类型、作物生长阶段等有关[18]。本研究是少次接种后短时间的数据结果,后续应考虑研究长期、重复性接种微生物菌剂对微生物菌群与植株的影响。对植株防御酶活性进行测定,结果表明,与CK相比,微生物菌剂对花生根系的PAL、PPO和POD活性整体上无显著影响,说明微生物菌剂的生防机制与诱导花生产生抗性无显著关系。
贝莱斯芽孢杆菌是芽孢杆菌属的新种,近年来研究热度不断增加,国内外分离得到的贝莱斯芽孢杆菌均在生物防治方面表现出巨大的潜力。贝莱斯芽孢杆菌含有多种脂肽抑菌物质合成基因,其无菌发酵滤液具有广谱抑菌性,可抑制多种植物病原菌的生长[19]。Cozzolinoa等[17]研究发现,贝莱斯芽孢杆菌SL-6能够抑制梨果实灰霉病(Botrytis cinerea),主要取决于其脂肽代谢产物丰原素的产生。Chen等[20]发现,贝莱斯芽孢杆菌FJAT-46737对番茄青枯病(Ralstonia solanacearum)的抑制作用与其产生的脂肽物质丰原素显著相关。本研究发现,微生物菌剂对土壤微生物群落多样性及植株防御酶活有一定影响,但效果不显著,因此初步推断该菌剂的生防机制极有可能与菌体产生的脂肽等抗菌物质有关,这为针对性地进行花生白绢病的生物防治提供了参考。后续将进行花生白绢病菌拮抗物质的分离纯化与验证,为花生生物农药的研发提供理论基础。
