香草兰酚酸类自毒物质降解菌的筛选和鉴定及其抑菌效果
2022-11-29王蓓蓓尚方剑苏兰茜赵少官赵青云
王 洁,王蓓蓓,尚方剑,苏兰茜,赵少官,3,洪 珊,赵青云
(1. 海南大学 热带作物学院,海口 570228; 2. 海南省热带香辛饮料作物遗传改良与品质调控重点实验室,海南 万宁 517533; 3. 河南农业大学 农业资源与环境科学学院,郑州 450000)
香草兰(Vanilla planifoliaAndrews)属多年生藤本热带经济作物, 享有“香料之王”的誉称,是制作各种高端食品和化妆品等的配香原料。香草兰用途广泛,附加值高,除制作香料外,还具健胃、补肾、软化血管、促进脑功能改善等药用价值,在国际市场上供不应求[1]。香草兰经连续多年种植后,其根际土壤中病原真菌尖孢镰刀菌相对丰度增加;其根际土壤中与枯萎病病情指数呈显著负相关的根际促生菌(PGPR)如芽孢杆菌、木霉、慢生根瘤菌等相对丰度显著降低[2−3]。香草兰经连续种植后,香草兰植株生长受抑,土传枯萎病高发,出现连作生物障碍[2−3]。根系分泌物能够影响植物根际微生物群落组成[4]。植株根系分泌的酚酸类物质是引起根系自毒作用的主要物质,其中酚酸类物质的可溶解部分和可逆吸附的组分是与自毒作用直接相关的[5−6]。在连续种植的花生[7]、甜瓜[8]、烟草[9]、黄瓜[10]的根系分泌物中均检测到酚酸类物质,如苯甲酸、水杨酸、对羟基苯甲酸等。酚酸类物质对种子萌发、植株生长具有显著的抑制作用[11]。西瓜根系分泌的酚酸类物质香草酸、水杨酸和对羟基苯甲酸可促进尖孢镰刀菌孢子萌发和菌丝生长[12]。花生根系分泌物中的苯甲酸被单独添加到根际土壤中时增加了花生根际细菌和真菌群落的丰度,降低了真菌与细菌的比例值,增加了病原真菌尖孢镰刀菌的丰度,使花生的根茎腐病的发病率升高[13]。利用有益微生物降解根系分泌的自毒物质,可降低或消除根系化感物质对土壤及植株的不利影响[14]。刘云露[15]从黄连种植园土壤中分离到能够降解阿魏酸的青霉菌(Penicillium daleae),该菌株培养72 h后对阿魏酸的降解率达87.5%。在花生根际土壤中筛选到1株能够降解多种酚酸的恶臭假单胞菌(Pseudomonas putida),经摇瓶培养5 d时,对酚酸类自毒物质如对羟基苯甲酸、肉桂酸、丁香酸、苯甲酸、阿魏酸等的降解率分别为99.85%、17.44%、90.04%、98. 69%、38.89%[16]。孙秀等[17]在黄瓜根际土壤中也筛选到了能够降解肉桂酸的高效菌株,其中,恶臭假单胞菌(Pseudomonas putida)在12 h内对肉桂酸的降解率达到了99.35%;黑曲霉(Aspergillus niger)在72 h内对肉桂酸的降解率达到了99.62%。目前,国内外对关于自毒物质降解菌的研究主要集中在大宗经济作物上,而较少关注热带经济作物,尤其在多年生热带香料饮料作物上鲜有研究报道。
本课题组前期研究表明,苯甲酸、水杨酸和对羟基苯甲酸是香草兰植株根系分泌的主要自毒物质。本研究从香草兰连作园中筛选到了可降解这3种自毒物质的微生物菌株,通过室内模拟实验研究其降解能力及其对病原菌尖孢镰刀菌的抑制作用,并对其进行了16S rRNA及ITS分子鉴定,为在生产上利用有益微生物缓解香草兰连作生物障碍提供理论基础和菌种资源储备。
1 材料与方法
1.1 供试样品材料土壤样品采集:选取海南省万宁市兴隆镇中国热带农业科学院香料饮料研究所香草兰种植园植株,参考XIONG等[2]的方法,采集植株根际土壤,带回实验室4 ℃冰箱保存备用。
供试病原菌:香草兰枯萎病致病菌尖孢镰刀菌 (Fusarium oxysporumsp. vanillae)由中国热带农业科学院香料饮料研究所植物保护研究室提供。
标准品:苯甲酸、水杨酸、对羟基苯甲酸均购自上海源叶生物有限公司。
1.2 培养基马铃薯葡萄糖培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,琼脂粉20 g,pH 7.0, 115 ℃高压蒸汽灭菌30 min,备用。
LB培养基:酵母膏5 g,蛋白胨10 g,氯化钠5 g,琼脂粉20 g,蒸馏水1 000 mL,pH 7.0,121 ℃高压蒸汽灭菌20 min,备用。
无机盐培养基:NH4NO31.0 g;MgSO4·7H2O 0.5 g;(NH4)2SO40.5 g;KH2PO40.5 g; NaCl 0.5 g;K2HPO41.5 g,蒸馏水1 000 mL;pH 7.0;121 ℃灭菌20 min,备用。
1.3 香草兰根际土壤拮抗真菌、细菌分离纯化称取5 g香草兰根际土壤,参照王辉等[18]的方法制备土壤悬浊液,置于28 ℃摇床振荡30 min,静置30 min,取土壤悬浊液上清液。对土壤悬浊液上清液进行梯度稀释,取10−3、10−4和10−5稀释液,分别吸取100 μL,涂布至PDA培养皿上;取10−4、10−5和10−6稀释液分别吸取100 μL,涂布至LB培养皿上。置28 ℃培养箱中培养。待长出明显菌落后,观察菌落形态,分别挑选不同形态、颜色的单菌落至PDA和LB培养皿中进行纯化。连续纯化5次后挑取单菌落接种至PDA、LB培养基斜面,4 ℃冰箱保存备用。
1.4 酚酸类物质降解率测定
1.4.1 菌悬液制备真菌菌悬液制备:取保存的真菌斜面,活化后挑取菌丝块,接种至PDA培养皿中培养3~5 d,用接种铲刮取菌丝块,转移至装有玻璃珠的无机盐液体培养基中,180 r· min−1摇床振荡30 min,制得孢子悬液,调节孢子密度至107cfu·mL−1,备用。细菌菌悬液制备:取保存的细菌斜面,将菌落接种至LB液体培养基中,置恒温摇床160 r·min−1振荡培养18~20 h,菌液经8 500 r·min−1离心10 min,倒掉上清液,收集菌体,用无菌水重悬,备用,
1.4.2 酚酸类物质降解率测定取上述已制备的菌悬液2 mL,接种至100 mL含2.0 mmol· L−1酚酸无机盐液体培养基中,160 r·min−130 ℃摇床振荡培养,分别于 0、12、24、36、48、60、72 h取真菌、细菌酚酸降解液,以无菌水为空白对照,采用紫外分光光度计法测定酚酸含量,根据标准曲线计算酚酸浓度。
标准曲线:称取对羟基苯甲酸和苯甲酸0、25、50、75、100 mg,水 杨酸0、50、100、150、200 mg,定容至100 mL,测量OD280吸光度,并制作标准曲线,得到对羟基苯甲酸的标准曲线y=0.086 2x− 3.449 1,R2= 0.999 4;得到苯甲酸的标准曲线y= 0.300 3x− 0.586 2,R2= 0.999 2;得到水杨酸的标准曲线y= 0.224 3x− 0.592 1,R2= 0.999 4。
降解率(DR) =(Cck-Ct)/Cck×100%,
式中,Cck为对照中酚酸剩余量,Ct为处理中酚酸剩余量。
1.5 自毒物质降解模拟实验取100 g香草兰连作土壤(过2 mm筛,土壤含水量20%)加入到250 mL三角瓶中。在三角瓶中按照10%的比例加入各供试降解菌的菌悬液,调整各处理最终的土壤含水量为40%。每处理设置9次重复,以无菌水为对照,用封口膜覆盖三角瓶口,在培养箱中30 ℃避光培养7 d,分别于处理后3 、5 、7 d取样,并测定土壤中自毒物质含量。参考LI等[19]的方法萃取土壤中酚酸物质,采用高效液相色谱法定量分析土壤中酚酸含量变化。
1.6 酚酸类物质降解菌对病原菌尖孢镰刀菌的抑制作用测定参照ZHAO等[20]的方法检测可降解酚酸类物质菌株对病原菌尖孢镰刀菌的抑制能力。用接种铲挑取病原菌尖孢镰刀菌菌丝块,置于PDA培养皿培养5 d,用打孔器在病原菌边缘打取圆形菌丝块,置于新的PDA培养皿中。用接种针从培养皿上挑取已活化的待测细菌,用打孔器打取已活化的待测真菌,分别置于距离病原菌菌丝块2 cm处,以只接种病原菌的培养皿为对照,置28 ℃培养箱培养 3~5 d。对病原菌的抑制作用采用抑制率表示。
抑菌率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。
1.7 酚酸类自毒物质降解菌的分子鉴定采用DNA离心柱型试剂盒(上海派森诺生物技术有限公司)提取降解菌株DNA,以总DNA为模板,以细菌特异性引物对338F(5′-AATGATACGGCGA CCACCGAG-3′)和806R(5′-GGACTACNVGGGT WTCTAAT-3′)[21]及真菌特异性引物ITS1F(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS2(5′-TCC TCCGCTTATTGATATGC-3′)[22]对DNA 的内转录间隔区进行PCR扩增。反应体系共25 μL:2.5 μL 10×反应 缓冲 液,10 μmol·L−1每种 引物,2.5 mmol·L−1dNTP,40 ng模 板 和0.625单 位 的Takara Pyrobest(日 本Takara生 物 技 术 有 限 公司)。扩增在以下温度范围内进行:在94 °C初始变性4 min,然后进行35个变性循环,94 °C持续30 s,50 ℃退火持续45 s,72 °C延伸持续1 min,最后在72 ℃延伸7 min[23]。使用PCR Purification Kit(Axygen Bio,USA)对PCR产物进行纯化[24]。ITS和16S rRNA测序工作由上海派森诺生物技术有限公司完成。根据测序结果,利用Genbank中的BLAST软件对获得的ITS和16S rRNA序列进行同源性分析,用MEGA7.0软件进行系统发育分析,采用Neighbor-joining算法和 JukesCantor模型构建系统发育树,自展次数设定为1 000。
1.8 数据分析采用软件SPSS 22.0对数据进行方差分析;采用软件Microsoft Excel 2010 进行数据处理和图表绘制。
2 结果与分析
2.1 酚酸类自毒物质降解菌的筛选依据菌落形态特征差异,从香草兰种植园根际土壤中分离挑选出31株真菌、84株细菌。通过紫外分光光度法筛选出6株可降解苯甲酸、水杨酸和对羟基苯甲酸的菌株,分别是BM-5、FD-21、BD-8、ZD-4、ZH-19和ZH-20。由图1可知在摇瓶培养72 h后,降解菌ZH-20、FD-21和BD-8均对对羟基苯甲酸的降解率超过89%;ZH-19、ZD-4均超过87%;而BM-5达到78.46%。由图2可知,在摇瓶培养72 h后,降解菌BM-5、FD-21、ZD-4、ZH-19和ZH-20对苯甲酸的降解率超过70%。由图3可知,在摇瓶培养72 h后,FD-21、BM-5对水杨酸的降解率超过了90%,分别为93.62%和92.56%;ZD-4、BD-8、ZH-19、ZH-20对水杨酸的降解率分别为39.06%、16.91%、6.44%、4.64%。由此可知,这6株菌均可降解酚酸类物质苯甲酸、水杨酸和对羟基苯甲酸,其中,在摇瓶培养条件下ZH-20对对羟基苯甲酸的降解能力较强,FD-21对苯甲酸和水杨酸的降解能力均较强。
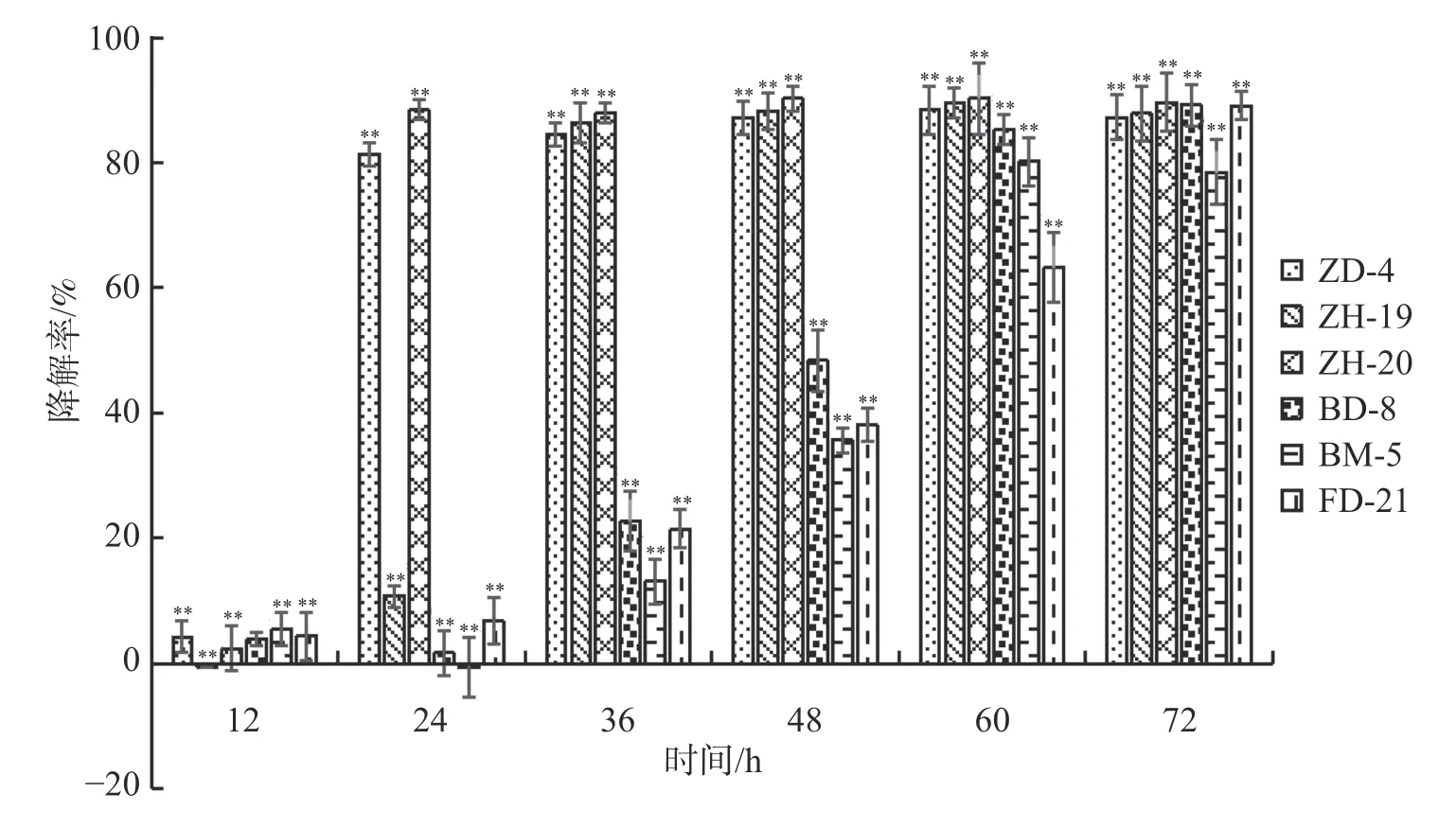
图1 6株降解菌降解对羟基苯甲酸的能力
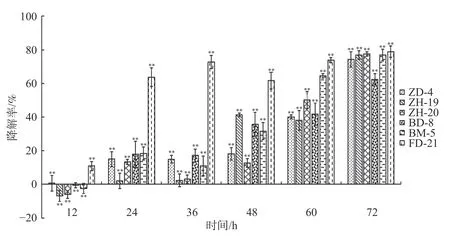
图2 6株降解菌降解苯甲酸的能力
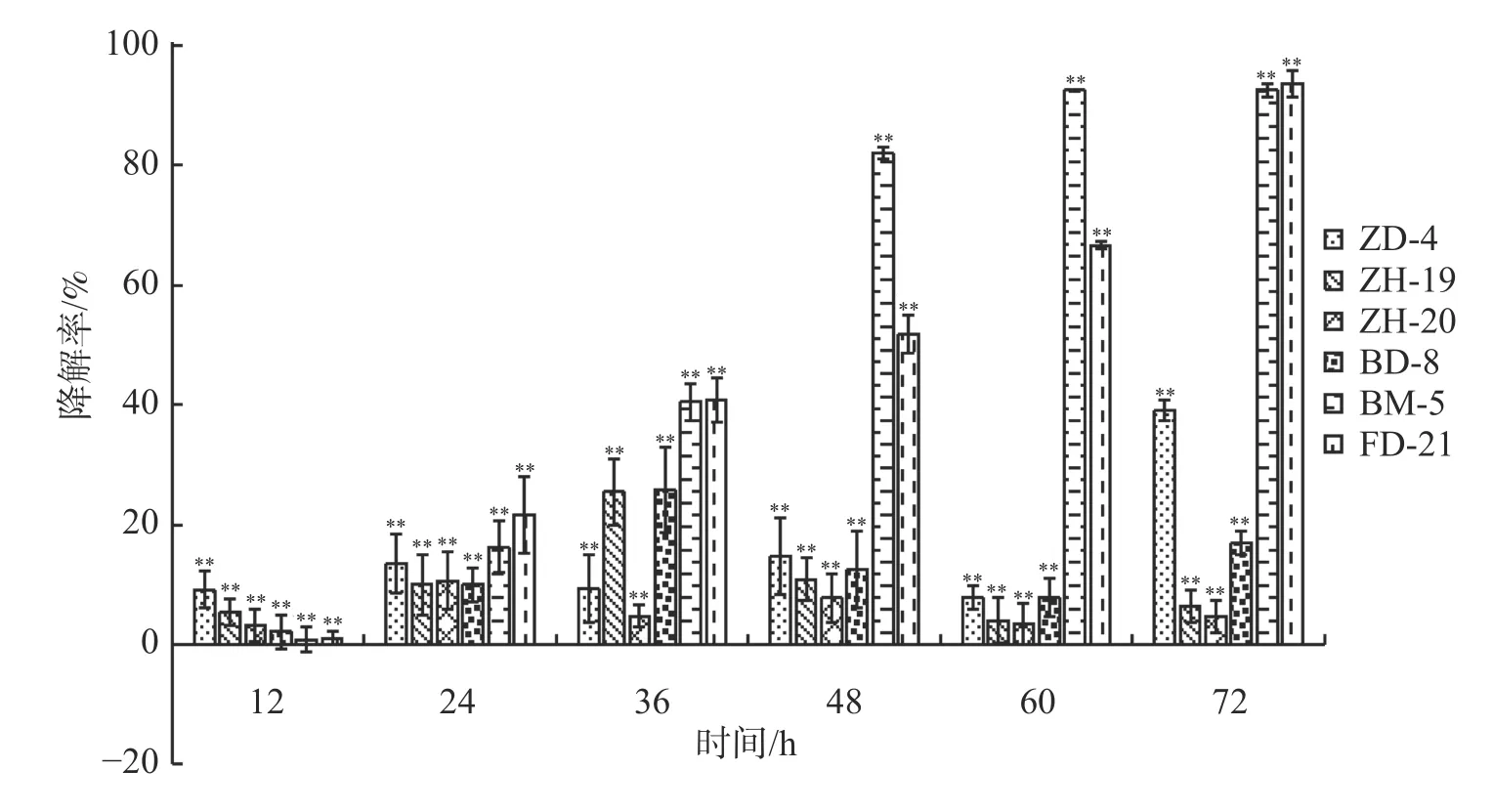
图3 6株降解菌降解水杨酸的能力
2.2 在连作土壤条件下菌株降解酚酸类自毒物质能力在恒温培养3 d时,这6株降解菌对连作土壤中的对羟基苯甲酸、水杨酸和苯甲酸均有一定的降解能力,其中,ZH-20和ZH-19对对羟基苯甲酸的降解率超过了50%,对水杨酸的降解率超过了60%;ZH-20、ZH-19和BD-8对苯甲酸的降解率超过了20%(图4)。在恒温培养5 d时,FD-21、ZH-19和BD-8对对羟基苯甲酸的降解率约为20%;FD-21对水杨酸的降解率最高,达到了37.11%;ZH-19、BM-5和BD-8对水杨酸的降解率超过了20%,其中,BM-5的降解率达到了27.5%;BD-8对苯甲酸的降解率最高,达到了75.87%;ZH-20、ZH-19和BM-5的降解率超过了30%(图5);恒温培养7 d时,ZD-4和ZH-19对对羟基苯甲酸的降解率超过了80%,其中,ZD-4对水杨酸的降解率最高,达到85.35%;BD-8、ZH-19、ZD-4对苯甲酸的降解率分别为86.52%、73.39%、69.84%(图6)。
图4 培养3 d时6株降解菌降解连作土壤中酚酸物质能力

图5 培养5 d时6株降解菌降解连作土壤中酚酸物质能力
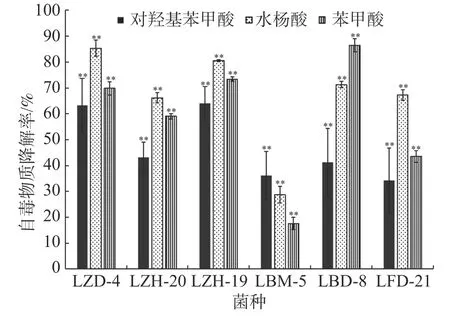
图6 培养7 d时6株降解菌降解连作土壤中酚酸物质能力
2.3 酚酸类物质降解菌对尖孢镰刀菌的抑制效果平板对峙实验结果表明,菌株ZH-20、ZH-19、ZD-4、BM-5对香草兰枯萎病病原菌尖孢镰刀菌都具有极显著抑制作用,其中菌株ZH-20、ZH-19的抑菌率达到80%以上,显著高于其他菌株(图7)。菌株FD-21的抑菌率为46%,显著高于BD-8,但低于3株细菌ZH-20、ZH-19、ZD-4对尖孢镰刀菌的抑制效果。
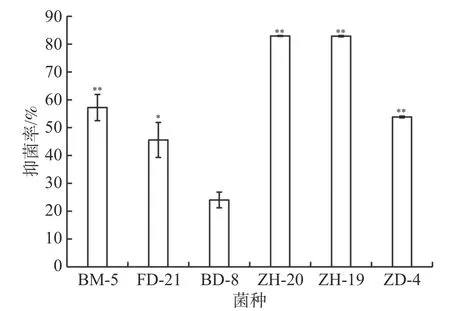
图7 6株菌对病原真菌尖孢镰刀菌的抑制率
2.4 酚酸物质降解菌分子鉴定6株降解菌经16S rRNA和ITS序列测定后,将3株细菌16S rDNA 序列和3株真菌ITS的测序结果登录GenBank,并用BLAST与 GenBank中16S rRNA序列和ITS序列进行同源性比较,结果发现,(1)6株降解菌中的3株细菌中,ZD-4与枯草芽孢杆菌Bacillus subtilis(MZ712061)的16S rRNA 序列同源性达到99.64% ;ZH-19与炭疽芽孢杆菌Bacillus anthracis(HQ670430)的16S rRNA 序列同源性达到95.83% ;ZH-20与解淀粉芽孢杆菌Bacillus amyloliquefaciens(KY784657)的16S rRNA序列同源性达到93.48% 。(2)6株降解菌中的3株真菌中,BM-5与黄丝曲霉属Talaromycessp.(MK368459)的 ITS 序列同源性达到99.81% ;菌株FD-21与青霉属Penicilliumsp.(MN701702)的ITS序列同源性达到99.45% ;菌株BD-8与桔青霉Penicillium citrinum(MT529414)的ITS序列同源性达到99.81% 。基于测序结果建立系统发育树如图8所示。

图8 基于 16SrRNA 和ITS基因序列构建的系统发育树

3 讨 论
酚酸是植物重要的次生代谢产物,通过莽草酸-苯丙烷途径产生,是木质素和细胞壁聚合物的分解产物[25]。这些化合物可以在植物-微生物和植物-植物的相互作用中发挥多功能作用[26]。本研究结果表明,从香草兰根际土壤中筛选到的6株菌对苯甲酸、水杨酸和对羟基苯甲酸均有较强的降解能力,可作为根系酚酸类自毒物质降解菌应用于实际生产中,以消减自毒物质对香草兰根系生长及根际微生物群落装配产生的负面影响[27]。张春杨等[16]在花生根际土壤中筛选出木糖氧化无色杆菌(Achromobacter xylosoxidansHJ-2) 和硝基还原假单胞菌(Pseudomonas nitroreducensHJ-3),均能够有效降解苯甲酸,同时这2株菌能够降解苯乙酮、硬脂酸、 棕榈酸、乳酸、3,5-二甲基苯甲醛和丙三醇等化感物质。何志刚等[28]在番茄的根际土壤中筛选出芽孢杆菌属枯草芽孢杆菌(Bacillus subtilis)、链霉菌属吸水链霉菌(Streptomyces hygroscopicus)、纳西杆菌属耐碱纳西杆菌(Naxibacter alkalitolerans),对苯甲酸、对羟基苯甲酸、水杨酸、肉桂酸以及香草酸都有一定的降解作用。在本研究中FD-21青霉菌(Penicilliumsp.)在摇瓶实验中降解对羟基苯甲酸、水杨酸和苯甲酸的能力均较好,分别达到89.85%、93.62%和78.87%,但在连作土壤中对对羟基苯甲酸、水杨酸和苯甲酸降解率分别为34.2%、67.28%和43.5%,这可能是在土壤环境条件下微生物的生存空间较复杂,受其在土壤中利用不同碳氮源能力及定殖能力影响所致[29]。
XIONG等[30]的研究结果表明,连作香草兰根际土壤真菌多样性和植株发病率呈显著负相关,抑病型香草兰园根际土壤具有较高的真菌多样性,更易富集与植株健康密切相关的芽孢杆菌和青霉等有益微生物。本研究筛选出了对尖孢镰刀菌有显著抑制作用及可降解根系自毒物质酚酸的复合型功能菌株,它们为ZD-4枯草芽孢杆菌(Bacillus subtilis)、ZH-19炭疽芽孢杆菌(Bacillus anthracis)、ZH-20解 淀 粉 芽 孢 杆 菌(Bacillus amyloliquefaciens)、BM-5黄 丝 曲 霉(Talaromycessp.)、FD-21青 霉(Penicilliumsp.)、BD-8桔 青 霉(Penicillium citrinum)。文献[31]的研究结果表明,在改良具有连作障碍的苹果园土壤,单施有机肥土壤中黄丝曲霉属明显升高,推测黄丝曲霉可能有益于苹果植株健康生长,为连作土壤改良提供了新思路[31]。另外,黄丝曲霉属可作为土壤高效解磷菌应用于实际生产中[18]。文献[32]的研究结果表明,在香草兰与胡椒轮作模式中,香草兰根际土壤中与植株密切相关的有益菌青霉的丰度显著增加[32]。在本研究中发现青霉FD-21降解3种酚酸自毒物质的能力明显优于其他2株真菌,且对尖孢镰刀菌有显著抑制作用。
近年来,我国高度重视研发农业绿色投入品,助力为实现我国农业绿色优质发展,更趋向重视对农业绿色投入品的研发与应用。随着对高效功能型菌种资源的不断挖掘,多种有益功能微生物应用到农业生产中,利用复合型高效功能微生物降解自毒物质、抑制土传病害,是一种缓解作物连作生物障碍行之有效的方法。本研究筛选到了对苯甲酸、水杨酸和对羟基苯甲酸有显著降解作用且可抑制土传病原真菌尖孢镰刀菌的复合型功能微生物菌株枯草芽孢杆菌、黄丝曲霉等,丰富了酚酸类自毒物质降解菌及生防菌菌种资源,对缓解香草兰连作生物障碍提供了新的菌种资源。下一步,笔者拟基于生态功能互补及生物多样性原理,组合高效互作菌群,并研究适宜高效菌群生长扩繁的不同营养载体组合(益生源),研制高效复合菌剂,为调控香草兰连作土壤,有效阻控连作生物障碍提供支撑,同时,也为缓解其他经济作物连作生物障碍提供参考。
