常压室温等离子诱变筛选高产酯酶的菠萝蜜果酒酿酒酵母
2022-11-29张雪吴叶陈雪雪陈星光杨华陆健吴殿辉
张雪,吴叶,陈雪雪,陈星光,杨华,陆健*,吴殿辉*
1(工业生物技术教育部重点实验室,江南大学 生物工程学院,江苏 无锡,214122)2(粮食发酵与食品生物制造国家工程研究中心(江南大学),江苏 无锡,214122)3(江苏省生物活性制品加工工程技术研究中心(江南大学),江苏 无锡,214122)
菠萝蜜(ArtocarpusheterophyllusLam.)是一种深受大众欢迎的热带水果,其果味甜、香气独特,具有多种生物比活力[1-2],有“热带水果皇后”、“齿留香”等美称。但菠萝蜜果实采摘期短、不耐贮藏,严重制约了菠萝蜜种植业的发展。因此,菠萝蜜精深加工的相关研究备受关注[3]。菠萝蜜果实含糖量高、香气浓郁、风味独特,是酿造果酒的上等原料[4];同时有研究认为,菠萝蜜果酒富含有机酸、多糖、没食子酸和原儿茶酸,具有抗氧化性和抑制DNA损伤的特性[5]。因此,酿造果酒成为了菠萝蜜精深加工的一个重要方向。
果酒酿造过程中,果汁在发酵微生物的作用下发生了一系列复杂的生物转化反应,形成种类丰富、特征各异的挥发性香气化合物,赋予了酒体不同风格[6]。酵母对菠萝蜜果酒香气成分的形成和含量具有重要影响[7]。在酿酒工艺相同的前提下,同品种菠萝蜜酿造果酒的香气成分差异主要是酿酒酵母风味酶活力不同引起的[8-9]。风味酶又称增香酶,是能够催化风味前体形成风味物质的酶的总称,如脂肪酶、糖苷酶、酯酶、蛋白酶等[10]。其中,酿酒酵母的酯酶活力与果酒中酯类物质的合成、积累过程密切相关[9]。BARDI等[11]研究发现葡萄汁酒精发酵期间有较高的酯酶活力;PÉNICAUD等[12]的研究证实了酿酒酵母细胞中酯酶的存在。酯类化合物具有较低的阈值和浓郁的水果香味,是决定果酒香气的重要香气化合物[13],因此,酯酶可以通过调节酒体中酯类物质的浓度来影响果酒的质量[14]。近年来关于酵母与菠萝蜜果酒香气之间关系研究多侧重于筛选自然菌株提高菠萝蜜果酒香气[15]、比较不同商业酵母对果酒香气成分影响[7]、果酒香气成分检测[16]及优化发酵工艺提高果酒香气[17]等,而关于通过提高酿酒酵母酯酶活力来增强菠萝蜜果酒香气品质的研究鲜有报道。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变育种指在室温常压的条件下,使用高纯氦气产生大量的等离子体流损伤微生物的遗传物质DNA,从而产生大量突变株的菌种选育方法。与传统诱变方法相比,该项技术具有突变效率高、安全性高等特点。目前诱变育种研究日趋成熟,可以有效地突变酵母[18]。
因此,本研究首先通过ARTP技术诱变酿酒酵母CS31(从菠萝蜜果汁自然发酵液中筛选),提高出发菌株的酯酶活力;再评估诱变菌株的各类发酵性能以及产酯酶能力,选择能顺利完成发酵的同时又具有最高酯酶活力的菌株;最后验证在菠萝蜜果酒发酵中,该突变菌株的产香能力,以期为菠萝蜜果酒专属酿酒酵母的选育提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
酿酒酵母CS31,由江南大学粮食发酵与食品生物制造国家工程研究中心从菠萝蜜自然发酵液中分离并在-20 ℃甘油管中保藏;菠萝蜜汁由海南豪蜜食品有限公司提供;白砂糖购自江苏省无锡市滨湖区欧尚超市。
YPD固体培养基(质量分数):酵母粉1.0%,蛋白胨2.0%,葡萄糖2.0%,琼脂粉2.0%;YPD液体培养基(质量分数):酵母粉1.0%,蛋白胨2.0%,葡萄糖2.0%;初筛培养基(质量分数):酵母粉1.0%,蛋白胨2.0%,葡萄糖2.0%,灭菌后加入12%乙醇;发酵培养基(质量分数):蛋白胨2.0%,酵母粉1.0%,硫酸铵0.3%,磷酸二氢钾0.4%,葡萄糖2.0%,吐温80 2 mL/L,蒸馏水配制,自然pH;以上培养基的灭菌条件均为115 ℃、0.1 MPa高压灭菌30 min。菠萝蜜汁培养基:解冻后的菠萝蜜汁,按料液比3∶2(g∶mL)加入蒸馏水,混匀后离心留上清液,用白砂糖调整糖度至230 g/L,加入偏重亚硫酸钾120 mg/L;pH值为5.0的柠檬酸-磷酸缓冲液:0.1 mol/L柠檬酸、0.2 mol/L磷酸氢二钠。
偏重亚硫酸钾、蛋白胨、葡萄糖、琼脂、酵母浸粉、乙醇、硫酸铵、磷酸二氢钾、氢氧化钠、氯化钠、柠檬酸、磷酸氢二钠、异戊醇和石英砂,国药集团化学试剂有限公司;对硝基苯基乙酸酯(p-nitrophenyl acetate,p-NPA)、对硝基苯基丁酸酯(p-nitrophenyl butyrate,p-NPB)、对硝基苯基己酸酯(p-nitrophenyl hexanoate,p-NPH)、2-辛醇,上海阿拉丁生化科技股份有限公司;偏重亚硫酸钾为食品级,2-辛醇为色谱纯,其余试剂均为分析纯。Premix ExTaqTM,6×DNA LoadingBuffer、2 000 bp DNA Marker、引物ITS1、ITS4,苏州Genewiz公司。
1.1.2 仪器与设备
Artp-iis ARTP 诱变系统,无锡源清天木生物科技有限公司;SW-CJ-1D 无菌操作台,苏州净化设备有限公司;EPOCH2T酶标仪,美国BioTek公司;LEGEND MICRO17离心机,赛默飞世尔科技公司;SHP-2500低温生化培养箱,上海精密实验设备有限公司;Trace1310-ISQ LT ISQ单四级杆气质联用仪,美国Thermo Scientific公司;LS-B50L自动高压蒸汽灭菌器,致微(厦门)仪器有限公司;HYL-C组合式摇床,太仓市强文实验设备有限公司;GHP-9050隔水式恒温培养箱,上海一恒科学仪器有限公司;5415D高速离心机,德国Eppendorf股份公司;Eppendorf AG 22331 Hamburg PCR扩增仪,德国艾本德股份公司。
1.2 实验方法
1.2.1 初始菌株ARTP诱变
取出-20 ℃甘油管保藏的初始菌种CS31,涂布于YPD固体培养基上,30 ℃条件下培养48 h,使其活化。活化结束后,在YPD固体培养基中挑取单菌落,接种至YPD液体培养基,30 ℃条件下振荡(220 r/min)培养11 h。收集处于对数期的初始菌种CS31,用生理盐水(0.9%氯化钠溶液)洗涤2次并稀释至1.62×107CFU/mL。在金属载片上均匀涂抹10 μL的菌悬液后,将金属载片置于诱变系统中,在100 W诱变功率、10 L/min气流量和2 mm照射距离下,分别诱变0、30、60、90、120、150、180、210 s。待诱变结束,对每个处理样品进行梯度稀释,并将稀释液涂布于YPD固体培养基上,30 ℃恒温恒湿培养3 d,观察菌落数并计算致死率。诱变致死率见公式(1):

(1)
1.2.2 诱变菌株的初筛
优良的菌株首先要顺利启动并完成发酵过程。因此,在筛选出具有高酯酶比活力的突变株之前,需要对这些菌株进行一定的初筛。
1.2.2.1 一级筛选
通过高通量筛选耐酒精菌株。将YPD液体培养基(含有12%乙醇)加入96孔板后接入诱变菌株。随后将孔板在30 ℃条件下振荡培养(200 r/min)2 d。取出孔板,并用酶标仪测定每个小孔在600 nm波长处的吸光值(OD600)。选取OD600比出发菌株CS31显著提高的突变株进行二级筛选。
1.2.2.2 二级筛选
采用杜氏小管发酵法筛选出起酵速度快、发酵能力强的菌株。将上步筛选的正向突变菌株,以8%的接种量分别接种到装有杜氏小管和菠萝蜜汁培养基(10 mL)的试管中,30 ℃条件下静置培养8 h后,每隔2 h观察各菌株的产气量,记录菌株的起酵时间和产气速度。
1.2.2.3 三级筛选
通过菠萝蜜果酒发酵实验,筛选出发酵性能优良的菌株。将活化2次后的菌株使用无菌水低温离心洗涤3次,再使用菠萝蜜果汁进行重悬。将重悬后的菌株进行菠萝蜜果酒发酵实验,主酵结束观察酒体的色泽和气味,去除明显出现异味、酒体浑浊的酒样。参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定剩余酒样的乙醇、总糖和总酸含量,再次去理化指标不达标的菌株。菠萝蜜果酒初步发酵条件为料液比3∶2(g∶mL),初始总糖含量230 g/L,酵母接种密度1×107CFU/mL,果胶酶15 U/mL,偏重亚硫酸钾120 mg/L,发酵温度20 ℃,发酵时间132 h。
1.2.3 诱变菌株的复筛
将初筛菌株接入YPD液体培养基中30 ℃活化24 h后,再按1%接种量转接至YPD液体培养基中30 ℃振荡培养(200 r/min)11 h,随后按2%接种量再次接入发酵培养基中30 ℃振荡培养(200 r/min)24 h。将培养好的菌液高速离心去上清液,用缓冲液低温离心洗涤3次后重悬细胞,以此作为粗酶液测定菌株的酯酶活力。酯酶比活力最高的菌株即为目标菌株。重悬细胞的干重通过将培养好的菌液用蒸馏水低温离心洗涤3次后,在100 ℃恒温烘干至恒重获得。
酯酶活力测定方法参照文献的报道[14,19],并进行略微修改。具体方法如下:分别在40 μL的p-NPA(C2)、p-NPB(C4)和p-NPH(C6)异戊醇溶液(25 mmol/L)中加入400 μL的菌悬液和860 μL的柠檬酸-磷酸缓冲液(pH=5.0)。在40 ℃下反应10 min后,在混合溶液中加入400 μL的NaOH溶液(0.5 mol/L)终止反应,10 000 r/min离心5 min,测定上清液在400 nm波长下的吸光值。对照组使用柠檬酸-磷酸缓冲液代替细胞重悬液。每个样品进行3次平行实验。根据标准曲线(y=0.752 6x-0.018 2,R2=0.999 3)计算反应体系中对硝基苯酚的质量浓度(g/L)。1个酯酶活力单位(U)定义为:40 ℃条件下,每分钟释放1 μmol对硝基苯酚所需的酶量。用酯酶比活力来表征不同菌株的酯酶活力高低,比活力定义为:单位质量(g)的菌体中所具有的酯酶活力单位数(U)。分别计算出不同菌株中C2、C4、C6酯酶比活力,计算见公式(2):

(2)
式中:C为酶活力测定反应体系中对硝基苯酚的浓度,μmol/L;V为体积,L;m为400 μL粗酶液中菌体的干重,g;t为酶活力测定反应时间,min。
酯酶累计比活力为各菌株C2~C6酯酶比活力之和。
1.2.4 优选菌种的鉴定
采用石英砂破壁法[20]提取目的菌株基因组DNA,并通过PCR扩增目的酵母的基因组DNA。PCR扩增体系(50 μL):Premix ExTaqTM,25 μL;引物ITS1和ITS4,各2 μL;DNA模板,1 μL;双蒸水,20 μL。PCR扩增程序:95 ℃预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸1 min,循环36次;72 ℃保持10 min。PCR产物进行核酸电泳检测,寄送至苏州Genewiz公司进行sanger测序。采用MEGA 7.4软件将测定的18S rDNA序列与GenBank中酵母菌的序列进行比对,下载匹配度前10位的序列与待鉴定菌株构建菌株系统发育树。
1.2.5 产香能力验证
菠萝蜜果酒发酵条件同1.2.2.3。对选育出的菌株和出发菌株CS31进行菠萝蜜果酒发酵实验。主发酵结束后,采用顶空固相微萃取气相色谱质谱联用方法(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析菠萝蜜果酒发酵香气成分。
样品配制:在20 mL容量的顶空瓶中,加入3 mL的菠萝蜜果酒样品、3 mL的去离子水、52 μg/L的2-辛醇内标、3.0 g的NaCl固体。
HS-SPME条件:50 μm/30 μm CAR/DVB/PDMS的SPME纤维萃取头用于风味物质的萃取。预热时间为2.5 min,预热温度为45 ℃,萃取吸附时间为30 min,质谱解吸温度为250 ℃,质谱解吸时间为1 min。
GC条件:色谱柱为TG-Wax(60 m×0.25 mm×0.25 μm)色谱柱;载气为氦气,流速是1 mL/min;升温程序为45 ℃维持1 min后,以6 ℃/min速度升温至230 ℃并保持6 min;进样口温度为250 ℃,不分流。
MS参数如下:离子源,电子电离源(EI);离子源温度,260 ℃;四极杆温度,150 ℃;碰撞电压,70 eV;扫描质量范围,29~350 u。
物质定性:香气比活力成分的定性通过与NIST 05质谱库(Agilent Technologies Inc.)中标准谱图进行检索比对,并根据改进的Kovats法计算得到各物质保留指数(retention index,RI)进行确认。
物质定量:在待测酒样中加入2-辛醇内标,根据半定量方法计算各物质的含量[21]。
1.2.6 关键风味物质分析方法
对突变菌株和出发菌株CS31发酵果酒的风味成分进行归纳,并利用相对气味活度值(relative odor activity value,ROAV)法确定挥发性物质对菠萝蜜果酒风味的贡献[22]。一般认为ROAV>1的挥发性物质是样品中的关键风味物质。使对样品总体风味贡献最大的组分ROAVstan为100,其余各组分的ROAVA计算见公式(3):
(3)
式中:Cstan、Tstan分别为对样品总体风味贡献最大的香气成分的含量及其感官阈值,μg/L;CA、TA分别为其余各香气成分的含量及其感官阈值,μg/L。
1.2.7 遗传稳定性验证
将复筛得到的具有较高酯化酶酶活力的突变株传代5次,测定每一代菌株的C2~C6酯酶活力及酯酶累计活力,以确定突变菌株的遗传稳定性。
2 结果与分析
2.1 ARTP诱变结果
原始菌株CS31经ARTP诱变后致死率曲线如图1所示。随着时间的增长,致死率也随之增大。当诱变时间180 s时,致死率达到98.75%,诱变时间210 s时,致死率达到100%(即未发现有活菌存活)。现代育种理论表明,诱变致死率≥95%时,正向突变率最高,可获得最佳正向突变体[18]。因此,选择ARTP诱变时间180 s为本试验的最佳诱变时间。

图1 CS31在ARTP不同处理时间下的致死率Fig.1 Lethality rate of CS31under different mutagenic time of ARTP
2.2 诱变菌株初筛结果
2.2.1 酒精耐受性实验
酒精耐受性是衡量突变菌株在果酒发酵中应用的重要指标之一,可初步筛选出性状优良的菌株[23]。以处理组菌体OD600值高于对照组菌体OD600值的20%为筛选准则进行选择[18]。由表1可知,从165株突变株中获得了21株对乙醇具有较好耐受性的菌株。

表1 不同菌株对酒精的耐受性Table 1 Alcohol tolerance of different strains
2.2.2 杜氏小管产气实验
将上步筛选得到的21株诱变菌株接种在装有杜氏小管的试管中,产气情况如表2所示。对照菌株CS31在8 h开始产气,12 h内气泡充满杜氏小管。对于突变菌株,产气最快的菌株8 h时也开始产气,至10 h 后产气充满杜氏小管,而有的菌株14 h后仍未能产满气体,可见不同酵母的产气能力差异较大。其中,编号分别为YB10、YB13、YB19、YB31、YB38、YB55、YB57、YB61、YB63、YB65、YB69、YB71、YB87、YB93、YB111和YB144的菌株相较于出发菌株起酵短、产气速度快,说明这16株酵母菌具有较高的发酵度和发酵效率[24]。故将上述16株酵母菌做下一级筛选。

表2 不同菌株的产气情况Table 2 Results of gas production of different strains
2.2.3 菠萝蜜果酒发酵实验
为减小复筛选时的工作量,需进一步剔除发酵液气味、外观和常规理化指标有明显缺陷的菌株。对17株菌(16株较为优良的菌株以及对照菌株)进行果酒发酵实验,20 ℃静置发酵132 h后发现YB10、YB63、YB69、YB87发酵果酒有明显臭味,YB31、YB55、YB71发酵果酒酒体浑浊失光,因此后续不再研究。其余菌株发酵的酒体均有不同程度的花香、果香和酒香,并伴随有菠萝蜜的典型香味,其中YB93发酵的果酒香味尤其突出,对这些酒体进行指标测定。如表3所示,这些菌株的总糖(以葡萄糖计)、总酸(以酒石酸计)和酒精度(以体积计)虽有一定差异,但均处于正常范围内,故本轮筛选中保留除有明显缺陷外的全部菌株进行复筛。

表3 菠萝蜜酒的指标分析结果Table 3 Indexes analysis of jackfruit wines
2.3 诱变菌株的复筛结果
果酒发酵过程中酯类化合物的种类和含量,由发酵汁中酯酶作用底物的种类和数量以及酯酶的潜在底物特异性决定。SUMBY等[25]对酒酒球菌(Oenococcusoeni)C2~C10酯酶活力研究发现,其对不同碳链长度的底物反应具有特异性。酯酶的潜在底物特异性决定了酒中酯类化合物的构成,且其含量与碳链长度成反比[19];同时脂溶性酯类物质的跨膜转运会随着碳链长度的增加而大幅下降,其中己酸乙酯可以100%释放到细胞外,癸酸乙酯只有8%~17%被转移,而只有被高效释放到细胞外的酯类才可被消费者感知[9],因此,微生物在发酵过程中主要通过作用于短碳链的酯酶影响酯类香气物质的合成。不同菌株间代谢能力的差异会影响合成酯酶的活力及底物特异性,进而影响果酒的香气特征。因此,本研究以C2~C6 酯酶比活力为指标选育适合菠萝蜜果酒发酵的优良菌株。
以酿酒酵母CA31为对照,对初筛获得的10株菌株的C2~C6酯酶比活力进行测定。由表4可知,共有6株菌株酯酶的累计比活力高于CS31,但仅有YB93的C2、C4和C6酯酶比活力均高于发菌株,并且YB93的C2酯酶比活力(952.67 U/g) 比CS31(764.32 U/g)高出24.64%。因此,筛选出酯酶活力较高的突变菌株YB93。
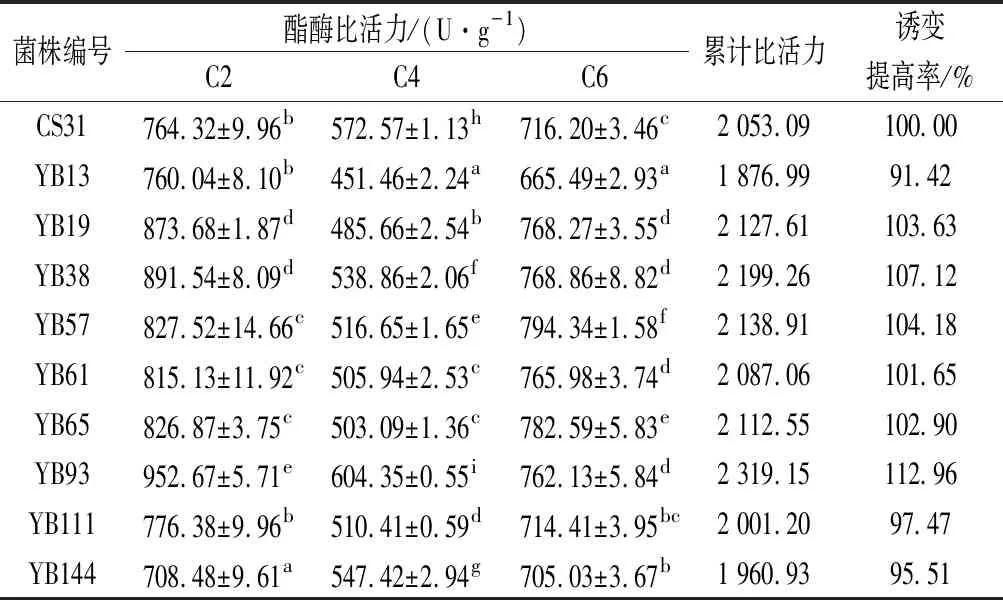
表4 不同菌株的酯酶比活力Table 4 Esterase specific activity of different strains
2.4 优选菌株的鉴定
突变菌株YB93外观呈乳白色、菌落凸起,表面较湿润、光滑,显微镜下边缘圆整,细胞呈圆状,一端出芽。突变菌株YB93的18S序列被命名为YB93,从GenBank中查找最高相似性序列,与获得的序列进行比较,然后使用Mega11构建邻接系统发育树,将自展值设置为1 000次重复。18S序列构建的系统发育树见图2。由图2可知,YB93菌株与MF276987.1具有100%的同源性。MF276987.1是一种托卡伊葡萄酒酿酒酵母(Saccharomycescerevisiae),说明YB93菌株属于酿酒酵母属。

图2 酵母菌株YB93的系统发育分析Fig.2 Phylogenetic analysis of yeast strain YB93
2.5 产香能力验证与关键风味化合物分析
突变菌株YB93和出发菌株CS31发酵得到的菠萝蜜果酒风味物质鉴定结果见表5。菠萝蜜果酒内共检出60种风味物质,其中包含38种酯类化合物,11种醇类化合物,5种酸类化合物及6种其他类化合物。由表5可知,在所有化合物中,以醇酯类化合物含量最为丰富,可占到挥发性化合物总量90%以上。两株菌株发酵的菠萝蜜果酒在风味物质的种类上并没有显著差异,但是在含量上具有显著差异。相较于CS31,YB93发酵的果酒中酯类、醇类以及酸类挥发性物质总含量均较高,尤其是酯类化合物。与CS31相比,经突变菌株YB93发酵的酒样总挥发性物质提高了34.28%,酯类物质提高了60.67%。上述结果表明,虽然酯酶作用效果具有双向性[9],但本实验中的酯酶对于菠萝蜜果酒中的酯类物质主导合成作用。FUJII等[26]报告了实验酵母菌株比对照菌株表现出更高的酯酶活性和更高含量的乙酸酯,其中乙酸异戊酯含量增加了27倍,乙酸乙酯含量增加了9倍。祝霞等[13]发现供试菌株总酯酶活性最高的ZX-1,其发酵的酒样中主要酯类物质(OAV>0.1)的总含量也最高,尤其是乙酸异戊酯、乙酸己酯、乙酸辛酯、乙酸苯乙酯等具有潜在花香和果香味的物质含量显著增加(P<0.05)。丰富的酯类物质赋予YB93发酵酒体更浓郁的花香和果香味[13],提高了菠萝蜜果酒的香气品质。
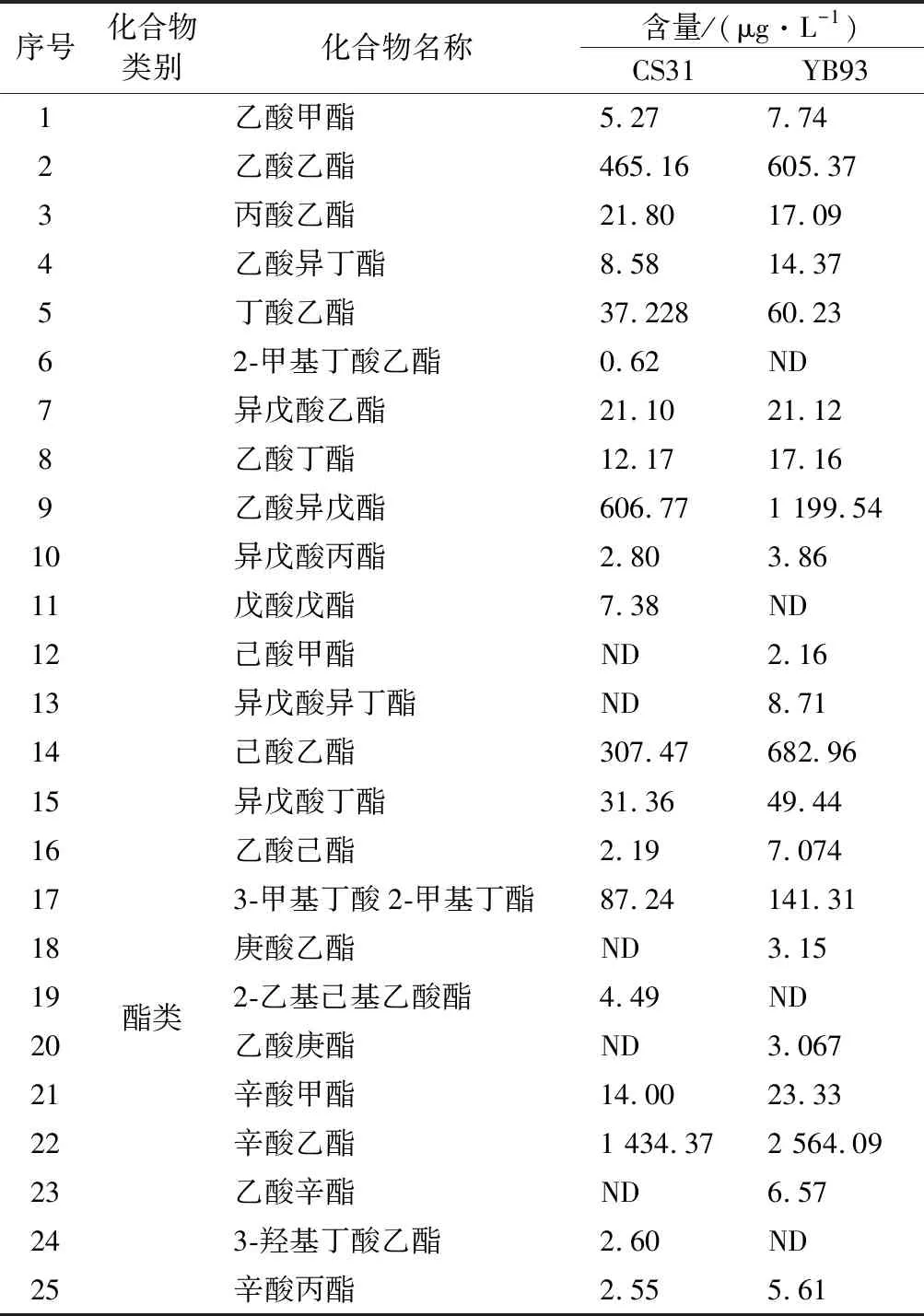
表5 菠萝蜜果酒中挥发性成分的半定量分析Table 5 Semi-quantitative analysis of volatile components in jackfruit wines
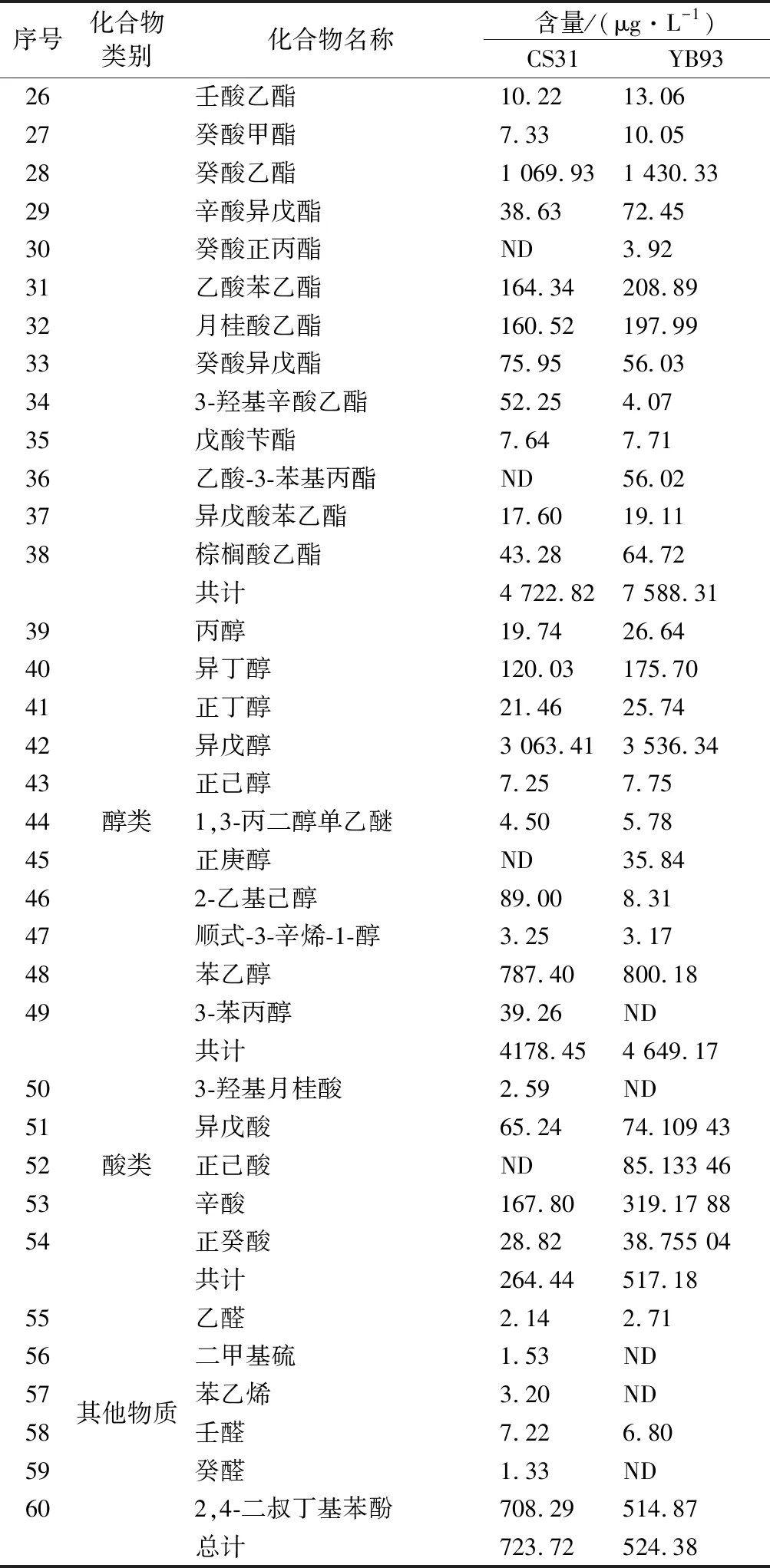
续表5
风味物质对总体风味的贡献不仅取决于其含量,还取决于其气味阈值。通过查询挥发性风味化合物的气味阈值进行ROAV分析,其中ROAV >1的香味物质对菠萝蜜果酒贡献较大,是菠萝蜜果酒中的关键风味化合物。由表6可知,两菌株发酵的果酒中关键风味化合物几乎都是酯类,且酯类物质数量与种类相同,可见提高酯类物质的含量对于提高菠萝蜜果酒香气品质的重要性。其中,除壬醛外,YB93各主要香气组分的含量均高于CS31,尤其是乙酸异戊酯、己酸乙酯、辛酸乙酯3种组分,分别提高了97.70%、122.13%、78.76%。在菌株YB93发酵果酒中,乙酸异戊酯、癸酸乙酯、异戊酸乙酯的ROAV值较高,这意味着这3种物质对酒体风味有着极大的贡献[22],这有助于分析菠萝蜜果酒中的典型呈香物质。综合以上初筛、复筛以及产香能力验证与关键风味化合物分析的结果,YB93菌株是可增强菠萝蜜果酒的香气品质的优良菌株。

表6 菠萝蜜果酒中关键风味物质含量及贡献值Table 6 Contents and ROAV values of key flavor compounds of jackfruit wines
2.6 遗传稳定性测定
通过ARTP诱变选育的菌株仍然具有不稳定性,会有回复性突变和隐性突变的可能,因此对诱变菌株进行传代试验验证菌株传代稳定性[18]。将诱变菌株CS31连续传代5次测定产酶能力,结果如表7所示。突变菌株YB93累计酯酶比活力稳定在2 308.51~2 318.91 U/g,且各代菌株的C2~C6酯酶活力差异不显著,变化幅度小。因此,可以证明突变菌株YB93高产酯酶能力可以稳定遗传,发生回复性突变概率较小,可以应用到菠萝蜜果酒发酵中[18]。

表7 菌株YB93酶活稳定性检测Table 7 Enzyme activity stability test of strain YB93
3 结论
优质酵母菌株的筛选和培育是菠萝蜜果酒酿造的重要一环。本实验以增强菠萝蜜果酒香气品质为目的,进行了菠萝蜜果酒高产酯酶酿酒酵母的选育。经ARTP诱变及系列筛选得到1株高产酯酶酿酒酵母YB93。经18S rDNA测序与系统发育树分析,鉴定YB93为Saccharomycescerevisiae。
在酯酶活力方面,YB93的C2、C4、C6酯酶比活力均高于发菌株,并且酯酶比活力累计量(2 319.15 U/g)比CS31(2 053.09 U/g)高出12.96%。高酯酶活力使YB93发酵果酒的醇类、酯类、酸类和总挥发性风味物质含量均高于出发菌株CS31发酵的果酒,其中酯类物质含量(7 588.31 μg/L)比出发菌株CS31(4 722.82 μg/L)提高了60.67%。通过ROAV法,分析出菠萝蜜果酒关键风味物质除壬醛外,均为酯类,较丰富的酯类物质可以赋予YB93发酵的酒体更浓郁的花香和果香味。菠萝蜜果酒中的关键风味物质一部分来自菠萝蜜的特征香味,一部分是由酵母在发酵过程中产生的芳香物质。菠萝蜜果酒和果汁中的关键风味物质(结果中未显示)相比较,果酒中关键香味物质的含量是果汁中的12.11倍;果汁中共有8种关键风味物质,和果酒中一样,除壬醛外均为酯类;两者有5种风味物质是重叠的,其中4种为酯类,贡献率最高的异戊酸乙酯和乙酸异戊酯也是果酒中贡献率较大的;经过酵母的发酵,果汁中的关键风味物质丁酸异戊酯消失,果酒中的关键风味物质癸酸乙酯和乙酸苯乙酯新生成,这使得菠萝蜜果酒在不破坏菠萝蜜典型香味的基础上拥有了更丰富的香气,达到既保留品种香,又增加发酵香的目的。经过测定YB93菌株具有较好的遗传稳定性,具有应用于果酒发酵的潜力。然而,本实验仅将诱变菌株与出发菌株的各项性能进行了对比,后续试验有待进一步考察突变菌株在菠萝蜜果酒发酵过程中酯酶活力和酯类物质种类、含量的变化规律。
总体而言,本实验为菠萝蜜果酒优良酵母的选育提供了一定的参考。
