野生鸟类肠道菌群多样性与生态适应研究进展
2022-11-28莫麒颖李明轩周一凡刘玲张雪涟张婉婷吴弘赵大鹏
莫麒颖,李明轩,周一凡,刘玲,张雪涟,张婉婷,吴弘,赵大鹏
(天津师范大学生命科学学院,天津300387)
动物肠道中存在一个庞大的微生物群落,其与宿主动物的相互作用参与了个体的营养吸收(Bäckhedet al.,2005)、生长发育(Diaz-Sanchezet al.,2012)、免疫防御(de Kivitet al.,2014)以及行为调节(Davidsonet al.,2020)等过程,在稳态维持和生态适应等方面起着重要作用(Moeller & Sanders,2020)。肠道菌群通常被描述为生物体内一个重要的“微生物器官”(Bäckhedet al.,2005),它们与宿主动物构成的整体被定义为“共生有机体”(Shapira,2016)。
鸟类是进化非常成功且极富物种和基因多样性的一类生物(Waite&Taylor,2014),相较于哺乳动物,鸟类的肠道菌群可能更具低稳定性和高可塑性(Hird,2017)。首先,鸟类的直肠很短,消化物不经贮存便直接作为粪便排出体外(Duke,1997),这种快速的消化过程导致了鸟类肠道菌群极易被改变和调整(Laviad-Shitritet al.,2019);其次,鸟巢是一个高度可变且微生物组成复杂的结构(Main‑waringet al.,2014;Hird,2017),其环境影响着雏鸟肠道菌群的建成(Gonzalez-Braojoset al.,2012;Am‑brosiniet al.,2019);更重要的是,野生鸟类具有多样的饮食类型、飞行习性和发育策略(García-Amadoet al.,2018),使其肠道菌群更为复杂(周立志,2018)。野生鸟类肠道菌群的变化影响着宿主的生理特征、营养状态和应激反应等方面(Laviad-Shitritet al.,2019)。肠道菌群的动态调整常作为鸟类提高自身生态适应性的一种重要机制(Riselyet al.,2018;Bodawattaet al.,2022a)。
全基因组概念指出宿主基因组及其微生物组形成一个共同经历自然选择的进化单元(Rosen‑berg & Zilber-Rosenberg,2016;Shapira,2016)。宿主为益生菌群提供合适的生态位以供它们较其他菌群更好地生长繁殖,而肠道菌群可以通过调节宿主食性生态位、放大使表型可塑性的信号以及促进免疫系统发育来促进生物的生态适应和进化历程(Moeller & Sanders,2020)。树袋熊Phasco⁃larctos cinereus幼崽在接种了专门针对一种桉树的肠道微生物后会摄入更多该种桉树的树叶(Blytonet al.,2019);候鸟在迁徙过程中由禁食产生的压力信号导致肠道中厚壁菌门Firmicutes 占比增加,这可能有利于它们最大效率地摄入能量(Turjemanet al.,2020);黑秃鹫Coragyps atratus和红头美洲鹫Cathartes aura肠道中富含2 类对于其他鸟类通常具有致病性的菌属,它们可能有助于野生秃鹫消化腐肉,并抵御其他适应肠道生态位的细菌侵入(Roggenbucket al.,2014)。
鸟类复杂的生存模式以及宿主-微生物群的相互作用,预示着鸟类肠道菌群具有宿主特异性(Sekirovet al.,2010),其肠道中可能富集着能适应宿主肠道生态位且有益于宿主健康的微生物(Sha‑pira,2016)。但鸟类个体小、飞行能力强、生活习性复杂等导致对鸟类肠道微生物的采样和研究难度都大大增加(Waite & Taylor,2014)。鸟类占据着广泛的生态位,在各类生态系统中均发挥着重要生态作用。然而,当今世界全球性环境问题对自然生态系统造成的影响和破坏日趋严重(李秉成,2006),鸟类肠道菌群也因此受到影响(Wuet al.,2018;Berlowet al.,2021a)。这不仅影响鸟类的生存,还关系到再引种的成败(Redfordet al.,2012)。因此,关注野生鸟类肠道菌群多样性具有重要研究价值和生态价值,探究宿主因素和环境因素对野生鸟类肠道菌群的影响,解释野生鸟类肠道菌群与其生态适应的关系,能够更深入地了解肠道微生物与宿主协同进化的生理机制,为生物多样性维持及生态环境保育工作提供基础理论依据。据此,本文归纳整理了现有关于野生鸟类肠道菌群的研究成果,总结了野生鸟类肠道菌群与宿主和环境的相互关系,为进一步探究野生鸟类肠道菌群的建成机制和生态作用提供参考。
1 研究方法
本研究以“肠道微生物”“肠道菌群”与“野生鸟类”为关键词,在中国知网(www.cnki.net)进行检索,以“gut microbiota”“intestinal flora”“gut microbi‑ome”“intestinal microbiota”“microbial community”与“wild birds”“wild avian”为关键词,在数据库Web of Science(http://www.webofscience.com/)中进行检索。通过对摘要和全文的阅读,保留研究野生鸟类肠道微生物多样性与结构特征,或探讨某种因素对野生鸟类肠道微生物的影响效应的相关论文,并着重分析研究结果体现肠道菌群与鸟类生态适应性相关的研究论文。
本研究记录所有论文的基本信息,包括文献基础信息、研究物种信息、研究方法等。将调研文献中的每个样本视为独立群体,统计所有研究群体的采样地点、分类地位、濒危等级、保护级别以及样本容量。数据分析采用Excel 2019、OriginPro 2021、Adobe Photoshop CC 2019。
2 研究进展
截至2022 年4 月,共搜集到符合要求的文献123 篇(期刊论文109 篇,学位论文14 篇)。本研究发现1992—2011 年相关论文发表数量无明显增长趋势,而2012—2022 年4 月相关论文发表数量呈显著增长趋势;国内研究起步晚于国外研究,但其增长速度较快(图1),其中中文文献共16篇。

图1 已检索到的国内外相关研究论文数量Fig. 1 Number of related domestic and foreign literatures
2.1 物种组成多样性
在研究物种的分类地位方面,当前研究物种共涉及野生鸟类24 目87 科212 属303 种。其中,在目水平上,以雀形目Passeriformes(54.1%)、鸻形目Charadriiformes(12.5%)和雁形目Anseriformes(4.6%)为主;在科水平上,以裸鼻雀科Thraupidae(9.6%)、鹬科Scolopacidae(6.9%)和鸭科Anatidae(4.6%)为主。
在研究物种的采样地区方面,共涉及6洲28国。其中,大洲以亚洲(32.5%)、南美洲(17.1%)和非洲(14.9%)为主;国家以中国(29.4%)、赤道几内亚(14.7%)和美国(12.9%)为主(图2)。
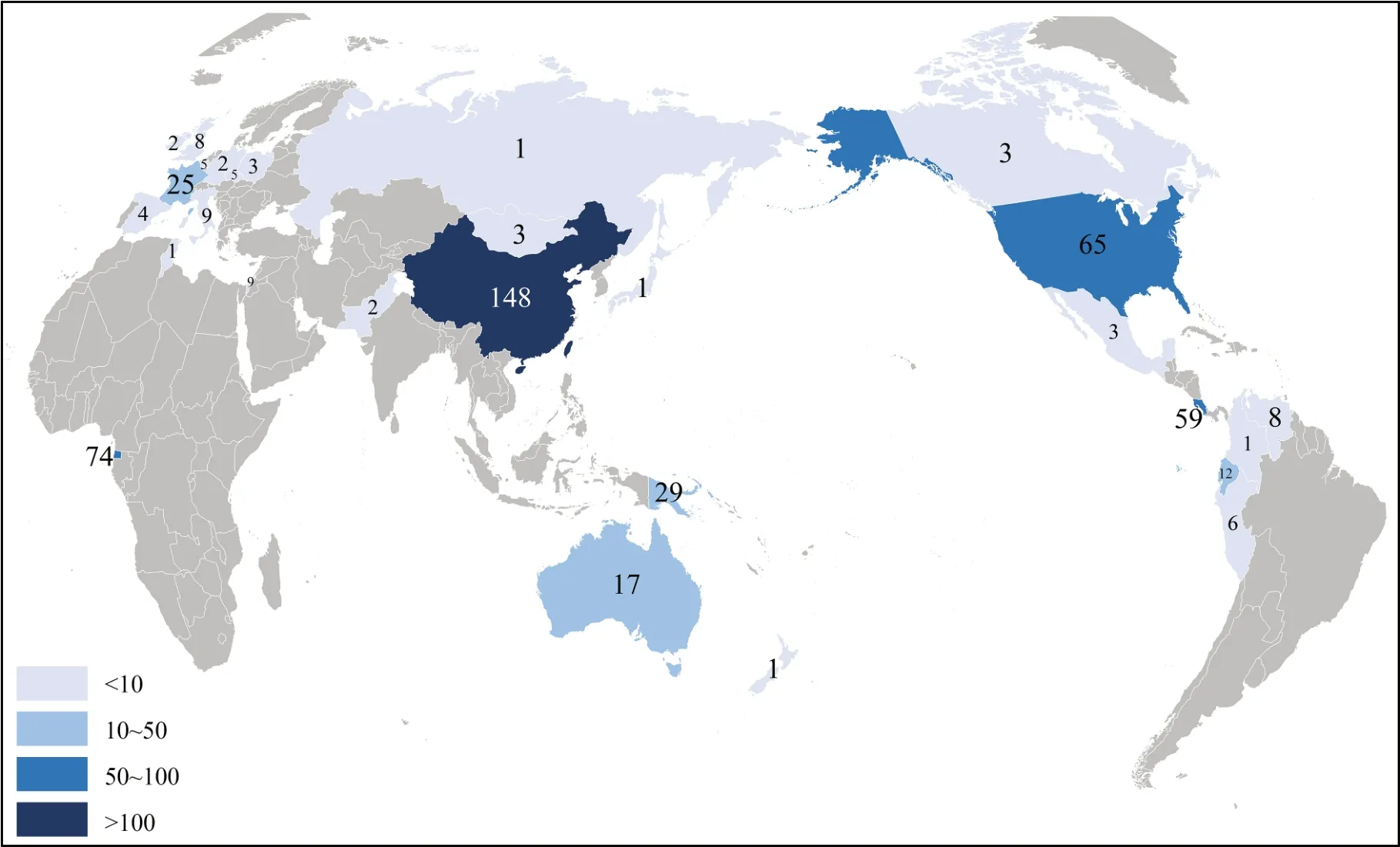
图2 已研究的野生鸟类群体的国家分布情况Fig. 2 National distributions of known wild bird clusters
在研究物种的濒危等级方面,世界自然保护联盟(IUCN)红色名录中“无危(LC)”物种占77.1%。在研究物种的保护级别方面,研究地点在我国,且为“国家一级重点保护野生动物”的占41.9%。
2.2 研究方法多样性
2.2.1 采样方法选择现有研究主流的采样方法为“间接采样(粪样)”(74.8%),且随着时间的推移,该方法使用比重呈上升趋势,多种采样方式结合的形式开始出现(表1)。

表1 不同时间段各采样方法的数量Table 1 Number of sampling methods in different time periods
2.2.2 研究对象选择在研究物种的样品数量方面,样本容量为1~546,以1~20(77.9%)为主;整体趋势表现为濒危等级越高,对应的样本容量越小(图3)。在研究物种、地区和时期的数量选择方面,以对单物种(64.2%)、单地区(65.9%)和单时期(82.1%)的研究为主。
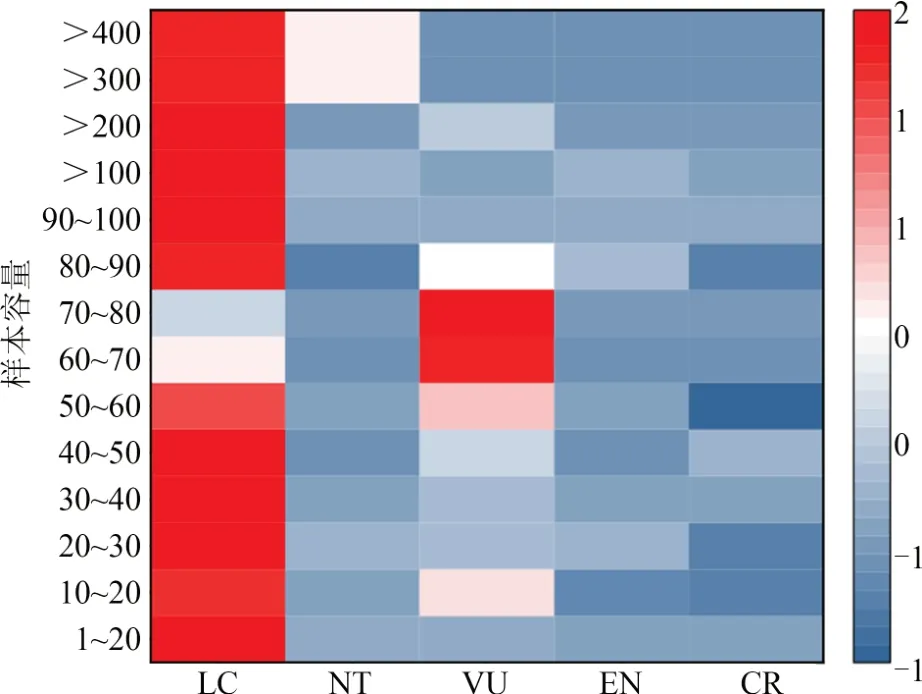
图3 样本容量与IUCN濒危等级的联系Fig. 3 Association between sample sizes and IUCN classification
2.2.3 实验技术选择早期研究受技术的限制,对肠道微生物的鉴定使用以纯培养、染色和显微镜观察为主的方法(Aguirreet al.,1992)。这类方法操作简易,但周期较长、结果受环境影响较大(刘玉婷等,2016),且鸟类肠道微生物中可培养的菌种百分比未知(张政,2021)。
基于16S rRNA 和18S rRNA 基因包含着不同物种特有保守基因序列的原理(Zaneveld,2010),现有研究主要通过分子生物学技术对肠道菌群进行检测。早期测序常用的自动化核糖体基因间隔分析(automated ribosomal intergenic spacer analy‑sis,ARISA)(van Dongenet al.,2013)可直接用来推测生物体肠道菌群的变化。也可通过克隆技术对优势菌群进行进一步分析(刘玉婷等,2016)。随着高通量测序技术的发展,Illumina 等测序平台的出现,给研究者提供了更加全面认识肠道微生物组成特征和物种信息的条件,16S rRNA 高通量测序技术已经成为检测野生鸟类肠道细菌群落的主要途径(Waite & Taylor,2015)。基于16S rRNA 高通量测序结果,研究者通常使用微生物生态学定量分析(quantitative insights into microbial ecology,QIIME)对微生物原始数据进行归一化处理(Caporasoet al.,2010)后,对所得数据进行操作分类单元(operational taxonomic units,OTU)划分,继而对其进行测序质量评估、物种组成分析、Alpha多样性分析以及Beta多样性分析(赵晗旭,2015;Xieet al.,2016),并使用 PICRUSt 进行功能预测(Langilleet al.,2013)。
宏基因组测序是一种新兴的对肠道微生物进行检测和表征的技术(张政,2021),可以全面反映环境中所有微生物的基因信息(Mendozaet al.,2018),其在反映和测量肠道菌群组成特征以及基因组编码代谢潜力方面有强大的功能(Tuohy,2009),但更大的测序深度也增加了分析的成本和计算难度(董元秋,2019),当前关于野生鸟类肠道菌群宏基因组的研究较少(Wanget al.,2019;Moh‑sin Bukhariet al.,2022)。
2.3 肠道菌群多样性
在门水平上,野生鸟类的肠道菌群以变形菌门Proteobacteria、厚壁菌门、拟杆菌门Bacteroide‑tes、放线菌门Actinobacteria 为优势菌门,其次还包括软壁菌门Tenericutes、蓝细菌门Cyanobacteria等。纵、横向比较各研究中鸟类群体肠道菌群的结构发现,各门的丰度和结构在种间和种内均存在较大差异,这可能是由于野生鸟类肠道菌群的构建受到多种因素的共同影响。生活在比利时北部一林地中的大山雀Parus major以厚壁菌门、放线菌门和变形菌门肠道为优势菌门,其中厚壁菌门和放线菌门占绝对优势(Teyssieret al.,2018);而生活在爱尔兰科克市的大山雀以厚壁菌门、变形菌门和软壁菌门为优势菌门(Davidsonet al.,2021)。以昆虫为食物的大山雀个体肠道菌群以变形菌门、厚壁菌门和软壁菌门为主,而以种子为食物的个体肠道菌群以变形菌门、软壁菌门和蓝细菌门为主(Davidsonet al.,2020)(表2)。

表2 部分野生鸟类肠道菌群多样性Table 2 Diversity of gut microbiota of some wild birds
在属水平上,野生鸟类肠道菌群也存在着丰富的变化。斑头雁Anser indicus在青海湖附近一湿地生境下以乳球菌属Lactococcus、假单胞菌属Pseudomonas和节细菌属Arthrobacter为优势菌属(Wanget al.,2016a),而同样在该地区,另一研究结果显示其以链球菌属Streptococcus、乳球菌属和芽孢杆菌属Bacillus为优势菌属(Wanget al.,2017);在西藏各越冬区内,斑头雁以乳球菌属、芽孢杆菌属和假单胞菌属为优势菌属(Wanget al.,2016b);在青海湖生境下斑头雁以梭杆菌属Fusobacterium、嗜冷杆菌Psychrobacter和Bulleidia为优势菌属(郑思思等,2018)。
2.4 影响因素多样性
野生鸟类肠道微生物可通过遗传获得,也可来源于环境(Theiset al.,2016;Trevellineet al.,2018)。Shapira(2016)提出将肠道菌群分为 2 类:宿主核心菌群和取决于环境条件而瞬时变化的菌群。野生鸟类肠道菌群的建成是宿主内在因素和外界环境因素共同驱动的结果(Hirdet al.,2015)。
2.4.1 宿主因素对肠道菌群的影响食性因素:食性被认为是影响肠道菌群结构最主要的内驱力因素(Carmodyet al.,2015)。植食性和杂食性鸟类肠道菌群多样性通常很丰富(章娜中,2021),前者以变形菌门、厚壁菌门为主,而后者肠道菌群组成更复杂(Wanget al.,2018;王娟等,2021),有利于消化更多种类的食物(Wanget al.,2019)。目前对肉食性鸟类肠道菌群的研究较少,现有结果显示其肠道菌群多样性较低(章娜中,2021),梭杆菌门丰度较高(高泽中,2020)。植食性和杂食性鸟类肠道菌群受季节影响显著(章娜中,2021),而肉食性鸟类肠道菌群的季节性差异不显著(Michelet al.,2018)。肠道菌群中一些菌群的存在往往与宿主特 殊 的 饮 食 相 适 应(de Carvalhoet al.,2003;Roggenbucket al.,2014;Ushidaet al.,2016;Michelet al.,2018)。与圈养个体相比较,野生日本岩雷鸟Lagopus muta japonica拥有更丰富多样的肠道菌群,且呈现部分特有菌群,这可能与其食用含植物毒素的食物有关(Ushidaet al.,2016)。
遗传因素:雌鸟的肠道微生物可以垂直遗传给子代,但这种影响是有限的(Kreisingeret al.,2017)。在实验控制和野生环境下,鸟类物种遗传距离与肠道菌群结构相似程度之间呈负相关(Ca‑punitanet al.,2020;Trevellineet al.,2020)。生活于同一区域的不同物种,虽然环境条件一致且存在肠道微生物的跨种传播,但其肠道菌群结构仍存在显著差异(Grondet al.,2014;杨预展,2016;Yang&Zhou,2021)。
年龄因素:野生鸟类肠道中特定微生物的相对丰度随年龄和时间的变化而变化(Spergseret al.,2018;Zhouet al.,2020)。即使在相同的环境下,不同年龄段的个体由于体内特异性环境或生理因素的差异,其核心肠道菌群差异显著(Gillinghamet al.,2019;Wanget al.,2020)。
性别和繁殖因素:不同性别和繁殖阶段的个体之间肠道菌群的差异与两性在整个繁殖季节行为和饮食的变化相一致(Gongoraet al.,2021)。鸟类在繁殖季节可能周期性地获得新的细菌,然后在非繁殖季节失去它们(Escallonet al.,2019)。这可能与繁殖活动需要大量的能量有关(尚伟平,2021)。
居留方式因素:迁徙鸟类在迁徙过程中会接触到各种外界环境,面临能量需求、环境压力、疾病免疫等方面的挑战,其肠道菌群的多样性可能高于留鸟(Riselyet al.,2017,2018;董元秋,2019)。
个体体型、健康状态等因素也影响着野生鸟类肠道菌群的建成。体型较大的雀形目鸟类个体间肠道菌群的差异更小,且与环境食物共享更少的微生物(Berlowet al.,2021a;Bodawattaet al.,2022b);腹泻个体与健康个体的肠道菌群结构差异显著(Xiet al.,2021)。
2.4.2 环境因素对肠道菌群的影响环境对野生鸟类肠道菌群建成的影响因素包括生物和非生物因素的差异(Hirdet al.,2014),即食物因素(赵广红,2016)、人为因素(Fuirstet al.,2018)、季节(Donget al.,2019)、地理因素(Looet al.,2019)和环境微生物因素(Xianget al.,2019)等。
食物因素:当鸟类饮食组成发生变化时,肠道微生物群落的Alpha 多样性不会发生显著变化,而Beta 多样性会发生显著变化(白头鹤Grus mona⁃cha:Zhaoet al.,2017;章 娜 中 ,2021;大 鸨Otis tarda:Luet al.,2021;青头潜鸭Aythya baeri:Xiet al.,2021;橙腹果鸠Ptilinopus iozonus:Bodawattaet al.,2022b)。这可能是由于虽然食物组成存在差异,但个体食性始终一致(章娜中,2021),食物的差异对鸟类肠道菌群的影响主要是针对一些特定的菌属,而不是对菌群整体的改变(Bodawattaet al.,2022b)。栖息生境的植被组成很大程度上决定了环境食物的复杂性,从而影响鸟类肠道菌群的多样性和组成(Drobniaket al.,2021;Goossenset al.,2022)。在食源丰富的生境中,鸟类肠道微生物的丰度和多样性通常更高(东方白鹳Ciconia boyci⁃ana:Wuet al.,2021;赤麻鸭Tadorna ferruginea:杜菲等,2022)。相似生境中的食物资源相似,因此鸟类肠道菌群的结构也更相似(杨竹青,2021;Zhanget al.,2021)。而在食物类型有限的生境下,鸟类肠道菌群结构简单(杜菲等,2022)、种间差异小(Wuet al.,2018)。
人为因素:频繁的人类活动、噪音污染等人为干扰加大了野生鸟类的生存压力,可能引起其免疫-体液调节系统的调整,从而导致肠道菌群的改变(Ber‑lowet al.,2021b)。人为干扰程度越高,对鸟类肠道菌群的影响程度越大(Knutieet al.,2019),可能导致肠道菌群多样性降低(Maulet al.,2005),而产生更多的潜在致病菌(Ushidaet al.,2016;顾晶晶,2021)。
季节、地理因素:季节和地理条件常通过影响食物间接影响鸟类肠道菌群(Davidsonet al.,2020)。季节更替使栖息地食物发生变化,可能导致鸟类肠道菌群出现季节性波动,冬季野生鸟类肠道微生物的Alpha 多样性更高(Zhanget al.,2020;Mahtabet al.,2021;Wanget al.,2021a);不同海拔、水热条件等地理因素改变了野生植被的类型,这可能促进了鸟类肠道菌群的分化(Looet al.,2019;Wanget al.,2020);农村生境中食物会发生季节性变化,这不仅会引起鸟类肠道菌群的季节性变化,还会增加鸟类定期获取新菌群的概率(Fuirstet al.,2018;Teyssieret al.,2018,2020),而城市对鸟类肠道菌群的效应也受环境中食物组成的影响,当城市环境可以提供多种营养时可以提高肠道微生物多样性,反之则会降低(Teyssieret al.,2018;Murrayet al.,2020)。
环境微生物因素:一方面,鸟类肠道菌群会受到食源性微生物(Davidet al.,2014;Bodawattaet al.,2022b)以及来自土壤(Yanget al.,2016;章娜中,2021)和巢穴(Ambrosiniet al.,2019;Gillinghamet al.,2019)中微生物的影响;另一方面,由于不同个体直接或间接的接触也会导致肠道菌群的种内传播(Kreisingeret al.,2017)和跨种传播(Gu & Zhou,2021;Wanget al.,2021b)。环境微生物对候鸟的影响较显著,即使只是短暂停歇也会导致鸟类肠道菌群与环境微生物的趋同(Turjemanet al.,2020)。此外,受流感病毒等微生物感染的鸟类肠道菌群也会出现显著变化(绿头鸭Anas platyrhynchos:Ganzet al.,2017;大天鹅Cygnus cygnus:Zhaoet al.,2018)。
2.4.3 内外因素共同影响肠道菌群宿主因素决定了种间差异,而不同生境也导致了肠道微生物结构的明显分化(Yanget al.,2016)。在长途迁徙过程中,虽然候鸟生存环境和饮食发生了明显变化,但其核心菌群基本保持稳定(Wuet al.,2018;王伟,2021;Zhaoet al.,2021),这可能是由于宿主核心菌群对肠道中微量的环境微生物具有特异性拮抗作用(Riselyet al.,2018;王伟,2021),因此鸟类肠道环境可以快速区分并选择定植的细菌群落(Gillinghamet al.,2019)。但部分研究结果与之相反,Hird 等(2014)研究发现,寄生于不同物种巢穴中发育成熟的成年棕头燕八哥Molothrus ater个体之间不存在一个共同的肠道核心菌群,这表明宿主内驱力作用可能并不显著;Goossens 等(2021)关于普通Sitta europaea的研究结果与之类似。这在一定程度上意味着多种生态因素对肠道菌群的综合影响可能超过了宿主因素的单一效应(Barbosaet al.,2016;Lewiset al.,2016;Grondet al.,2019)。可见,内外因素对野生鸟类肠道菌群建成的贡献程度目前尚无明确定论。
3 野生鸟类肠道菌群的生态适应
动物肠道菌群在生态适应方面表现出高度的可塑性(Weinhold,2022)。肠道菌群的动态变化可以通过提高消化效率、增强免疫能力、维持体内稳态等方式来提高宿主生存适应性。
3.1 肠道菌群适应宿主饮食的各种变化
饮食对肠道微生物群变化的影响是由饮食成分和宏观营养素共同驱动的(Bodawattaet al.,2021)。肠道菌群对宿主饮食差异高度敏感(Davidet al.,2014;吕小艳,2021),可以对宿主饮食的变化迅速作出反应(赵广红,2016),以促进宿主对特定生态位的适应,满足其对能量和营养的需求(Gonget al.,2021)。当宿主的饮食发生改变,肠道菌群的结构和功能也会随之改变(杨预展,2016;Liet al.,2021)。
肠道菌群对鸟类饮食季节性变化的适应。杂色山雀Sittiparus varius是杂食性鸟类,在夏季主要为肉食性,在春、冬季为植食性,其春、冬季肠道中的厚壁菌门丰度高于夏季(高泽中,2020),由于厚壁菌门在降解纤维方面起着关键作用(Flintet al.,2008),因此这种转变有利于改善鸟类对营养的吸收。白头鹤(Fuet al.,2020)、大鸨(Luet al.,2021)、灰鹤Grus grus(Pekarskyet al.,2021)的研究结果与之类似。
肠道菌群对鸟类越冬时期饮食变化的适应。白头鹤在越冬前期以稻谷为主要食物,肠道中主要以参与植物蛋白质分解代谢的普氏菌属Prevotella为优势菌,而在以高纤维植物为主要食物的越冬中后期,具有降解肠道中纤维素作用的梭菌属Clos⁃tridium为优势菌(赵广红,2016)。白头鹤(Zhanget al.,2021)、黑 颈鹤Grus nigricollis(Zhaoet al.,2021)的研究结果与之相似。
肠道菌群对鸟类在复杂生境中饮食多样化的适应。相较于野生类群和圈养类群,半圈养斑头雁群体中有大量拟杆菌门出现,而拟杆菌门具有高度可塑性,可以很快地适应各种生态位(董元秋,2019)。因此肠道菌群的这种转变可能有助于斑头雁适应野生和人工不同的食物资源,使宿主肠道能够在不同能量消化模式之间轻松切换(Wanget al.,2016a)。在越冬早期,候鸟肠道菌群多样性通常丰富且多变,这可能由于在长途飞行后肠道建立了对新环境的耐受性和适应性,以最大效率消化食物、补充能量(Zhaoet al.,2021)。
3.2 肠道菌群适应长途飞行的生理挑战
候鸟在迁徙飞行期间会面临能量、免疫等方面的生理挑战(张政,2021),它们已经进化出一系列与迁徙习性相适应的生理特征,而肠道菌群的改变是其适应长途飞行的潜在机制之一(Riselyet al.,2018)。
候鸟长途飞行期间处于长期禁食状态,研究结果显示,长途飞行时鸟肠道中厚壁菌门的丰度增加(加拿大黑雁Branta canadensis:Obrochtaet al.,2022),或厚壁菌门与拟杆菌门丰度比(F/B)升高(白头鹤:付蓉,2020;大天鹅:Wanget al.,2021a)。这可能是由禁食产生的压力信号所引起,当动物面对环境压力产生应激反应时通常会分泌糖皮质激素(Martin&Reale,2008),而糖皮质激素的分泌会导致鸟类肠道菌群的改变(Nogueraet al.,2018)。肠道菌群对宿主压力信号的响应可能是其帮助鸟类适应长途飞行的基础(Turjemanet al.,2020)。
在适应能量需求方面,研究表明厚壁菌门的基因编码了许多与能量代谢相关的酶,这些消化酶可以代谢各种物质(Kaakoush,2015),而F/B 的增加会提高机体代谢脂肪的能力,增加肠道吸收营养和转化能量的能力(Bäckhedet al.,2005;Ya‑davet al.,2021)。因此,肠道菌群的这种转变有利于宿主消化吸收营养物质,提高宿主能量代谢的效率(Kaakoush,2015;Wanget al.,2018)。
在适应疾病免疫方面,糖皮质激素的增加可能降低了宿主对机会性病菌的易感性(Dhabhar,2009),F/B 的增加可以显著地抑制肠道致病菌的定植(Heet al.,2019)。Davies 等(2022)的研究表明,宿主免疫系统可以通过调节肠道微生物组来调节宿主的健康,微生物组也可能影响免疫基因的选择性表达。因此,肠道菌群的这种转变有利于提高宿主免疫能力,宿主与肠道菌群的相互作用可能在维持鸟类功能性免疫遗传变异中发挥重要作用。
除此之外,值得关注的是候鸟肠道中棒状杆菌属Corynebacterium丰度显著高于留鸟(如红颈滨鹬Calidris ruficollis:Riselyet al.,2017;弯嘴滨鹬Calidris ferruginea:Riselyet al.,2018;家燕Hirundo rustica:Turjemanet al.,2020)。在同一圈养环境下生长的15 种鹤科Gruidae 鸟类中,短途迁徙物种蓝蓑羽鹤Anthropoides paradiseus肠道中棒状杆菌属丰度较其他长途迁徙物种的更低(Trevellineet al.,2020)。这可能意味着棒状杆菌参与了候鸟与微生物的功能性相互作用,使候鸟在迁徙过程中最大限度地增加脂肪沉积和能量摄入(Riselyet al.,2018)。
3.3 肠道菌群适应生境扰动的生存挑战
由于人类活动范围的扩张和强度的增加,栖息生境破碎、气候变化、噪声污染、光污染等一系列环境问题都导致了野生鸟类巨大的生存压力(Bestionet al.,2017;Zhaoet al.,2017;姜 俊霞 ,2019;Berlowet al.,2021a,2021b)。为了缓解生存压力,许多鸟类通过调整自身行为或免疫系统,间接影响了肠道菌群的组成,从而提高了自身生存能力。
面对栖息生境破坏,鸟类会不断调整觅食策略(Weiet al.,2020),而其多变的肠道菌群可能是水鸟面对湿地资源流失的一种适应机制(Donget al.,2019;章娜中,2021)。此外,一些鸟类肠道内还发现了抗有机污染物的细菌(栗斑腹鹀Emberiza jankowskii:尚伟平,2021)。
面对城市化,鸟类对城市栖息地的使用和饮食的变化显著改变了其肠道微生物的组成和多样性,如银鸥Larus argentatus(Fuirstet al.,2018)、麻雀Passer domesticus(Teyssieret al.,2018;Gadauet al.,2019),这可能导致鸟类更容易感染病原菌(Mur‑rayet al.,2020)。肠道菌群多样性与肠道中病原菌之间存在负相关(Xianget al.,2019),肠道微生物可能通过竞争作用以及与宿主免疫系统的相互作用,抵御病原菌的定植,以保护宿主的健康(Lawleyet al.,2008;Murrayet al.,2020;Craftet al.,2022)。
双色树燕Tachycineta bicolor通过与免疫系统更好地耦联作用,调节自身对热的敏感性,以更好地适应热环境(Ingalaet al.,2021),这可能是一些鸟类应对气候变化的一种潜在机制。高海拔安氏蜂鸟Calypte anna肠道菌群中的拟杆菌门丰度为低海拔的7.0 倍,通过降低肠道中好氧菌丰度可能是一些鸟类应对人类活动造成其活动海拔升高的一种潜在机制(Herderet al.,2021)。噪音似乎能直接作用于肠道菌群使其多样性升高(Berlowet al.,2021b),而肠道菌群多样性越高,通常意味着机体对环境扰动的恢复能力越强(Teyssieret al.,2018),这可能是一些鸟类应对噪音污染的一种潜在机制。
4 总结展望
当前研究对野生鸟类肠道菌群的认识不断深入,但与哺乳动物肠道菌群的研究相比,有关野生鸟类肠道菌群的研究仍然有一定距离(Kohl,2012)。基于现有研究,提出以下建议:(1)建立统一、系统的样品采集方法,样本容量、采样方式、取样部位、储存方法的差异均会对肠道菌群检测结果造成影响(Bodawattaet al.,2018;Drovetskiet al.,2018;Videvallet al.,2018;Vargas-Pelliceret al.,2019);(2)加强肠道菌群宏基因组学和代谢组学的研究,明确肠道微生物的生态功能,揭示宿主与肠道菌群相互作用的内在机制;(3)拓展研究物种范围,不断丰富完善鸟类肠道菌群的背景信息,并与人类和其他脊椎动物肠道菌群开展比较研究,深化对宿主-肠道微生物协同进化的认识;(4)增加多地区、多时期、多物种的对比研究,综合探讨内外因素对野生鸟类肠道菌群的影响机制,明确肠道微生物、宿主和环境三者之间的相互关系。
