方斑东风螺3个选育世代遗传多样性和遗传结构的微卫星分析
2022-11-26付敬强沈铭辉游伟伟柯才焕
梁 园, 付敬强, 沈铭辉, 骆 轩, 游伟伟, 柯才焕
方斑东风螺3个选育世代遗传多样性和遗传结构的微卫星分析
梁 园1, 3, 付敬强2, 3, 沈铭辉4, 骆 轩1, 3, 游伟伟1, 3, 柯才焕1, 3
(1. 厦门大学 海洋与地球学院, 福建 厦门 361102; 2. 厦门大学 环境与生态学院, 福建 厦门 361102; 3. 厦门大学 福建省海洋经济生物遗传育种重点实验室, 福建 厦门 361102; 4. 海南省海洋与渔业科学院 海南省热带海水养殖技术重点实验室, 海南 海口 571126)
采用12个多态性微卫星标记对方斑东风螺()泰国选育系TF4~TF6连续3代选育群体的遗传多样性与遗传结构进行了分析。3个群体的多态信息含量分别为0.730、0.717和0.708, 均高于0.5, 表现出较高的多态性。平均等位基因数()、有效等位基因数(e)、观测杂合度(o)、期望杂合度(e)和Shannon’s信息指数()的变化范围分别为11.667~12.583、6.334~6.915、0.658~0.672、0.737~ 0.787和1.837~2.003, 整体呈降低趋势, 但差异并不显著(>0.05)。分子方差分析结果显示, 群体间的遗传变异仅占总变异的0.95%; 群体间的遗传分化系数(st)介于0.00569~0.01324, 处于低等分化水平(st0.05)。主坐标分析和STRUCTURE分析结果显示, 3个群体呈现出相似的遗传背景和遗传结构。以上研究结果表明, 经过连续多代的人工选育, 方斑东风螺选育群体保持着较高的遗传多样性水平, 遗传变异和遗传分化水平较低, 遗传结构趋于稳定, 仍具有较高的遗传选育潜力。
方斑东风螺(); 选育群体; 微卫星标记; 遗传多样性; 遗传结构
方斑东风螺()俗称花螺, 是生活于热带、亚热带海域的腐肉食性浅海底栖腹足类动物[1], 在中国主要分布于海南、广东、广西、福建和台湾等东南沿海地区[2, 3]。方斑东风螺不仅生长速度快, 肉质鲜美, 氨基酸含量高, 还富含人体所需的EPA和DHA[1], 深受消费者的喜爱。目前, 方斑东风螺已成为中国重要的经济贝类养殖品种[4, 5]。随着其养殖业的快速发展, 养殖过程中个体大小差异大, 生长速度减缓, 抗逆性差以及病害频发等问题日益突出[4, 6], 因此, 培育出生长速度快、抗逆性强的方斑东风螺优良养殖品种具有十分重要的意义。
选择育种作为一种传统的育种方法, 能够有效改善育种目标性状[7]。在人工选育过程中, 部分不利基因被淘汰, 与目标性状相关的基因逐渐趋向于纯合, 选育群体的遗传结构逐渐趋向于稳定, 遗传基础会逐渐得到纯化[8-10]。但与此同时, 选育可能导致群体遗传多样性水平出现不同程度的下降, 而较低的遗传多样性则不利于物种的生存和适应[11-13]。为了对方斑东风螺进行遗传改良, 从2011年开始, 本实验室对其开展了生长性状相关的群体选择育种研究。此前, FU等[14]对该选育系TF0-TF33代选育群体进行了遗传多样性分析, 结果表明, 经过连续3代的人工选育, 选育群体的遗传多样性水平略有下降, 但差异不显著。但是, 再次经过连续3代的选育, 该选育系各世代群体的遗传多样性水平变化如何, 目前并不清楚。
微卫星标记具有种类多、分布广、多态信息含量高、操作简单等优点[15], 已被广泛应用于大黄鱼()[8]、刺参()[16]、太平洋牡蛎()[17]、文蛤()[18]、海湾扇贝()[19]、马氏珠母贝()[20]等水产动物的遗传多样性分析。为了解人工选育对方斑东风螺泰国选育群体TF4~TF6分子遗传水平上产生的影响, 本研究采用12个微卫星标记对这3代选育群体的遗传多样性和遗传结构进行分析, 以期为进一步的良种选育和遗传改良提供理论指导。
1 材料与方法
1.1 实验材料
从2011年开始, 本实验室针对生长性状开展了连续6代的群体选择育种研究。本研究所用到的选育群体(TF4、TF5、TF6)是2017—2020年连续3代从生长快的个体中截留亲本选育而成, 选择强度为10%, 具体方法见FU[14]的报道。从每代选育群体中随机选取30个6月龄的样品, 取适量腹足肌于无水乙醇中脱水保存备用。
1.2 实验内容与方法
1.2.1 基因组DNA的提取
使用AxyPrep基因组DNA小量试剂盒提取方斑东风螺的基因组DNA。利用1%的琼脂糖凝胶电泳检测DNA的完整性, 使用NanoDrop 2000紫外分光光度计检测DNA的浓度与纯度, 于–20℃保存备用。
1.2.2 微卫星引物的筛选
从已报道的文献[14, 21-23]中筛选出12对多态性较好的微卫星引物用以遗传多样性分析。利用FAM、HEX和ROX 3种不同颜色的荧光在上游引物的5’端进行标记, 荧光引物由上海生工生物工程有限公司合成。引物的详细信息见表1。
1.2.3 PCR扩增与检测
PCR反应体系体积为25 μL, 包括: 10×PCR Buffer (含Mg2+)5.0 μL、dNTPs (10 mmol/L) 2.0 μL、上游引物(10 mmol/L) 1.0 μL、下游引物(10 mmol/L) 1.0 μL、rTaq DNA Polymerase (5 U/μL) 0.25 μL、模板DNA 2.0 μL和ddH2O 13.75 μL。
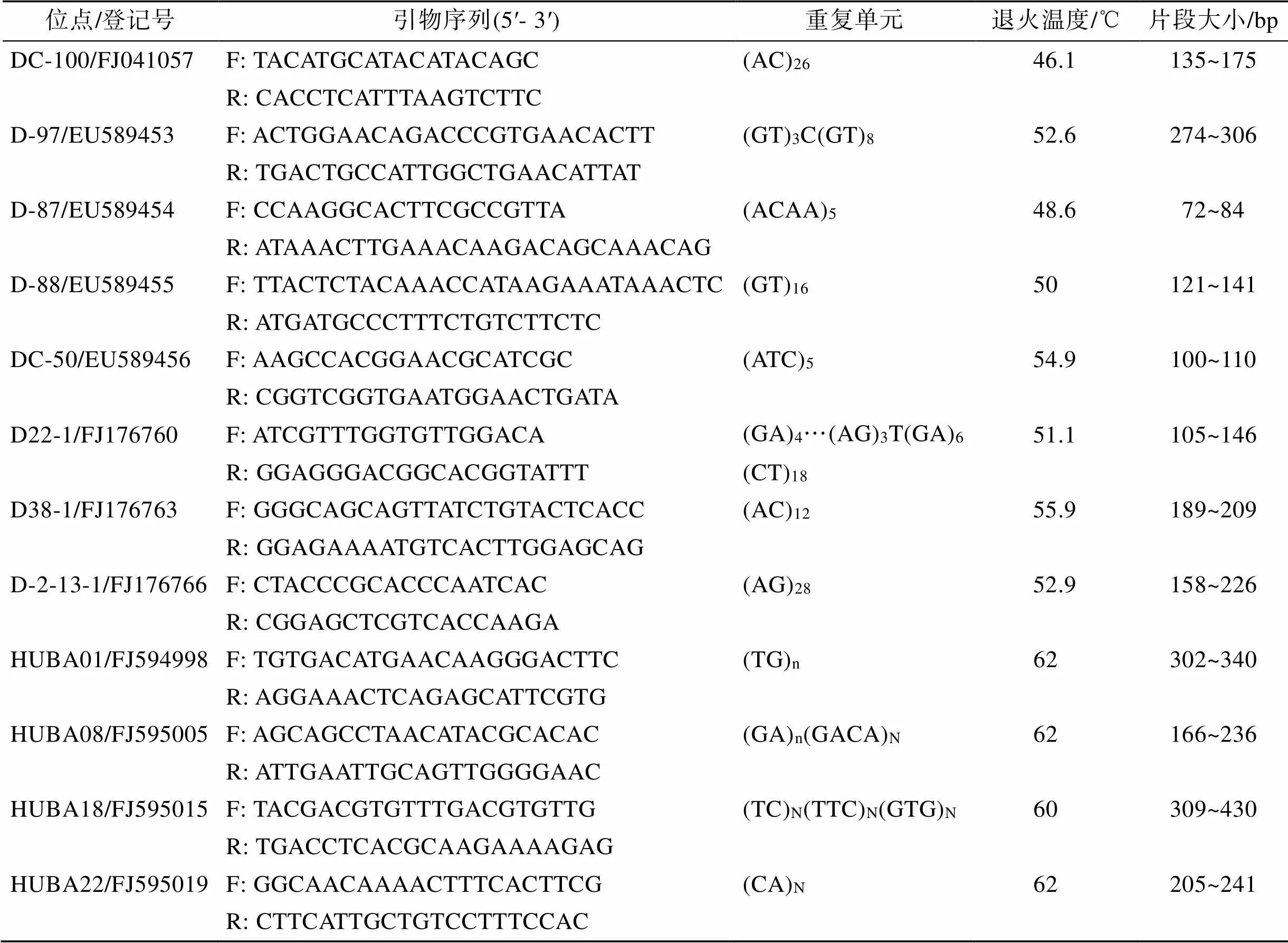
表1 12对微卫星引物信息表
F. forward primer, 上游引物; R. reverse primer, 下游引物; N. pure, 连续的微卫星序列; n. interrupted, 有间隔的微卫星序列
PCR反应程序为: 94 ℃ 3 min; 94 ℃ 30 s, 退火温度30 s(引物退火温度见表1), 72 ℃ 1 min, 30个循环; 72 ℃ 10 min; 4 ℃保温。
PCR产物经1%的琼脂糖凝胶电泳检测后, 将其置于凝胶成像系统中观察是否扩增出目的片段。将PCR扩增产物送往上海生工生物工程有限公司, 使用ABI 3500xl基因分析仪进行毛细管电泳, 检测荧光信号; 使用软件GeneMapper ID v3.2分析微卫星位点的片段长度[14]。
1.2.4 数据分析
使用GenAlEx v6.5[24]计算等位基因数(number of alleles,)、有效等位基因数(effective number of alleles,e)、观测杂合度(observed heterozygosity,o)、期望杂合度(expected heterozygosity,e)、Shannon’s信息指数(Shannon’s information index,)和固定系数(fixation index,)。使用PIC-CALC 0.6软件计算多态信息含量(polymorphism information content,)。使用NeEstimator v2.0.1[25], 采用连锁不平衡方法(linkage disequilibrium method)[26]和卡方检验估算有效群体大小(effecttive population size,e), 最低等位基因频率取0.01。
使用Arlequin v3.5[27]进行分子方差分析(analysis of molecular variance, AMOVA), 计算群体间遗传分化指数(st)。使用GenAlEx 6.5软件[24]进行主坐标分析(principal coordinates analysis, PCoA)。使用STRUCTURE v2.3.4[28]分析群体遗传结构, 采用混合模型(admixture model), 设定群体间等位基因频率相关; 设置值为1到3, 每个值重复估算10次; 设定运行参数MCMC的不作数迭代(lenth of Burnin period)为100 000次, 迭代后的MCMC (number of MCMC reps after Burnin)为500 000次。使用CLUMPP 1.1.2[29]进行重复抽样分析, 并使用Distruct 1.1[30]将其结果转化为图形。
2 结果
2.1 遗传多样性
12对微卫星引物在连续3代选育群体(TF4、TF5和TF6)中共扩增获得188个等位基因, 每个群体检测到的总等位基因数分别为146、151和140, 每个微卫星位点的等位基因数介于4~34。3个群体的遗传多样性参数如表2所示, 多态信息含量()分别为0.730、0.717和0.708, 均表现出较高的多态性(>0.5)[31]。另外, 等位基因数()、有效等位基因数(e)、观测杂合度(o)、期望杂合度(e)和Shannon’s信息指数()的范围分别为11.667±2.061~12.583±1.869、6.334±1.366~6.915±1.274、0.658±0.072~0.672±0.059、0.737±0.058~0.787±0.039和1.837±0.224~2.003±0.187。3个群体的平均观测杂合度(o)均低于对应的平均期望杂合度(e), 且平均固定系数()均大于0(表2), 表明存在杂合子缺失的情况。总的来说, 经过连续3代的选育, 各遗传多样性参数的大小整体呈降低趋势, 但世代间的差异并不显著(>0.05)。

表2 方斑东风螺3个群体的遗传多样性参数
注: a.同一字母表示群体间差异不显著(>0.05)
此外, 获得3个群体的有效群体大小(e)如表3所示, TF4~TF6依次为无穷大、223.0和628.9。
2.2 遗传分化与变异
利用分子方差分析(AMOVA)和遗传分化系数(st)对3个群体间的遗传变异与遗传分化进行分析。AMOVA结果见表4, 绝大部分变异来源于各群体内部(99.05%), 群体间的变异仅占总变异的0.95%。群体间的遗传分化系数(st)介于0.005 69~ 0.013 24(表5), 其中TF4与TF5的遗传分化水平最高(st=0.013 24), TF5与TF6的遗传分化水平最低(st=0.005 69)且差异不显著。根据White对遗传分化系数的界定[32], 3个群体的遗传分化均处于低等水平(st0.05)。
2.3 遗传结构变化
利用主坐标分析(PCoA)比较3个群体的遗传聚类(图1)。所有个体重叠交错分布, 群体间未表现出明显的分离现象。STRUCTURE分析结果(图2)显示,=2或=3时, 3个群体均表现出相似的遗传背景。遗传分化和遗传结构的分析结果保持一致, 即3个群体间的遗传差异较小, 遗传结构趋于稳定。

表3 方斑东风螺3个群体的有效群体大小(Ne)

表4 方斑东风螺3个群体的分子方差分析(AMOVA)
ST= 0.00953;<0.01

表5 方斑东风螺3个群体的遗传分化系数(Fst)
**.<0.01; ns.>0.05

图1 方斑东风螺3个群体的主坐标分析(PCoA)

图2 方斑东风螺3个群体的STRUCTURE分析
3 讨论
遗传多样性是生物多样性的核心[33], 一般来说, 种群的遗传多样性越高, 其适应环境的能力越强, 相应的选育潜力也越大[34]。在针对生长性状的人工选育过程中, 目的性状相关基因会不断趋于纯合[35-37], 同时部分与适应性和抗逆性相关的等位基因很容易丢失, 选育群体的遗传多样性可能会有所下降, 甚至发生近交衰退而失去继续选育的价值[38]。选育群体的遗传多样性水平随着选育世代的推进而不断下降的现象在太平洋牡蛎[39]、马氏珠母贝[40]、中国对虾()[41]、罗氏沼虾()[42]、尼罗罗非鱼()[43-44]等水产动物中均有报道。此前FU等[14]对方斑东风螺海南和泰国两个选育系(HT0~HT3, TH0~TH3)的遗传多样性水平进行了比较分析, 结果显示选育群体存在微弱但不显著的下降趋势。因此, 有必要继续对方斑东风螺人工选育过程中各世代群体遗传多样性的变化进行监测。
有效等位基因数和期望杂合度等参数是衡量选育群体遗传多样性水平的重要指标[45]。本研究中, 由遗传多样性参数所揭示的3个群体的遗传多样性水平接近, 相比于TF4和TF5, TF6的遗传多样性水平略有下降, 但群体间的差异并不显著(>0.05), 3个群体均保持着较高的遗传多样性水平。此前, FU等[14]利用10对微卫星标记获得了TF0~TF34个群体的遗传多样性参数, 其中等位基因数、有效等位基因数和Shannon’s信息指数的变化范围分别为8.10±0.89~ 10.30±1.32、4.26±0.48~5.22±0.90和1.62±0.13~1.78±0.17;而本研究中TF4~TF6对应参数的变化范围分别为11.667±2.06~12.583±1.869、6.334±1.366~6.915±1.274和1.837±0.224~2.003±0.187, 高于TF0~TF3。本研究使用了12对微卫星标记, 与TF0~TF3相比有所增加, 微卫星标记数量和多态性的不同有可能是TF4~TF6部分遗传多样性参数升高的原因[46-48]。此外, 在养殖或选育群体中, 相比于等位基因数和有效等位基因数, 短时间内外界环境因素对杂合度的影响更小[39, 49]。NEI[50]认为, 在小群体中, 期望杂合度是度量群体遗传变异的最适参数。本研究中, TF4~TF6的期望杂合度(0.737±0.058~0.787±0.039)未表现出明显的下降趋势, 并且与TF0~TF3的水平较一致(0.726±0.040~ 0.759±0.028)。由此可见, 再次经过连续3代的人工选育, 方斑东风螺泰国选育群体仍保持着较高的遗传多样性水平, 具有一定的遗传选育潜力。
有效群体大小往往是影响群体近交率和遗传漂变率的重要参数[12]。在连续多代的人工选育过程中, 不合理的育种操作常常会引起选育群体有效群体数量下降而近交几率上升[51]。为了解有效群体大小对遗传多样性变化的影响, LIND等[52]在珠母贝(.)的3个野生群体与5个人工培育群体中进行了比较分析, 发现两种群体的有效群体大小变化范围分别为109.6~432.4和3.5~9.2, 而等位基因丰富度的变化范围分别为12.6±1.4~14.0±1.2和7.5±1.1~9.4±1.4, 人工培育群体的等位基因丰富度与野生群体相对比减少了29%~44%。另外, 在南非鲍()的选择育种中, 当有效群体大小从F1的471.6减少到F2的52.5时, F2的等位基因大约减少了30%[53]。在FU等[14]的前期研究中, TF0~TF3的有效群体大小e从最初的436.0逐渐降至151.8, 且选育群体遗传多样性的降低并不显著。而本研究中TF4~TF6的有效群体大小的变化为无穷大、223.0和628.9, 相对于TF3有所增加, 这可能是3个群体保持较高遗传多样性的原因之一。维持一定的有效群体数量能够在一定程度上降低近交和遗传多样性损失所带来的负面影响[49], 因此, 在后续的选育过程中仍需重视有效群体数量的管理。
众多研究表明, 在选择压力的驱动下, 选育群体相邻世代间的遗传分化会逐渐减弱, 遗传相似性逐渐升高, 遗传结构与选育性状会逐渐稳定[8, 37, 38]。本研究中3个群体整体的遗传变异(0.95%)和遗传分化水平(ST= 0.00953)很低, TF5与TF6的遗传分化水平(st: 0.00569,0.05)与TF0~TF3中相邻世代(st: 0.0103~0.0308)相比明显下降[14]。此外, PCoA分析和STRUCTURE分析的结果均显示出3个群体在遗传结构上的相似性。由此可知, 经过连续多代的人工选育, 方斑东风螺选育群体的遗传分化和遗传变异水平逐渐降低, 遗传结构逐渐趋于稳定, 经进一步选育可望获得较稳定的品系。
4 结论
本研究利用12对微卫星标记对方斑东风螺3代选育群体(TF4~TF6)的遗传多样性与遗传结构进行了分析比较。结果显示, 方斑东风螺选育群体的遗传多样性水平较高且未表现出明显的下降趋势, 遗传变异与遗传分化水平较低, 遗传结构趋于稳定。连续多代的人工选育并未对其遗传多样性和遗传结构造成不利影响, 该选育群体仍具有较高的遗传选育潜力。在后续的选育进程中, 可继续保持一定的选择强度, 同时应注意增加有效亲本的数量, 减少近交发生的几率, 从而确保方斑东风螺优良性状的稳定遗传。
[1] 许贻斌, 沈铭辉, 魏永杰, 等. 两种东风螺的营养成分分析与评估[J]. 台湾海峡, 2008, 27(1): 26-32.
XU Yibin, SHEN Minghui, WEI Yongjie, et al. Analysis and evaluation of nutritional composition ofLink and[J]. Journal of Ocreanography in Taiwan Strait, 2008, 27(1): 26-32.
[2] 陈利雄, 吴进锋. 东风螺的增养殖技术及产业化前景[J]. 齐鲁渔业, 2004, 21(10): 9-11.
CHEN Lixiong, WU Jinfeng. Culture technique and industrial prospect of ivory shell[J]. Shandong Fisheries, 2004, 21(10): 9-11.
[3] 张汉华, 吴进锋, 陈利雄, 等. 东风螺人工育苗、养殖及产业化发展前景[J]. 南方水产科学, 2004, 11: 2-5.
ZHANG Hanhua, WU Jinfeng, CHEN Lixiong, et al. Development prospect of artificial seedling, breeding and industrialization of[J]. South China Fisheries Science, 2004, 11: 2-5.
[4] 沈铭辉, 符芳霞, 吕文刚, 等. 海南省东风螺养殖产业现状和展望[J]. 安徽农业科学, 2015, 43(26): 144- 145.
SHEN Minghui, FU Fangxia, LV Wengang, et al. The current situation ofspp. farming industry in Hainan and prospect outlook[J]. Journal of Anhui Agriculture Sciences, 2015, 43(26): 144-145.
[5] 梁飞龙, 毛勇, 余祥勇, 等. 方斑东风螺人工育苗试验[J]. 海洋湖沼通报, 2005, 1(14): 79-85.
LIANG Feilong, MAO Yong, YU Xiangyong, et al. Experiment on artificial breeding of(Lamarck)[J]. Transactions of Oceanology and Limnology, 2005, 1(14): 79-85.
[6] 王菁, 刘付柏, 许尤厚, 等. 基于转录组测序的方斑东风螺单核苷酸多态性位点挖掘及功能注释[J]. 广东海洋大学学报, 2021, 21(1): 111-118.
WANG Jing, LIU Fubo, XU Youhou, et al. SNP site biological analysis ofbased on RNA-seq technology[J]. Journal of Guangdong Ocean University, 2021, 21(1): 111-118.
[7] 张守都. 海湾扇贝的选择和杂交育种[D]. 青岛: 中国科学院海洋研究所, 2013.
ZHANG Shoudu. Selective and crossing breeding of Bay scallop,(Lamarck)[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2013.
[8] 赵广泰, 刘贤德, 王志勇, 等. 大黄鱼连续4代选育群体遗传多样性与遗传结构的微卫星分析[J]. 水产学报, 2010, 34(4): 500-507.
ZHAO Guangtai, LIU Xiande, WANG Zhiyong, et al. Genetic structure and genetic diversity analysis of four consecutive breeding generations of large yellow croaker () using microsatellite markers[J]. Journal of Fisheries of China, 2010, 34(4): 500- 507.
[9] 郭红军, 罗洁, 洪一江, 等. 人工选育池蝶蚌的生长及不同世代遗传分析[J]. 水生生物学报, 2008, 32(2): 220-224.
GUO Hongjun, LUO Jie, HONG Yijiang, et al. Growth and genetic analysis on the selected breeding[J]. Acta Hydrobiologica Sinica, 2008, 32(2): 220-224.
[10] 郑荷子, 易提林, 梁旭方, 等. 翘嘴鳜连续4代选育群体遗传多样性及遗传结构分析[J]. 淡水渔业, 2013, 43(6): 8-12.
ZHENG Hezi, YI Tilin, LIANG Xufang, et al. Genetic structure and genetic diversity analysis of four conescutive breeding generations of[J]. Freshwater Fisheries, 2013, 43(6): 8-12.
[11] 于爱清, 施永海, 邓平平. 长江刀鲚选育和野生群体遗传多样性的微卫星分析[J]. 水产科技情报, 2019, 46(3): 121-125.
YU Aiqing, SHI Yonghai, DENG Pingping. Microsatellite analysis of genetic diversity of wild population and selection ofin the Yangtze River[J]. Aquatic Science and Technology Information, 2019, 46(3): 121-125.
[12] CHEN N, LUO X, LU C K, et al. Effects of artificial selection practices on loss of genetic diversity in the Pacific abalone,[J]. Aquaculture Research, 2017, 48(9): 4923-4933.
[13] XU L, LI Q, XU C X, et al. Genetic diversity and effective population size in successive mass selected generations of black shell strain Pacific oyster () based on microsatellites and mtDNA data[J]. Aquaculture, 2019, 500: 338-346.
[14] FU J Q, LV W G, LI W D, et al. Comparative assessment of the genetic variation in selectively bred generations from two geographic populations of ivory shell ()[J]. Aquaculture Research, 2017, 48(8): 1-14.
[15] 黎裕, 贾继增, 王天宇. 分子标记的种类及其发展[J]. 生物技术通报, 1999, 4: 19-22.
LI Yu, JIA Jizeng, WANG Tianyu. Types of molecular markers and their development[J], Biotechnology Information, 1999, 4: 19-22.
[16] 孙孝德, 孙国华, 袁延柱, 等. 刺参()野生及两代选育群体间遗传变异的微卫星标记研究[J]. 海洋与湖沼, 2016, 85(1): 92-99.
SUN Xiaode, SUN Guohua, YUAN Yanzhu, et al. Genetic variations of wild and selectively bred populations of a sea cucumber[J]. Oceanologia et Limnologia Sinica, 2016, 85(1): 92-99.
[17] 王庆志, 孔令锋, 李琪.长牡蛎3代人工选育群体的微卫星分析[J]. 水产学报, 2012, 36(10): 1529-1536.
WANG Qingzhi, KONG Lingfeng, LI Qi. Genetic variability assessed by microsatellites in mass selection lines of Pacific oyster ()[J]. Journal of Fisheries of China, 2012, 36(10): 1529-1536.
[18] 郑培. 文蛤三个选育世代的多样性研究[D]. 上海: 上海海洋大学, 2013.
ZHENG Pei. Genetic diversity analisis of three generations of selective breeding of[D]. Shanghai: Shanghai Ocean University, 2013.
[19] WANG L L, ZHANG H, SONG L S, et al. Loss of allele diversity in introduced populations of the hermaphroditic bay scallop[J]. Aquaculture, 2007, 271(1/4): 252-259.
[20] 王爱民, 王嫣, 顾志峰, 等. 马氏珠母贝()2个地理群体杂交子代的杂种优势和遗传变异[J]. 海洋与湖沼, 2010, 41(1): 140-146.
WANG Aimin, WANG Yan, GU Zhifeng, et al. Heterosis and genetic variation of hybrids from two geographical populations of pearl oyster,[J]. Oceanologia et Limnologia Sinica, 2010, 41(1): 140-146.
[21] CHEN F, KE C H, WANG D X, et al. Isolation and characterization of microsatellite loci inand cross-species amplification in[J]. Molecular Ecology Resources, 2009, 9(2): 661-663.
[22] WANG Y, LU H, ZHENG J, et al. Eight polymorphic microsatellite markers for the spotted babylon,(Buccinidae)[J]. Genetics & Molecular Research, 2011, 10(4): 3230-3235.
[23] ZHANG N, YING Q, HUANG X Z, et al. Microsatellite marker development and characterization in the spotted babylon,(Link, 1807): detection of duplicated loci at high frequency[J]. International Journal of Aquaculture, 2012, 2(2): 5-10.
[24] PEAKALL R, SMOUSE P E. GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research-an update[J]. Bioinformatics, 2012, 28(19): 2537-2539.
[25] DO C, WAPLES R S, PEEL D, et al. NeEstimator v2: re-implementation of software for the estimation of contemporary effective population size (e) from genetic data[J]. Molecular Ecology Resources, 2014, 14(1): 209-214.
[26] WAPLES R S. A bias correction for estimates of effective population size based on linkage disequilibrium at unlinked gene loci[J]. Conservation Genetics, 2006, 7(2): 167-184.
[27] EXCOFFIER L, LISCHER H. Arlequin suite ver 3.5: a new series of programs to perform population genetics analyses under Linux and Windows[J]. Molecular Ecology Resources, 2010, 10(3): 564-567.
[28] EARL D A, VONHOLDT B M. Structure harvester: a website and program for visualizing structure output and implementing the evanno method[J]. Conservation Genetics Resources, 2012, 4(2): 359-361.
[29] JAKOBSSON M, ROSENBERG N A. Clumpp: a cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure[J]. Bioinformatics, 2007, 23(14): 1801-1806.
[30] ROSENBERG N A. Distruct: a program for the graphical display of population structure[J]. Molecular Ecology Notes, 2003, 4(1): 137-138.
[31] BOTSTEIN D, WHITE R L, SKOLNICK M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980, 32(3): 314.
[32] WRIGHT S. Variability within and among natural populations[M]. Chicago: University of Chicago Press, 1978.
[33] 钱迎倩. 生物多样性研究的原理与方法[M]. 北京: 中国科学技术出版社, 1994.
QIAN Yingqian. Principles and methods of biodiversity research[M]. Beijing: Science and Technology of China Press, 1994.
[34] 马静, 安永平, 王彩芬, 等. 遗传多样性研究进展[J]. 陕西农业科学, 2010, 56(1): 126-130.
MA Jing, AN Yongping, WANG Caifen, et al. Advances in genetic diversity research[J]. Shaanxi Agricultural Sciences, 2010, 56(1): 126-130.
[35] 张进, 梁旭方, 杨敏, 等. 2个鳜鱼选育群体遗传多样性分析[J]. 水产科学, 2014, 33(7): 447-450.
ZHANG Jin, LIANG Xufang, YANG Min, et al. Genetic structure and genetic diversity analysis of artifitial selection populations of mandarin fish[J]. Fisheries Science, 2014, 33(7): 447-450.
[36] 马春艳, 马洪雨, 马凌波, 等. 凡纳滨对虾引进群体和2个养殖群体遗传变异的微卫星分析[J]. 海洋渔业, 2011, 31(1): 1-8.
MA Chunyan, MA Hongyu, MA Lingboet al. Microsatellite analysis on genetic variation of importedpopulation and cultured stocks[J]. Marine Fisheries, 2011, 31(1): 1-8.
[37] YI T L, GUO W J, LIANG X F, et al. Microsatellite analysis of genetic diversity and genetic structure in five consecutive breeding generations of mandarin fish(Basilewsky)[J]. Genetics and Molecular Research, 2015, 14(1): 2600-2607.
[38] 马冬梅, 苏换换, 朱华平, 等. 华南鲤选育群体不同世代遗传多样性与遗传结构的微卫星分析[J]. 水生生物学报, 2018, 42(5): 887-895.
MA Dongmei, SU Huanhuan, ZHU Huaping, et al. Genetic diversity and genetic structure analysis of different selective breeding generations inusing microsatellite markers[J]. Acta Hydrobiologica Sinica, 2018, 42(5): 887-895.
[39] HAN Z Q, LI Q, LIU S K, et al. Genetic variability of an orange-shell line of the Pacific oysterduring artificial selection inferred from microsatellites and mitochondrial COI sequences[J]. Aquaculture, 2019, 508(May): 159-166.
[40] 管云雁, 刘文广, 何毛贤. 马氏珠母贝选育群体4个世代的遗传变异[J]. 中国水产科学, 2013, 20(4): 764-770.
GUAN Yunyan, LIU Wenguang, HE Maoxian. Genetic variation during four generations of selective breeding in the pearl oyster[J]. Journal of Fishery Sciences of China, 2013, 20(4): 764-770.
[41] LI Z X, LI J, WANG Q Y, et al. The effects of selective breeding on the genetic structure of shrimppopulations[J]. Aquaculture, 2006, 258(1/4): 278-282.
[42] 董丁健, 戴习林. 罗氏沼虾不同群体世代遗传多样性的SSR分析[J]. 南方农业学报, 2020, 51(2): 421-428.
DONG Dingjian, DAI Xilin. SSR analysis on genetic diversity in different populations and generations of[J]. Journal of Southern Agriculture, 2020, 51(2): 421-428.
[43] 唐首杰, 李思发, 赵金良.“新吉富”罗非鱼选育后期世代遗传潜力的微卫星分析[J]. 海洋湖沼通报, 2018, 3: 120-131.
TANG Shoujie, LI Sifa, ZHAO Jinliang. Heritability analysis of the late selection generations of nile tilapia () NEW GIFT strain using microsatellites[J]. Transactions of Oceanology and Limoology, 2018, 3: 120-131.
[44] 刘志刚, 曹建萌, 高风英, 等. 罗非鱼“粤闽1号”母本选育群体世代间遗传差异的微卫星分析[J]. 大连海洋大学学报, 2021, 36(1): 16-22.
LIU Zhigang, CAO Jianmeng, GAO Fengying, et al. Genetic differentiation analysis of maternal selective breeding generations of tilapia “Yuemin No. 1”using microsatellites[J]. Journal of Dalian Ocean University, 2021, 36(1): 16-22.
[45] 杨弘, 李大宇, 曹祥, 等. 微卫星标记分析罗非鱼群体的遗传潜力[J]. 遗传, 2011, 33(7): 768-775.
YANG Hong, LI Dayu, CAO Xiang, et al. Genetic potential analysis of six Tilapia populations by microsatellite DNA markers[J]. Hereditas (Beijing), 2011, 33(7): 768-775.
[46] 闫路娜, 张德兴. 种群微卫星 DNA 分析中样本量对各种遗传多样性度量指标的影响[J]. 动物学报, 2004, 50(2): 279-290.
YAN Luna, ZHANG Dexing. Effects of sample size on various genetic diversity measures in population genetic study with microsatellite DNA markers[J]. Acta Zoologica Sinica, 2004, 50(2): 279-290.
[47] 戴习林, 刘洁, 李晶晶, 等. 罗氏沼虾种群SSR分析中样本量及标记量对遗传多样性指标的影响[J]. 水产学报, 2017, 41(7): 1083-1095.
DAI Xilin, LIU Jie, LI Jingjing, et al. Effects of sample size and loci number on genetic diversity index inwith microsatellite markers[J]. Journal of Fisheries of China, 2017, 41(7): 1083-1095.
[48] 李欧, 赵莹莹, 郭娜, 等. 草鱼种群SSR分析中样本量及标记数量对遗传多度的影响[J]. 动物学研究, 2009, 30(2): 121-130.
LI Ou, ZHAO Yingying, GUO Na, et al. Effects of sample size and loci number on genetic diversity in wild population of grass carp revealed by SSR[J]. Zoological Research, 2009, 30(2): 121-130.
[49] HILLEN J E J, COSCIA I, VANDEPUTTE M, et al. Estimates of genetic variability and inbreeding in experimentally selected populations of European sea bass[J/OL]. Aquaculture, 2017, 479(March): 742-749.
[50] NEI M. Estimation of average heterozygosity and genetic distance from a small number of individuals[J]. Genetics, 1978, 89(3): 583-590.
[51] BEAUMONT A, BOUDRY P, HOARE K. Biotechnology and genetics in fisheries and aquaculture[M]. Singapore: Wiley-Blackwell, 2010.
[52] LIND C E, EVANS B S, KNAUER J, et al. Decreased genetic diversity and a reduced effective population size in cultured silver-lipped pearl oysters()[J]. Aquaculture, 2009, 286(1/2): 12-19.
[53] RHODE C, MADUNA S N, ROODT-WILDING R, et al. Comparison of population genetic estimates amongst wild, F1 and F2 cultured abalone ()[J]. Animal Genetics, 2014, 45(3): 456-459.
Microsatellite analysis on genetic diversity and genetic structure of three successive selected generations of
LIANG Yuan1, 3, FU Jing-qiang2, 3, SHEN Ming-hui4, LUO Xuan1, 3, YOU Wei-wei1, 3, KE Cai-huan1, 3
(1. College of Ocean and Earth Sciences, Xiamen University, Xiamen 361102, China; 2. College of the Environment and Ecology, Xiamen University, Xiamen 361102, China; 3. Fujian Key Laboratory of Genetics and Breeding of Marine Organisms, Xiamen University, Xiamen 361102, China; 4. Hainan Academy of Ocean and Fisheries Sciences, Hainan Provincial Key Laboratory of Tropical Maricultural Technologies, Haikou 571126, China)
We analyzed the genetic diversity and genetic structure among three successive selected generations (TF4–TF6) ofusing 12 polymorphic microsatellite markers. Polymorphism information content () was 0.730, 0.717, and 0.708, showing relatively high polymorphisms (>0.5). Additionally, number of alleles (), effective number of alleles (e), observed heterozygosity (o), expected heterozygosity (e), and Shannon’s information index () ranged from 11.667 to 12.583, 6.334 to 6.915, 0.658 to 0.672, 0.737 to 0.787, and 1.837 to 2.003, respectively, suggesting an overall decreasing but not significant trend (0.05). Furthermore, analysis of molecular variance (AMOVA) showed that genetic variation among generations only accounted for 0.95% of the total variation, whilestranged from 0.00569 to 0.01324, belonging to the low differentiation level (st0.05). Moreover, principal coordinates analysis (PCoA) and STRUCTURE analysis illustrated a similar genetic background and genetic structure among the three generations. These results suggested that the three generations maintained a high level of genetic diversity after consecutive generations of artificial breeding, with a low level of genetic variation and differentiation and a stable genetic structure. The results also indicated that a highly selective potential still existed in the breeding populations of..
; selective population; microsatellite marker; genetic diversity; genetic structure
Oct. 7, 2021
S917.4
A
1000-3096(2022)10-0085-09
10.11759/hykx20211007003
2021-10-07;
2022-01-13
海南省重点研发项目(ZDYF2022XDNY234); 福建省科技计划项目高校产学合作项目(2020N5001); 国家自然科学基金资助项目(32202900); 海南省热带海水养殖技术重点实验室项目(TMTOF-202003)
[Hainan Province Science and Technology Special Fund, No. ZDYF2022XDNY234; Fujian Provincial S & T Project, No. 2020N5001; National Natural Science Foundation of China, No. 32202900; The Project of Hainan Provincial Key Laboratory of Tropical Maricultural Technologies, No. TMTOF-202003]
梁园(1998—), 女,满族, 辽宁凤城人, 硕士, 主要从事东风螺遗传育种研究, E-mail: liangyuan@stu.xmu.edu.cn; 柯才焕(1962—),通信作者, E-mail: chke@xmu.edu.cn
(本文编辑: 谭雪静)
