金属离子诱导人中心蛋白3的聚集
2022-11-23赵亚琴王映杰
赵亚琴,王映杰
(山西大学 分子科学研究所,山西 太原 030006)
0 引言
中心蛋白是一种分子量比较小(约20 kD)的酸性钙结合蛋白。最初,中心蛋白是在单细胞绿藻中作为与基底细胞相关联的收缩纤维被发现的[1]。后来在有丝分裂纺锤体、中心体和中心粒的成分中也发现了它的同源蛋白[2-3]。序列分析表明,中心蛋白可以分成4个不同的亚型。第一种亚型以植物中心蛋白为代表[4];第二种亚型以草履虫中心蛋白为代表[5];酵母菌中心蛋白(Sac-charomyces cerevisiae Centrin,Cdc31)、鼠中心蛋白3(Murine centrin 3,MmCen3)和人中心蛋白 3(Human centrin 3,HsCen3)属于第三种亚型;衣藻中 心 蛋 白(Chlamydomonas reinhardtii centrin,CrCen)、鼠中心蛋白(MmCen1、2、4)、人中心蛋白 1和 2(HsCen1、HsCen2)同属于第四种亚型。不同亚型的中心蛋白在同一种细胞中发挥不同的生物功能。有研究表明[6-7]HsCen1位于精子鞭毛基部,通过将精子的母中心粒贡献给卵子实现中心粒复制。HsCen2参与细胞中受紫外线照射DNA损伤部位的切除、修复;参与信使RNA的输出[8],它的磷酸化与中心体的复制有关[9]。而HsCen3在体内参与中心体复制。HsCen4发现于脑内的神经元细胞中[10]。
中心蛋白属于EF-hand钙结合蛋白,是钙调蛋白(calmodulin,CaM)家族成员[1]。氨基酸序列分析表明中心蛋白与CaM有50%的同源性。中心蛋白与CaM有相似的三维结构,整个蛋白分子呈哑铃型构象,氨基端(N-端)和羧基端(C-端)分别为哑铃的两端,各含有两个EF-hand结构域,中间由一段柔韧的α-螺旋环相连,每个EF-hand可以结合一个Ca2+。通过Ca2+作用CaM的构象由“封闭”状态转变为“开放”状态,传导钙信号,调控下游蛋白的功能[11]。HsCen3的分子量约为20 kD,理论酸性等电点为4.62。它由167个氨基酸残基组成,其中包含1个色氨酸,2个酪氨酸,8个苯丙氨酸以及2个组氨酸。HsCen3分子中含酸性氨基酸45个,碱性氨基酸29个,使得蛋白本身带16个负电荷,是一种酸性蛋白。蛋白质的二级结构包括α-螺旋、β-折叠和β-转角。在单细胞绿藻中发现的以中心蛋白为主要组分的纤维状物质的功能受到细胞内钙离子浓度的调控[12-13]。通过收缩分离微管、切除鞭毛。在高等真核生物中的中心粒及中心粒周围物质的结构中也发现有纤维状物质的成分,通过纤维收缩来负责整个系统的运动行为。因此,研究蛋白的聚集是发挥蛋白生物功能的重要性质。本文通过荧光共振散射方法研究了稀土离子、钙离子对HsCen3聚集性质的影响,探索蛋白浓度、离子强度和离子半径等对HsCen3聚集的影响,为研究中心蛋白在中心粒组装中功能的研究具有重要意义。
1 实验
1.1 材料
N-2-羟乙基哌嗪-N’-2-乙磺酸(Hepes),分析纯,Sigma公司;氯化钾(KCl),分析纯,BBI公司;三氧化二镧(La2O3),三氧化二钕(Nd2O3),三氧化二钐(Sm2O3),三氧化二铕(Eu2O3),三氧化二钆(Gd2O3),七 氧 化 四 铽(Tb4O7),三 氧 化 二 镝(Dy2O3),三氧化 二钬(Ho2O3),三氧 化二镱(Yb2O3),三氧化二镥(Lu2O3),纯度达99.99%,湖南稀土金属材料研究所;无水氯化钙(CaCl2),分析纯,北京化学试剂厂产品;2-对甲苯胺基-6-萘磺酸(2-p-toluidinyinaphthalene-6-sulfonate,TNS),纯度95%,Sigma公司。
1.2 蛋白的表达与纯化
经测序正确的pGEX-6p-1-HsCen3重组质粒转入到大肠杆菌中进行可溶性表达,其纯化方法与游仆虫中心蛋白类似[14-15]。中心蛋白HsCen3的N端半分子(N-HsCen3)和C端半分子(C-HsCen3)的表达与纯化方法也与游仆虫中心蛋白的类似[14-15]。将纯化最后得到的蛋白质HsCen3用Cary 50 UV-Vis紫外可见分光光度计测定280 nm处的吸光度,根据朗伯比尔定律A=εbc测定蛋白 的 浓 度 。HsCen3 的 ε280=8480 L·mol-1·cm-1,N-HsCen3 的 ε280=8480 L·mol-1·cm-1,C-HsCen3的 ε260=760 L·mol-1·cm-1。
1.3 荧光共振光散射光谱
使用F-2700荧光光谱仪测定金属离子对HsCen3的聚集作用及影响。使用相同的激发和发射波长,扫描波长范围为250 nm~500 nm,激发狭缝及发射狭缝均为5 nm。为使反应达到平衡,加入Tb3+后间隔时间为3 min,加入Ca2+后间隔时间为4 min。为消除滴定过程中的稀释效应,数据处理时将荧光共振光散射强度(fluorescence resonance light scattering,RLS)转化为摩尔荧光共振光散射强度(Molar RLS)。实验在室温下0.01 mol/L Hepes,pH 7.4的缓冲液中进行。
1.4 远紫外圆二色光谱
使用Chirascan型圆二色谱仪进行远紫外光谱分析,扫描速度为100 nm/min,扫描范围为200 nm~240 nm,蛋白浓度为5×10-6mol/L,三次扫描取平均值,光程为1 mm,扣除缓冲信号。首先在石英池中加入浓度为5×10-6mol/L的蛋白HsCen3溶液,再加入4倍蛋白质溶液的Ca2+或Tb3+溶液,充分反应3 min,进行测定。实验在25℃,pH 7.4的0.01 mol/L Hepes缓冲液中进行。
1.5 动态光散射技术
使用Malvern Zetasizer Nano ZS动态光散射仪(PCS1115比色杯)对纯化后的蛋白进行扫描。实验在25℃,pH 7.4的0.01 mol/L Hepes缓冲液中进行。三次测量,对每次测量的运行次数进行优化。将分散剂(水)的折射率(RI)设置为1.330,黏度设置为0.887 2 cp,粒子的RI设置为1.45,蛋白质的吸收设置为0.00,衰减器和测量位置均由仪器控制,所有测量均以173°的散射角进行。
2 结果与讨论
2.1 Tb3+、Ca2+诱导人中心蛋白3的聚集
在0.01 mol/L Hepes,pH 7.4缓冲溶液中,Ca2+加入到HsCen3溶液中的共振光散射谱如图1(a)所示。由图可知,HsCen3的共振光散射峰为300 nm。随着Ca2+的逐渐加入,HsCen3在300 nm处共振光散射峰强度逐渐增大,证明Ca2+和HsCen3结合形成了比较大的散射颗粒,在Ca2+作用下HsCen3可能发生聚集;当Ca2+浓度达到一定值后,共振光散射强度达到最大基本不变。为了消除稀释效应,将300 nm处的RLS信号强度除以蛋白的分析浓度,将RLS转化为Molar RLS(图1(b))。由图1(b)的曲线a可见,[Ca2+]< 4.0 mmol/L时,HsCen3共振光散射强度随Ca2+浓度的增大逐渐增加,当[Ca2+]>4.0 mmol/L时达到最大值,证明HsCen3在Ca2+作用下形成了聚集体。Ca2+加入N-HsCen3溶液中可以看到相似的现象:[Ca2+]< 0.4 mmol/L时,NHsCen3共振光散射强度几乎不变,当0.4<[Ca2+]<1.0 mmol/L时,N-HsCen3共振光散射强度明显增加,并且在[Ca2+]>1.0 mmol/L时达到最大值。中心蛋白HsCen3与Ca2+的结合能力很弱(Kd=1.4×10-4mol/L),Ca2+与蛋白结合形成钙蛋白的过程是一个动态平衡过程,当HsCen3的浓度为10-5mol/L时,在此实验条件下形成完全饱和的钙结合蛋白需要10-4mol/L~10-6mol/L的钙离子,即Ca2+浓度是蛋白浓度的10到100倍。比较曲线HsCen3、N-HsCen3的共振光散射曲线发现HsCen3的聚集程度远远低于N-HsCen3。与N-HsCen3相比较,Ca2+加入C-HsCen3溶液中同样可以引起蛋白共振光散射强度增强(图1(b),曲线b),但其增强效应明显比HsCen3或N-HsCen3弱。比较Ca2+与HsCen3、N-HsCen3、C-HsCen3作用的共振光散射曲线发现:在相同的条件下,N-HsCen3形成的散射粒子最大,HsCen3其次,C-HsCen3形成的散射粒子最小,比较图1(b)的曲线a、b、c可知:在钙离子存在下,HsCen3、N-HsCen3、C-HsCen3都可以形成聚集体,其中N-端结构域起主要作用。而曲线b和c理论加和值曲线d与曲线a不能重合,证明N—、C—端结构域之间存在协同作用,对HsCen3聚集有一定的影响。

图1 (a)Ca2+诱导HsCen3聚集的共振光散射谱,[Ca2+]=0(a)、1.5(b)、3(c)、4.5(d)、8(e)mmol/L。(b)Ca2+滴定HsCen3(a),C-HsCen3(b)或N-HsCen3(c)时蛋白在300 nm处摩尔RLS强度随钙离子浓度变化的曲线。曲线d表示CHsCen3和N-HsCen3的摩尔RLS强度的理论叠加。插图:Ca2+加入到N-HsCen3溶液中300 nm处的摩尔RLS强度变化曲线。蛋白浓度为1×10-5mol/LFig.1 (a)The resonance light scattering spectra of Ca2+-induced HsCen3 aggregates.(b)The concentration of Ca2+was 0,1.5,3,4.5,8 mmol/L HsCen3(c)at 300 nm.d:the calculated sum of the molar RLS of C-HsCen3 and N-HsCen3.Inset:the RLS curve of Ca2+titrating N-HsCen3 at 300 nm.[Protein]=1×10-5mol/L
由于Tb3+与Ca2+具有相似的化学硬度、离子半径、配位数,Tb3+被广泛用于钙离子结合蛋白的探针[16],进入体内后有可能占据或者取代钙的位置而影响一系列的生物功能。图2为Tb3+滴定HsCen3、N-HsCen3、C-HsCen3时300 nm处共振光散射强度变化曲线。由图可知,Tb3+可以引起HsCen3、NHsCen3、C-HsCen3形成聚集体;聚集程度与Ca2+类似,N-HsCen3最强,HsCen3次之,C-HsCen3最弱。由于Tb3+比Ca2+有更高的离子势,因此Tb3+存在下人中心蛋白3的聚集粒子更大,导致其共振光散射强度更强。
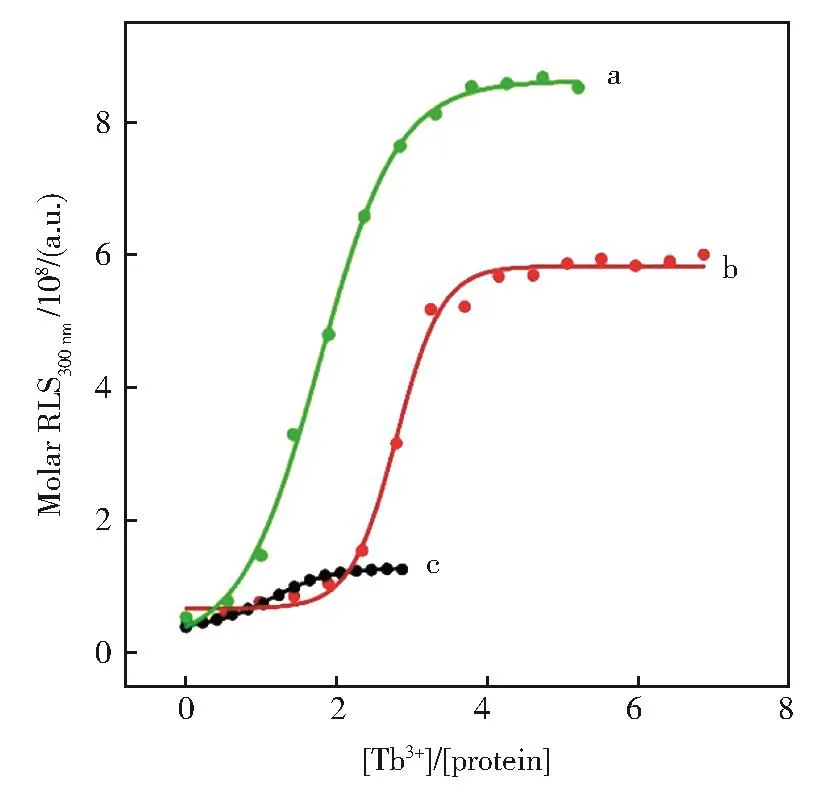
图2 Tb3+滴定N-HsCen3(a)、HsCen3(b)或C-HsCen3(c)时300 nm处的摩尔共振光散射强度变化曲线,蛋白浓度为1×10-5mol/LFig.2 Titration curves(at 300 nm)of molar RLS for the addition of Tb3+to N-HsCen3(a),HsCen3(b)or C-HsCen3(c).[Protein]=1×10-5mol/L
2.2 影响人中心蛋白3聚集的因素
图3(a)为0.01 mol/L Hepes pH 7.4缓冲溶液中,将Tb3+加入不同浓度HsCen3中的共振光散射变化曲线。随着蛋白浓度从4.5×10-6mol/L增加2.5×10-5mol/L,蛋白HsCen3的摩尔共振光散射荧光强度逐渐增加。提高蛋白浓度使得单位体积内蛋白分子数量增加,蛋白分子之间碰撞的概率增加,从而增加了聚集的概率,因此蛋白分子聚集体的粒径随着蛋白浓度增大而增大。在一定浓度范围内,蛋白质HsCen3的聚集程度与蛋白质本身的浓度呈正相关(图3(b))。当HsCen3蛋白浓度从2.5×10-5mol/L增加到8.5×10-5mol/L时,由于蛋白本身已经聚集成多聚体,不再以单体形式存在,因此加入Tb3+后,摩尔共振光散射信号强度反而降低。蛋白HsCen3聚集的最佳浓度为1.0×10-5mol/L。

图3 (a)Tb3+滴定不同浓度的HsCen3在300 nm处的摩尔RLS滴定曲线。(b)Tb3+滴定不同浓度HsCen3时的最大摩尔RLS强度对蛋白浓度曲线Fig.3 (a)The molar RLS changes at 300 nm of Tb3+titrating different concentration of HsCen3(4.5×10-6mol/L(a);1×10-5mol/L(b);2.5×10-5mol/L(c)or 8.5×10-5mol/L(d)).B:The plot of Tb3+-saturated HsCen3 molar RLS vs[HsCen3]
由于镧系离子(Ln3+)与Ca2+具有相似的离子半径和配位数,镧系离子可能取代结合中心蛋白中的 Ca2+[17],从而实现稀土生物效应。图4(a)为pH 7.4,0.01 mol/L Hepes缓冲液中,不同稀土离子诱导HsCen3作用导致聚集体时蛋白在300 nm处的摩尔荧光共振光散射强度的变化曲线。Lu3+的离子半径最小与中心蛋白的作用最强[18],因此Lu3+存在下HsCen3的聚集程度最大。尽管镧系离子半径与Ca2+相似,但镧系离子的质荷比大,比Ca2+的亲和力强[19]。大的电荷密度提高Ln-EF-hand的结构刚性[19]。因此,稀土离子La3+,Nd3+,Sm3+,Eu3+,Gd3+,Tb3+,Dy3+,Ho3+,Yb3+,Lu3+都可以诱导HsCen3发生聚集形成聚集体,而且稀土离子的作用下蛋白的聚集程度远高于Ca2+的作用。图4B为HsCen3在300 nm处聚集的最大摩尔共振光强度随稀土离子原子序数的变化图。可以看出,除Ca2+诱导HsCen3的聚集强度很小外,随着镧系金属离子原子序数减小,离子半径增大(Lu3+<Yb3+<Ho3+<Dy3+<Tb3+<Gd3+<Eu3+<Sm3+<Nd3+<La3+),蛋白聚集程度减弱。Lu3+诱导的蛋白聚集作用最大,La3+诱导的蛋白聚集作用最小。除钙离子的亲和力很小外,镧系金属离子半径越小,蛋白质的聚集行为越明显。在中性条件下,Ln3+与水分子配位。当与蛋白质结合时,部分与Ln3+配位的水分子会被蛋白质上的氨基酸所取代,剩余的水分子与氨基酸之间的斥力随着Ln3+半径的减小而增大[15],因此Lu3+与中心蛋白的亲和力最强,诱导HsCen3聚集的作用最大。

图4 (a)不同金属离子滴定HsCen3在300 nm处的摩尔RLS变化曲线。(b)不同金属离子滴定HsCen3在300 nm处的最大摩尔共振光散射强度图。蛋白浓度为1×10-5mol/LFig.4 (a)The molar RLS changes at 300 nm of different metal ion titrating HsCen3.[Protein]=1×10-5mol/L.(b)The maximal molar RLS intensity changes of HsCen3 with the different ions at 300 nm
图5(a)为含有不同KCl浓度的Hepes缓冲液中Tb3+诱导HsCen3聚集的摩尔共振光散射曲线。可以看出随着溶液中KCl浓度的增加,静电作用增大,HsCen3的最大共振光散射强度减小,聚集明显减弱。当溶液中KCl浓度增加,离子强度增强,溶液中的静电作用减小,使得金属离子诱导蛋白聚集的程度减弱。推测静电作用在HsCen3的聚集中起重要作用。图5(b)为不同浓度TNS存在下Tb3+滴定HsCen3的摩尔荧光共振光散射曲线。TNS是一种检测蛋白疏水结构域变化的荧光探针,它主要结合在中心蛋白的疏水性的结构域[20]。因此推测疏水作用力在HsCen3的聚集中也起重要作用。疏水力是中心蛋白聚集的重要驱动力[21]。由图5(b)可以看出,随着溶液中TNS浓度的增加,Tb3+诱导HsCen3聚集的最大共振光散射强度降低,即TNS的存在抑制了Tb3+诱导的HsCen3聚集。Tb3+与蛋白结合后疏水区暴露,TNS部分占据了疏水区表面,使得蛋白分子之间的疏水作用减弱,导致共振光散射强度降低。

图5 (a)溶液中含不同浓度KCl(0(a)、25(b)、50(c)、100(d)、200(e)mmol/L)时,Tb3+滴定HsCen3的共振光散射强度变化曲线。(b)溶液中存在TNS条件下,Tb3+滴定HsCen3的共振光散射变化曲线(a)[TNS]/[HsCen3]=0,(b)[TNS]/[HsCen3]=2,(c)[TNS]/[HsCen3]=4或 (d)[TNS]/[HsCen3]=10。HsCen3浓度:1×10-5mol/LFig.5 (a)Titration curves(at 300 nm)of molar RLS for adding Tb3+to HsCen3 in Hepes buffer containing different KCl concentrations[0(a),25(b),50(c),100(d),200(e)mmol/L].(b)The molar RLS changes at 300 nm of Tb3+titrating HsCen3 in the presence of different TNS concentrations([TNS]/[HsCen3]=0(a),[TNS]/[HsCen3]=2(b),[TNS]/[HsCen3]=4(c)or[TNS]/[HsCen3]=10(d)).[Protein]=1×10-5mol/L
2.3 金属离子对中心蛋白二级结构的影响
CD光谱是研究可溶性蛋白二级结构特征的一种实用而有效的方法。图6给出了中心蛋白HsCen3在结合金属离子前后的CD光谱图。由图6中的曲线b可以看出,HsCen3的谱线在208和222 nm处显示负吸收峰,这是典型的具有α-螺旋结构蛋白质的特征[22]。加入Ca2+或Tb3+后,位于208和222 nm处的负峰均有所增加,即蛋白质与金属离子结合后,其二级结构被重组,导致蛋白质α-螺旋含量增加。基于222 nm处的摩尔椭圆度与α-螺旋/线圈混合物中螺旋含量的线性关系,相比于HsCen3,Ca4-HsCen3的α-螺旋含量增加了24.3%(图6,曲线c),Tb4-HsCen3的α-螺旋含量增加了48.6%(图6,曲线d),Tb3+的加入使蛋白α-螺旋含量增加比例大于Ca2+。

图6 HsCen3与金属离子作用的远紫外CD光谱。蛋白浓度为5×10-6mol/LFig.6 Far-UV CD spectra of HsCen3 in the presence of metal ions.[HsCen3]=5×10-6mol/L
2.4 HsCen3动态光散射分析
由图7中不同浓度HsCen3的动态光散射光谱分析可以看出,当中心蛋白HsCen3的浓度为1×10-5mol/L时,颗粒半径较小(曲线a);当蛋白浓度逐渐增大时(曲线b和c),其颗粒半径逐渐增大,表明大浓度的HsCen3分子本身会聚集形成聚集体。当向HsCen3溶液中加入金属离子Ca2+或Tb3+时,颗粒半径增大(曲线d和e),说明金属离子的结合可诱导蛋白形成聚集体,颗粒半径明显增大。这与前面共振光散射技术的结果相一致。

图7 HsCen3的动态光散射光谱。a:[HsCen3]=1×10-5mol/L,b:[HsCen3]=4.5×10-5mol/L,c:[HsCen3]=8×10-5mol/L,d:Ca2+存在下HsCen3的动态光散射光谱,e:Tb3+存在下HsCen3的动态光散射光谱Fig.7 Dynamic light scattering spectra of HsCen3.a:[HsCen3]=1×10-5mol/L,b:[HsCen3]=4.5×10-5mol/L,c:[HsCen3]=8×10-5mol/L,d:Ca2+-HsCen3([HsCen3=1×10-5mol/L]),e:Tb3+-HsCen3([HsCen3=1×10-5mol/L])
3 结论
本文通过荧光共振光散射光谱法研究了金属离子与HsCen3的相互作用,结果表明,Tb3+、Ca2+会诱导HsCen3聚集形成聚集体,共振光散射强度增强。在HsCen3的聚集过程中其N-端结构域起重要作用,且在这个过程中可能受疏水作用和静电作用的共同调控。通过研究影响HsCen3聚集的因素如离子半径、离子强度等,得出结论:在一定范围内HsCen3的聚集程度与蛋白本身的浓度呈正相关;随着金属离子半径的减小,所引起蛋白的聚集程度增强;随着KCl盐浓度的增大,HsCen3的聚集程度减弱,HsCen3聚集成最大颗粒所需Tb3+的浓度增加;随着TNS与HsCen3比例的增加,Tb3+引起HsCen3的聚集程度减弱。通过CD光谱分析可知金属离子的加入使得蛋白质HsCen3的二级结构被重组,α-螺旋含量增加。
