Luciference 标记胰岛及在体外和裸鼠体内的荧光表达研究
2022-11-21夏楚睿寿辰菲金明叶泽岚宋益康章余旋傅红兴
夏楚睿,寿辰菲,金明,叶泽岚,宋益康,章余旋,傅红兴
(1.浙江树人学院树兰国际医学院,浙江 杭州 312028;2.浙江大学医学院附属第二医院,浙江 杭州310000)
胰岛移植是目前临床上唯一微创并能实现血糖精确调控的外科治疗手段,随着近几年胰岛移植临床治疗方案和标准的纯化人胰岛生产方法的公布[1-6],国内外已有越来越多的医疗机构正在开展或准备开展该项手术。但胰岛移植依然存在体内移植的胰岛追踪、存活评价困难等问题[7-8],成为该技术研究和推广应用的一个障碍。
活体生物体内光学成像技术在近20 年里发展迅速[9-10]。其中荧光素酶(Luciference,LUC)基因可整合到细胞染色体DNA 上,表达的偏红外荧光在体内穿透性强,无需激发光,使用底物荧光素(D-Luciferin)即可在小动物活体光学成像系统中观察标记的细胞或蛋白在体内的存活和运行轨迹,在肿瘤、干细胞和蛋白因子的表达、测定研究中应用广泛[11-12]。本研究采用慢病毒载体将荧光素酶基因导入分离后的胰岛中,并移植至裸鼠肾被膜下,在成像系统中定期观察LUC 基因转染后胰岛在体外和体内的荧光表达,为胰岛的LUC 标记和体内移植后的跟踪研究提供方法参考。
1 材料和方法
1.1 材料
1.1.1 实验动物:ICR 小鼠、Balb/c-nu 裸鼠(雄性,SPF 级,6 ~ 8 周,杭州医学院实验动物中心)。
1.1.2 实验试剂和器材:慢病毒Luciference 基因质粒(HBLV-LUC-PURO)、慢病毒ZsGreen 基因质粒(HBLV-ZsGreen-PURO)、溴化己二甲铵(Polybrene)〔汉恒生物科技(上海)有限公司〕;D-荧光素钾盐(D-Luciferin,货号:MB1834,大连美仑生物技术有限公司);胎牛血清(Gibco,Thermo Fisher Scientific,美国);Ficoll-1077、Ficoll-1119、FDAPI 双染细胞活力检测试剂盒、CMRL-1066(温州市怡康细胞移植技术开发有限公司);全自动活细胞成像系统(EVOS M7000,Invitrogen,美国);IVIS Lumina LT 小动物活体光学成像系统(Series Ⅲ,PerkinElmer,美国)。
1.2 方法
1.2.1 小鼠胰岛的分离和培养:参考前期工作基础[13-14],简述如下:取ICR 小鼠,颈椎脱臼法处死,U 型切口剪开腹部肌肉层;夹闭胆总管入十二指肠口;逆行胆总管灌注V 型胶原酶溶液2.5 ml,膨胀的胰腺放入含2 ml 同浓度V 型胶原酶的15 ml 离心管中,在(37.0±0.5)℃恒温水浴中振摇消化呈乳糜状,用Ficoll-1077、Ficoll-1119 进行密度梯度纯化,得到高纯度的小鼠胰岛,用CMRL 1066 胰岛培养液(含10%胎牛血清和青链霉素)在37℃、5% CO2培养箱中培养6 ~ 8 h 后进行后续实验。
1.2.2 慢病毒LUC 基因转染胰岛
1.2.2.1 慢病毒-LUC 胰岛培养液的配制:基于前期慢病毒ZsGreen 基因转染胰岛预实验,本实验选择慢病毒的感染复数为10 MOI。慢病毒-LUC 胰岛培养液的配制方法:取病毒-LUC 原液(病毒滴度:108TU/ml)10 μl,加入CMRL 1066 胰岛培养液990 μl,混匀后得到含10 MOI 病毒-LUC 基因质粒的胰岛培养液1 ml。
1.2.2.2 胰岛经慢病毒LUC 基因转染:将需转染的胰岛细胞团(约200 IEQ)放置于24 孔板中,尽量去除胰岛培养液;快速加入1 ml 10 MOI 的慢病毒-LUC 胰岛培养液,放于37℃、5%CO2培养箱中分散后培养24 h。将转染慢病毒后的胰岛取出后至新的12 孔板中,用胰岛培养液洗涤1 遍后加入2 ml新鲜的CMRL 1066 胰岛培养液,37℃、5%CO2培养24 h 后进行后续的实验。
1.2.3 LUC 基因转染后胰岛的体外发光检测:取不同当量的上述转染LUC 基因的小鼠胰岛(约100、200、250 IEQ,各3 份),加入50 μl 底物D-Luciferin溶液(取D-Luciferin 原料,用无菌水配制成15 mg/ml 的荧光素溶液),在小动物活体光学成像系统中测定胰岛在体外的LUC 荧光表达,作为培养后第0 日荧光表达;取测定荧光后的小鼠胰岛(约100 IEQ),用胰岛培养液洗涤1 遍后,放置在新的12 孔板中,加入2 ml 胰岛培养液继续37℃、5%CO2培养;在培养1、7、14 d 进行相同的活体光学成像系统观察,得到LUC 标记胰岛在体外培养不同时间的荧光表达变化。
1.2.4 肾被膜下胰岛移植:将培养第0 天后约200 IEQ 转染慢病毒LUC 基因的胰岛移植至正常裸鼠的肾被膜下。方法简述如下[14]:异氟烷吸入麻醉正常Balb/c-nu 裸鼠,用眼科剪在右肾背侧皮肤和肌肉上开1 cm 小口暴露右肾。用针在肾被膜上刺一小口,并使用自制的移植工具将胰岛移植到肾背膜下。缝合切口并用聚维酮碘消毒,皮下注射1 ml 生理盐水补液。术后小鼠每日皮下注射100 μl 头孢唑啉钠预防感染,持续1 周。
1.2.5 LUC 基因转染后胰岛的体内发光检测:取胰岛移植后的裸鼠,异氟烷吸入麻醉后,腹腔注射100 μl 底物D-Luciferin 溶液,5 min 后在小动物活体光学成像系统中测定LUC 标记胰岛在体内的荧光表达。对同一小鼠在胰岛移植术后的同一位置,术后第0、1、3、5、7、14、21、30 日监测1 次荧光表达,以未转染慢病毒LUC 基因的胰岛移植为对照组进行相同的观察。
1.2.6 胰岛活性:使用FDA-PI 双染细胞活力检测试剂盒评估胰岛的活性。方法:取25 个经慢病毒基因转染后的胰岛细胞团(约0.5 ml),加入10 μl PI 和10 μl FDA 溶 液 后,室 温 下 避 光 孵育30 s,使用EVOS M 7000 细胞成像系统,在蓝色激发光下发绿色荧光的为活细胞;在绿色激发光下发红色荧光的为死细胞。用发绿色荧光的组织面积占胰岛总面积的百分比进行胰岛活性的评估。
1.2.7 统计学分析:数据采用SPSS 17.0 统计学软件进行处理,所有数据用均数±标准差(±s)表示,并采用成对样品t 检验进行统计学分析。
2 结 果
2.1 小鼠胰岛的分离、培养及LUC 标记后胰岛的活性结果:1 只ICR 小鼠可分离得到(166±47)个胰岛,当量为(183.6±36.5) IEQ;胰岛形态圆整,经双硫腙(dithizone,DTZ)染色后,纯度>90%。经培养6 ~ 8 h 后的胰岛经荧光素双醋酸酯-碘化丙啶(fluorescein diacetate-propidium iodide,FDA-PI)染色后,活性达(93.6±3.1)%。胰岛经慢病毒LUC 转染24 h和再培养24 h 后,可见LUC 标记后的胰岛外形圆整(图1A),经FDA-PI 染色后大部分体积呈绿色,胰岛活性为(86.7±6.7)%(图1B)。

图1 LUC 标记后小鼠胰岛的形态和活性
2.2 LUC 标记胰岛在体外随时间的荧光表达结果:不同当量上述LUC 标记的胰岛培养第0 天,在小动物活体光学成像系统中测定的胰岛LUC 荧光的表达结果如下图2A(白色箭头)、2B 所示;取约100 IEQ LUC 标记胰岛,在培养第0、1、7、14 日的LUC 荧光表达结果如下图2C 所示。
体外培养的LUC 标记胰岛在小动物活体成像仪中可见荧光表达(图2A 中白色箭头所示),且荧光表达量与胰岛当量有关(图2B);LUC 标记胰岛在体外培养2 周内的荧光表达强度呈现逐渐增强趋势(图2C)。

图2 LUC 标记胰岛在不同胰岛当量、培养时间的荧光表达结果(n=3)
2.3 LUC 标记胰岛移植至裸鼠体内后随时间的荧光表达结果:培养第0 天的LUC 标记胰岛移植至裸鼠肾被膜下后,在小动物活体光学成像系统中的成像结果如下图3A 所示。移植术后第0、1、3、5、7、14、21、30 日的体内LUC 荧光表达结果如下图3B所示。
在小动物活体成像仪中,裸鼠肾被膜下移植的LUC 标记胰岛可见荧光表达(图3A 中白色箭头所示),并可实现在活体状态下长期观察(>30 d);但荧光表达的强度随时间变化有较大差异(图3B)。对照组移植未转染LUC 基因的胰岛的裸鼠,在活体成像仪中无荧光表达。
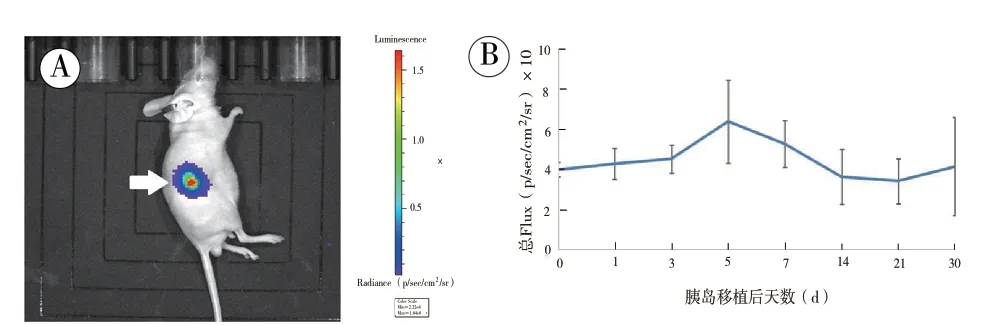
图3 LUC 标记胰岛移植至裸鼠体内后随时间的荧光表达结果
3 讨 论
关于LUC 标记胰岛的研究有经腺病毒载体转染分离后的胰岛[15]和转染胰岛素Ⅰ启动子控制的LUC 基因至小鼠[16]等,但存在LUC 表达时间短,模型构建难度大等问题。本研究中LUC 基因经慢病毒稳转,可实现LUC 的长期表达,转染方法简便。
LUC 标记的胰岛在体外培养2 周内,随培养时间的延长荧光强度表达增强,说明胰岛细胞内LUC的表达随时间逐渐增加。LUC 标记胰岛在体内移植后的荧光表达的差异较大,且不像体外胰岛LUC 的表达逐渐增加,这可能与体内肾被膜下环境复杂,胰岛细胞团内表达LUC 的细胞在肾被膜下移植后有部分死亡,存活的表达LUC 细胞数量差异较大有关;且在活体成像仪下测定时裸鼠的体位、测定时间对荧光强度的结果也具有一定的影响。为提高慢病毒对细胞的感染效率,慢病毒基因转染中常加入Polybrene;但在本实验中慢病毒-LUC 胰岛培养液中添加Polybrene 后,标记的胰岛细胞病死率大大增加,因此后续LUC 转染胰岛实验中未加该成分。本研究LUC 标记的胰岛移植至裸鼠体内后,可实现在活体状态下长期观察体内胰岛的存活情况,为后续研究胰岛在移植部位的存活和功效研究提供一定的参考。
