中枢神经系统散发性血管母细胞瘤MRI征象与病理对照
2022-11-21丁晓云石士奎
张 平 丁晓云 石士奎
1.阜阳市人民医院影像中心(安徽 阜阳 236000)
2.杭州市临平区第五人民医院放射科(浙江 杭州 311100)
3.蚌埠医学院第一附属医院放射科,蚌埠医学院影像学院 (安徽 蚌埠 233000)
血管母细胞瘤 (hemangioblastoma,HBM)是一种真性血管源性肿瘤,占中枢神经系统肿瘤的1%~2.5%和后颅窝肿瘤的7%~12%[1]。除中枢神经系统外,其他部位罕见报道。典型的大囊小结节型HBM多见于小脑半球[2],MRI易于诊断。大囊大结节型、小囊大结节型、小囊小结节型、实性肿块型及单纯囊肿型少见,MRI征象不典型,易误诊为转移瘤、动脉瘤[3]或其他病变。本文对蚌埠医学院第一附属医院2011年1月至2019年7月16例手术病理证实的中枢神经系统散发性HBM(Sporadic HBM,sHBM)临床及MRI资料进行回顾性研究,旨在提高sHBM诊断技能,降低误诊率。
1 资料与方法
1.1 一般资料本组sHBM16例,其中包括男9例,女7例,年龄21~78岁,平均43.13±17.28岁。MRI平扫及增强扫描15例,MRI平扫1例。头痛、头晕、步态不稳13例,耳鸣1例,下肢无力并麻木1例,偶然发现1例。病程2月~20月不等。术后随访0.5~3年,无复发。
1.2 MRI检查方法5例患者检查设备为Philips Achieva 3.0T 超导MRI成像仪,11例检查设备为GE Signa 1.5 T超导MRI成像仪,头部表面线圈及胸椎体部线圈。扫描序列SE T1WI(TR500-600ms/TE20-25ms)、FSE T2WI(TR3000-4000ms/TE 90-110ms)、T2-FLAIR(TR2000-2200ms/TE22-25ms)及DWI(b值为1000s/mm2,TR2500ms/TE110ms)。FOV 350×350~411×411,层厚3mm,层间距3mm。肘前静脉注射Gd-DTPA行冠状位、矢状位、横轴位TSE FS T1WI(TR 500-600 ms/TE 18~25ms)增强扫描,剂量0.1mmol/kg体重,注射速率2~ 3mmol/s。
1.3 病理检查术后病理切片行常规HE染色和免疫组化分析,检测指标包括CD34、CD31、Vimentin、NSE、S-100、CD56、GFAP以及Ki-67等标志物。病灶的具体情况参照手术记录。
2 结 果
2.1 病灶分布本组16例sHBM均为单发,边界清晰,对邻近脑组织无明显浸润。颅内15例,其中幕上2例,包括左侧颞叶深部脉络膜裂内和左侧鞍旁各1例;幕下13例,包括右侧小脑半球4例、左侧小脑半球2例、小脑蚓部偏左侧2例、小脑蚓部偏右侧1例、第四脑室内2例、左侧桥小脑角区1例及延髓背侧1例。颅外1例,位于胸椎11-12水平胸髓内。
2.2 MRI征象囊结节型9例,实性肿块型7例。囊结节型中,典型大囊小结节6例,大囊大结节1例,小囊大结节2例。壁结节和实性肿块大小1.0cm~4.1cm,圆形、类圆形或不规则形,较大者局部分叶,包膜征象不明显,2例可见“脑膜尾”征。壁结节和实性肿块T1WI上表现为等或稍低信号,T2WI上表现为等、稍高或高信号(图1A~图1B),部分信号不均,内伴条索样或螺旋状改变。囊腔在T1WI上呈低信号、T2WI上呈高信号(图2A~图2B),T2-FLAIR上稍高于脑脊液信号(图2C),T1WI上部分病例壁结节和实性肿块内可见斑片状高信号(图2A)。部分病灶内及周围可见血管流空信号(图3A~图3B)。增强扫描,壁结节和实性肿块均明显强化,囊腔、囊壁无明显强化(图1C,图2D)。
2.3 手术、病理所见术中见肿瘤边界清晰,囊结节型见红色、鲜红色壁结节靠近脑膜侧,质地较韧,富含小血管,囊液呈淡红色或淡黄色。实性肿块型质软,呈鲜红色或灰红色,血管丰富,周围见多发血管影。光镜下,壁结节和实性肿块由不同发育阶段的毛细血管及间质细胞构成(图1D)。毛细血管内皮细胞排列成单层,细胞之间间隙大,间质细胞在毛细血管网之间呈瘤巢状,构成瘤细胞的主体,间质细胞内含较多脂质,局部可发生粘液样及囊样变,核呈短梭形、卵圆形或圆形,胞质淡染或表现成空泡状。免疫组化染色CD34、CD31、Vimentin、NSE、S100、CD56、GFAP和Ki-67多为阳性表达,Ki-67增殖指数0~10%。
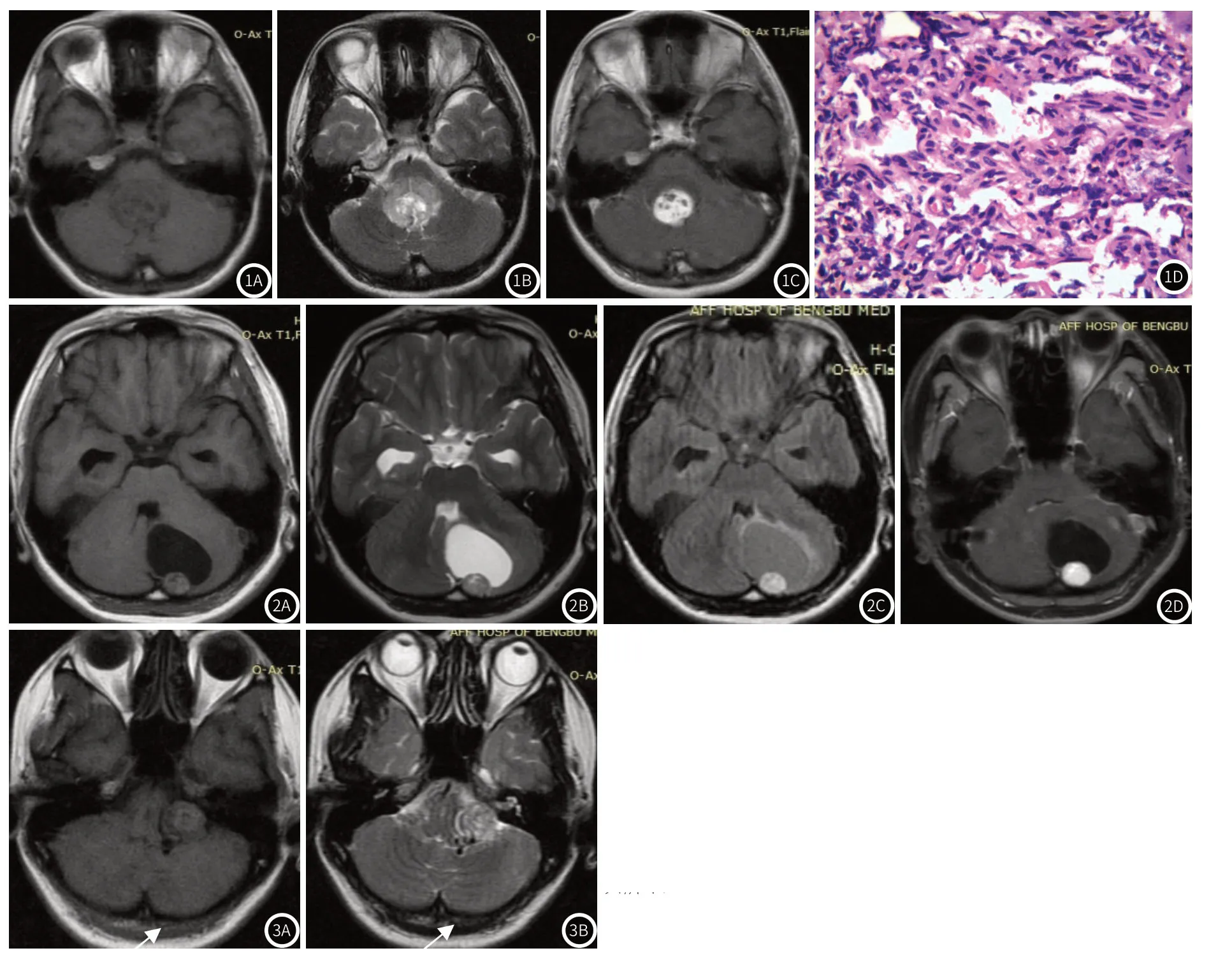
图1 实性肿块型sHBM。T1WI实性肿块等或稍低信号(图1A)。T2WI实性肿块等、稍高或高信号(图1B)。增强扫描实性肿瘤明显强化,其内囊腔不强化(图1C)。HE染色(400倍)显示肿块由不同发育阶段的毛细血管和间质细胞组成(图1D)。图2 大囊小结节型sHBM T1WI壁结节等或稍低信号,内见斑片状高信号出血灶(图2A)。T2WI壁结节等、稍高或高信号(图2B),T2-FLAIR囊腔信号较脑脊液高(图2C)。增强扫描壁结节强化显著,囊腔及囊壁未见明显强化(图2D)。图3 左侧桥小脑角区实性肿块型sHBM。肿块内及周围低信号血管流空信号(箭头所示)。
3 讨 论
3.1 概述HBM又称为成血管细胞瘤、血管网状细胞瘤,一般被认为来源于中胚层的血管胚胎细胞,不表现为浸润性生长趋势,边界清晰,是一种良性肿瘤。2016年WHO的中枢神经系统肿瘤分类中,将其归为间叶性非脑膜上皮性肿瘤Ⅰ级。散发性多见,占67%,几乎均为单发[3],多发者常见于Von Hippel-Lindau(VHL)综合征患者,占33%,sHBM发病一般晚于VHL相关者。本组16例sHBM均为单发,且无VHL相关病史。sHBM发病机制至今不明,Roh等[4]研究发现,HBM与琥珀酸脱氢酶B免疫失活可能存在一定相关性。sHBM在中枢神经分布广泛,中枢神经系统以外罕见报道,以脑实质起源为主[5],后颅窝小脑半球及蚓部多见,其次是脑干,幕上少见[6]。颅内脑外者,见于软脑膜、颅神经、桥小脑角区及鞍区等部位[7-8]。颅外者,以脊髓多见,为脊髓第三好发肿瘤,仅次于室管膜瘤和星形细胞瘤[9]。
3.2 临床与病理文献报道,sHBM 30~40岁多见、男性多于女性[10],10岁以下儿童少见,本组与其基本一致。sHBM初起临床表现不典型,病灶较大时可产生压迫症状,主要包括颅内压增高、小脑功能障碍及颅神经损害等,以头痛、头晕多见,但缺乏特异性。本组病例术后随访0.5~3年,无复发。
病理上,肿瘤组织主要是不同发育阶段的毛细血管及间质细胞构成。毛细血管壁内皮细胞排列成单层,细胞之间存在较大间隙,血清可自由漏出。间质细胞构成肿瘤的实质,间质细胞可能产生血管内皮生长因子,诱导毛细血管网的形成。因此,推测sHBM可能具有一定的神经内分泌功能,NSE免疫组化染色阳性间接支持该观点。Ki-67抗原作为细胞增殖标记物,被认为能够可靠的预测肿瘤的生物学行为,本组病例Ki-67增殖指数均<10%,提示肿瘤细胞增殖活性不高,预示肿瘤的良好预后。
3.3 MRI征象与病理对照根据发病部位不同,sHBM分为颅内型与颅外型。颅内型分为幕上和幕下,幕下多见,可能与小脑幕下软脑膜血管分支独特的胚胎期发育特点及不同的颅腔压力有关。幕上少见,主要分布于鞍区及颞叶内侧等。颅外型主要分布于椎管内,以脊髓多见。根据MRI表现不同,sHBM主要分3型,即囊结节型、实性肿块型及单纯囊肿型。囊结节型表现为单一囊腔和单一壁结节。根据囊腔与壁结节大小比例不同,又分大囊小结节型、大囊大结节型、小囊大结节型和小囊小结节型。实性肿块型表现为软组织肿块,内见散在分布范围不等囊腔,壁结节不明显,部分可见“囊中囊”征。单纯囊肿型极其罕见,文献报道较少,T2-FLAIR诊断价值较高,囊液信号稍高于脑脊液,囊肿周围散在分布异常强化结节,病理上与壁结节相似,具有一定特征性。单纯囊肿型可能是囊结节型的一种特殊存在形式,即与壁结节退化有关。根据大小不同,实性肿块型sHBM分三型,<3cm者为小型、3.1~4cm者为大型、>4cm者为巨大型[11]。巨大型sHBM切除过程中出血风险高,尤其是合并凝血功能障碍者[12]。
sHBM以囊结节型最多见,大囊小结节型尤为典型[13],结节位于靠近软脑膜或室管膜侧的囊壁上,为囊结节型的实性成分,边界清楚,也是部分病例“脑膜尾征”的病理基础。囊性部分不同于肿瘤的坏死与囊变,可能为邻近正常脑组织发生的继发性改变,可从增强扫描囊壁不强化、囊腔远离脑膜侧、以及囊腔缺乏包膜样结构得到解释。病理上,组成sHBM的血管内壁单层扁平内皮细胞间隙大,通透性高,血清及血液内小分子物质可无障碍漏出,在漏出液张力的持续影响下,继发邻近脑组织囊腔形成,囊变程度与漏出液的量可能存在相关性。此外,漏出液中或壁结节自身分泌液中可能存在一些溶组织蛋白酶,邻近脑组织溶解坏死,加速了囊腔形成与增大,大囊小结节型、大囊大结节型、小囊大结节型和小囊小结节型等不同类型可能与溶组织蛋白酶的量有关。囊液T2-FLAIR信号稍高于脑脊液,提示囊液成分并非单纯脑脊液。病理显示囊液呈淡红色或淡黄色,提示血液成分漏出,若囊内血液成分较多,易误诊为单纯性血肿。壁结节增强后可见显著强化,呈“壁灯征”或“吊灯征”,囊腔及囊壁未见明显强化。DWI上,sHBM的壁结节及实性肿块均呈等或低信号,无明显扩散受限,对其诊断具有一定参考价值。MRS上,壁结节和实性肿块Cho峰可见明显升高,NAA及Cr峰明显降低或近乎消失,Lac峰和Lip峰可见升高,Lac峰升高与肿瘤间质细胞无氧代谢有关,Lip峰与肿瘤内大量间质细胞富含脂质有关[14-15]。
本组资料提示,实性肿块型sHBM与一般肿瘤无异,外形不规则,局部分叶,信号不均,内见线样或蚯蚓样血管流空信号,周围可见范围不等的水肿带环绕。部分病灶内可见条索样或螺旋状异常信号,可能与病理所见的间质细胞及其分泌的纤维成分有关。肿瘤包膜征象不明显,其内散在分布的大小不等囊腔病理所见为血窦样结构。实质肿块强化明显,甚至达邻近血管强化程度,反映了肿瘤富血供本质。
T1WI上,本组部分病例壁结节和实性肿块内可见散在斑片状出血灶,可能与病理所见的毛细血管处于不同发育阶段有关,发育不成熟或生长较快均可导致毛细血管壁脆性加大或局部薄弱而易于破裂出血,外科手术切除过程中应提高警惕。sHBM的MRI表现并非一成不变,病程进展过程中,各型间可发生相互转变,以囊结节型向单纯囊肿型转变多见。
3.4 鉴别诊断sHBM周围可见范围不等的水肿,病灶形态及信号多样,除了大囊小结节型表现典型,MRI容易诊断外,其他各型均缺乏特异性MRI征象,容易误诊。
囊结节型sHBM应与转移瘤及毛细胞型星形细胞瘤等鉴别。转移瘤一般有明确的原发恶性肿瘤病史,多发常见,分布更为广泛,与中枢神经系统以外病灶并存者,倾向于转移瘤诊断。毛细胞型星形细胞瘤实性成分强化程度不及sHBM。
实性肿块型sHBM应与其他实性肿瘤鉴别,如淋巴瘤、髓母细胞瘤、转移瘤、室管膜瘤以及实性颅咽管瘤等。淋巴瘤信号较均匀,T2WI呈等或稍高信号,DWI呈高信号,增强后多呈明显强化[16]。髓母细胞瘤多见于儿童,而sHBM 10岁以下儿童少见。转移瘤分布广泛,结节样及环形强化,有原发病灶。转移瘤与实性肿块型sHBM并存时,鉴别诊断困难。脑室内实性肿块型sHBM强化明显,可并发脑室内出血及蛛网膜下腔出血[17],有助于与室管膜瘤、室管膜下瘤及脉络丛乳头状瘤鉴别。实性颅咽管瘤强化程度不及实性肿块型sHBM,3D-MPRAGE序列MRI易于发现肿块内血窦,3D-FIESTA序列MRI易于显示肿块周围流空血管[18],均有助于鞍区实性肿块型sHBM诊断。
单纯囊肿型sHBM应与蛛网膜囊肿、大囊型脑囊虫病及表皮样囊肿等囊性病变鉴别。蛛网膜囊肿表现为脑脊液信号,周围一般无脑水肿。大囊型脑囊虫病常与其他小囊并存,囊壁可强化,囊内可见头节,偏心性。表皮样囊肿DWI呈高信号,囊壁可强化,邻近脑实质内一般无强化小结节存在。
综上所述,sHBM以中枢神经系统分布为主,血供丰富,术中处理不当可引起致命性大出血。术前MRI对sHBM进行准确的诊断及鉴别诊断,对临床治疗方案的选择具有重要的指导价值。
