miR-21对类风湿关节炎滑膜成纤维细胞增殖与凋亡的影响*
2022-11-18张兵王孝玉朱亚辉张仕慧胡凌云
张兵 王孝玉 朱亚辉 张仕慧 胡凌云
(南充市中心医院 1.骨科;2.医学影像科,四川 南充 637000)
类风湿关节炎(Rrheumatoidarthritis, RA)属于全身性免疫性疾病,以关节滑膜炎症为主要特征,目前其病因和发病机制尚不清楚[1-2]。正常的滑膜组织是由结缔组织以及滑膜衬里层组成,衬里层包括滑膜成纤维细胞(Fibroblast-like synoviocytes,FLS),对维持关节腔具有稳定的作用,参与RA病理变化[3-4]。研究显示,RA与基因表达有关,基因调控FLS细胞的增殖和凋亡,分子靶向治疗可能是RA潜在的治疗方式[5]。miRNA没有编码蛋白质的能力,其长度一般在20 nt左右,miRNA与细胞生长、细胞凋亡、能量代谢、氧化应激等有关[6-8]。miRNA还与人类疾病如肿瘤、糖尿病等疾病的进展有关,对分子靶向治疗的具有重要作用[9-10]。研究显示miR-21具有调控胚胎发育、器官形成、肿瘤、哮喘、成骨分化等的进展有关[11-13]。有研究显示,上调miR-21表达减轻RA大鼠模型关节炎指数,改善RA症状[14]。RA患者中miR-21表达量降低,抑制miR-21能够促进RA-FLS释放炎症因子,以及改善RA患者Th17/Treg细胞失衡[15-16]。这些研究均证明了miR-21参与RA进展。目前尚不明确miR-21在RA-FLS增殖和凋亡中的作用。本次实验体外分离培养RA-FLS,探讨miR-21对RA-FLS增殖、凋亡的影响和可能机制,为基因靶向治疗RA提供可能思路。
1 材料与方法
1.1 主要材料与试剂 RA患者以及健康对照(关节外伤)滑膜组织均采集自2018年7月~2020年2月南充市中心医院;蛋白激酶B(Protein kinase B,Akt)抗体购自美国Invitrogen公司;miR-X miRNA First-Strand Synthesis kit购自丹麦Exiqon公司;B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)抗体购自上海晅科生物科技有限公司;p-PI3K抗体购自上海鑫乐生物科技有限公司;RNAiso for Small RNA购自宝生物工程(大连)有限公司;Bcl-2相关X蛋白(Bcl-2 Associated X Protein, Bax)抗体、p-Akt抗体购自美国santacruze公司;mimics control、miR-21 mimics由Thermo Fisher Scientific公司构建;C-Caspase-3抗体购自美国Santa Cruz Biotechnology公司;磷脂酰肌醇-3激酶(Phospoinositide 3-kinase,PI3K)抗体购自美国Abcam公司。本研究获医院医学伦理委员会审核通过。
1.2 方法
1.2.1 FLS分离培养[13]RA滑膜组织和健康滑膜组织均浸泡在含有10%双抗的PBS溶液内,将表面的脂肪等组织去除,再次用PBS洗涤2次。用剪刀和镊子把组织剪碎,大小约为1 mm3,置于培养瓶内,添加适量的0.4%的Ⅰ型胶原酶消化,期间每间隔30 min将细胞瓶翻转,2 h后,将细胞培养瓶从培养箱中取出,以吸管将细胞沉淀混匀,1000 g离心10 min。添加含有EDTA-0.25%胰蛋白酶的消化液孵育30 min,期间每隔10 min摇晃1次。添加DMEM,过滤(200目),1000 g离心10 min,弃掉上清溶液,添加培养液(10%胎牛血清、1%双抗的DMEM)悬浮,转移到培养皿内常规培养。48 h后,更换新鲜的细胞培养液,将悬浮的细胞弃掉,继续培养,期间每隔2 d换液1次,培养至第3代,经细胞免疫化学法鉴定为FLS(Vimentin表达阳性,CD68表达阴性)。
1.2.2 Realtime PCR方法检测miR-21表达 取第4代RA-FLS和正常-FLS,添加RNAiso for Small RNA试剂,常规方法提取miRNA,将miRNA溶解在DEPC水中,放在-80℃保存。利用miR-X miRNA First-Strand Synthesis kit进行逆转录反应,取0.5 μg的miRNA样品,添加5 μL的mRQ Buffer、1.25 μL的mRQ Enzyme,充分混合后,放在37℃孵育1 h,然后放在85℃孵育5 min,合成的cDNA放在-20℃保存。PCR扩增反应如下:2 μL的cDNA、0.5 μL的mRQ 3'primer、0.5 μL的miRNA-specific primer、0.5 μL的ROX Dye、12.5 μL的SYBR advantage premix,最后添加ddH2O至25 μL,设置反应条件如下:95℃ 10 s,95℃ 5 s,60℃ 20 s,72℃ 30 s。U6作为内参,按照2-△△Ct法计算miR-21的表达变化。
1.2.3 细胞转染和分组 RA-FLS接种到6孔板内,分别把mimics control、miR-21 mimics转染到细胞内,转染步骤按照转染试剂Lipofectamine 2000说明书进行。将转染mimics control、miR-21 mimics以后的RA-FLS设置为miR-NC组、miR-21组,Control组为没有转染的RA-FLS。Control组、miR-NC组、miR-21组细胞培养48 h以后,按照1.2.2中方法检测miR-21的表达差异。
1.2.4 CCK-8实验测定细胞增殖活性变化 RA-FLS配制成5×104个细胞/mL,分别吸取100 μL的细胞悬浮液添加到96孔板内,在37℃过夜,按照Control组、miR-NC组、miR-21组方法分组处理,细胞培养48 h后,分别在细胞中添加10 μL 的CCK-8溶液,继续放在37℃孵育1 h,检测450 nm的A值。A值表示细胞增殖活性大小。
1.2.5 流式细胞术检测细胞凋亡变化 Control组、miR-NC组、miR-21组细胞培养48 h后,收集细胞,分别用PBS将细胞洗涤3次,最后将细胞悬浮在400 μL的结合缓冲液中,添加5 μL的Annexin V-FITC溶液,放在室温孵育20 min,继续添加5 μL的PI溶液,放在室温孵育20 min,立即用流式细胞仪检测细胞凋亡变化。
1.2.6 Western blot方法检测细胞中C-Caspase-3、Bax、Bcl-2、PI3K、p-PI3K、Akt、p-Akt蛋白表达变化 Control组、miR-NC组、miR-21组细胞培养48 h后,分别在细胞中添加细胞裂解溶液(PMSF∶RIPA=1∶100),放在冰上孵育30 min,以细胞刮刀将细胞收集,转移到干净的EP管内,4℃,12000 g离心10 min,上清吸取到新的EP管内,放在-80℃保存。利用BCA蛋白浓度检测试剂盒测定蛋白浓度。配制10%的分离胶和5%的浓缩胶。将蛋白样品和等体积的Loading Buffer混合后,在100℃煮沸5 min。把蛋白添加到上样孔内,每个孔中加40 μg的蛋白。首先按照60 V的电压电泳,等到染料电泳至浓缩胶和分离胶的分层处时,更换成90 V的电压继续电泳,观察染料到达底部边缘之后,停止电泳。NC膜根据凝胶的大小裁剪,然后浸泡在甲醇中湿润15 s,浸泡至转膜缓冲液中孵育5 min。以常规方法在4℃进行转膜,转膜电流为300 mA,转膜2 h后,取出NC膜。将NC膜浸泡在5%牛血清白蛋白中,在室温中孵育1 h。然后将NC膜放在一抗溶液中(C-Caspase-3抗体按照1∶800稀释,Akt、PI3K、Bax、Bcl-2抗体按照1∶1000稀释,p-PI3K、p-Akt抗体按照1∶600稀释),在4℃结合过夜。NC膜放在二抗溶液中,在室温中结合2 h。以ECL方法显色。分析条带的灰度值,根据灰度值,以GAPDH作为参照,分析蛋白水平。
1.2.7 PI3K/Akt信号激活剂对miR-21影响FLS细胞增殖和凋亡的作用测定 取转染了miR-21 mimics后的RA-FLS,以含有100 ng/mL的PI3K/Akt信号通路特异性激活剂胰岛素生长因子-1(Insulin-like growth factor-1,IGF-1)处理,记为miR-21+IGF-1组,以miR-21组为参照,检测细胞增殖(步骤参照1.2.4中CCK-8)、凋亡(步骤参照1.2.5中流式细胞术)和细胞中C-Caspase-3、Bax、Bcl-2、PI3K、p-PI3K、Akt、p-Akt蛋白表达(步骤参照1.2.6中Western blot)。
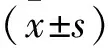
2 结果
2.1 RA-FLS中miR-21表达水平降低 与正常-FLS比较,RA-FLS中miR-21表达水平降低(P<0.05)。提示RA-FLS中miR-21低表达。见表1。
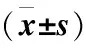
表1 正常-FLS和RA-FLS中miR-21的表达水平比较
2.2 miR-21对RA-FLS增殖和凋亡影响 与Control组、miR-NC组比较,miR-21组RA-FLS细胞中miR-21表达水平升高,细胞增殖活性降低,细胞凋亡率增加,细胞中C-Caspase-3、Bax蛋白表达增多,Bcl-2蛋白表达减少(P<0.05)。提示miR-21降低RA-FLS增殖活性,诱导细胞凋亡。见图1、表2。

图1 miR-21 mimics转染后细胞凋亡和细胞中相关蛋白表达变化
2.3 miR-21对RA-FLS中PI3K/Akt信号通路的作用 与Control组、miR-NC组比较,miR-21组RA-FLS细胞中p-PI3K/PI3K、p-Akt/Akt蛋白水平均降低(P<0.05)。提示miR-21降低RA-FLS中PI3K/Akt信号通路激活水平。见图2、表3。
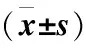
表2 miR-21 mimics转染后细胞增殖活性、凋亡率和细胞中相关蛋白水平比较

图2 上调miR-21对RA-FLS细胞中PI3K/Akt信号相关蛋白表达影响
2.4 PI3K/Akt信号通路激活剂对miR-21影响RA-FLS增殖、凋亡的作用 与miR-21组比较,miR-21+
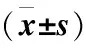
表3 上调miR-21后RA-FLS细胞中p-PI3K/PI3K、p-Akt/Akt蛋白水平比较
IGF-1组RA-FLS增殖活性升高,细胞凋亡率降低,细胞中p-PI3K/PI3K、p-Akt/Akt蛋白表达增多,C-Caspase-3、Bax蛋白表达减少,Bcl-2蛋白表达增多(P<0.05)。提示激活PI3K/Akt信号逆转miR-21对RA-FLS增殖、凋亡作用。见图3、表4。

图3 IGF-1对上调miR-21的RA-FLS细胞凋亡和细胞中相关蛋白表达影响
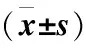
表4 表4 IGF-1上调miR-21后RA-FLS细胞增殖活性、凋亡率和细胞中相关蛋白水平比较
3 讨论
RA发病率较高,患者的关节内发生炎症后,能诱导软骨、骨组织损伤,最终诱导关节功能障碍,影响RA患者正常行动能力和劳动能力[17-19]。滑膜组织增生是RA发生的典型特征,虽然炎症在滑膜衬里层中长期存在,但RA-FLS过度增殖是诱导滑膜增生的关键因素[20-21]。既往研究显示,miRNA参与RA发生,能够影响RA-FLS生物学行为[22]。Liu等[14]研究显示,miR-21与RA有关,过表达miR-21减轻RA大鼠模型关节炎症。Hu等[15]研究结果显示,miR-21对RA-FLS释放炎症因子的有抑制作用。本次实验结果显示,RA-FLS中miR-21表达水平降低,上调miR-21可降低RA-FLS细胞增殖活性,提示上调miR-21抑制RA-FLS增殖,这与以上的研究结果相符合,表明miR-21在RA进展中可能扮演抑制因子的作用。
RA患者中FLS过度增殖的同时细胞凋亡减少。细胞凋亡是一个复杂过程,与细胞凋亡有关调控因子很多,Caspase-3是Caspase蛋白家族中的凋亡执行因子,Caspase-3活化后形成C-Caspase-3被认为是细胞凋亡不可逆的标志[23]。Bcl-2蛋白家族包括促凋亡蛋白和抑凋亡蛋白,Bax属于Bcl-2蛋白家族中的促凋亡蛋白,Bcl-2属于Bcl-2蛋白家族中的抑凋亡蛋白,二者表达改变与细胞凋亡进程有关[24-25]。本研究发现,上调miR-21后的RA-FLS中C-Caspase-3、Bax蛋白表达水平均升高,而Bcl-2蛋白水平降低,上调miR-21诱导RA-FLS凋亡,这与细胞凋亡检测结果相一致,miR-21具有诱导RA-FLS凋亡的作用。
信号通路在RA发生中作用广泛,PI3K/Akt是在RA中过度激活的信号转导通路,降低PI3K/Akt信号激活水平抑制RA-FLS细胞增殖[26]。miRNA不具备编码蛋白质的作用,其可以通过调控下游信号通路发挥生物学作用,并且在不同的病理或生理过程中miRNA的调控机制有差异[27]。本研究结果显示,上调miR-21后的RA-FLS中PI3K/Akt信号激活水平降低,且PI3K/Akt信号激活剂可以逆转上调miR-21抗RA-FLS增殖和诱导细胞凋亡的作用,这进一步说明了miR-21通过PI3K/Akt信号发挥作用。
miR-21在RA-FLS中可能发挥保护作用,miR-21通过降低PI3K/Akt信号激活水平抑制RA-FLS增殖,诱导细胞凋亡,为分子靶向治疗RA提供了参考思路。本研究不足之处在于,miR-21通过PI3K/Akt信号对RA具体作用机制还不明确,需要在后续的实验中进一步探讨。
4 结论
上调miR-21可抑制RA-FLS增殖,诱导细胞凋亡,机制可能与降低PI3K/Akt信号激活水平有关。
