灰鹤大肠杆菌的分离鉴定与致病性
2022-11-17陈文东陈耀年何玉鹏叶文斌苏满春徐永平
陈文东,陈耀年,何玉鹏,叶文斌,苏满春,徐永平
(1.陇南师范高等专科学校农林技术学院,甘肃 成县 742500;2.甘肃农业大学动物医学院,甘肃 兰州 730000;3.西北农林科技大学动物医学学院,陕西 杨凌 712100)
灰鹤(Grusgrus)属鹤形目鹤科,又称千岁鹤、番薯鹤、玄鹤等,为栖息在近水区域和沼泽地的大型迁徙涉禽,其为杂食性动物,常选择草洲、稻田、浅水区和泥滩生境作为栖息地,以植物根茎、植物嫩芽、草籽、蒲公英、农作物种子等为食[1]。我国境内灰鹤的分布广泛,东起黑龙江抚远县,西至新疆喀什地区,南到四川若尔盖草原,北达内蒙古甘河流域,包括甘肃、吉林、内蒙古、青海、黑龙江、新疆和宁夏等,分布范围在东经76°~135°,北纬32°20′~53°[2]。研究表明,甘肃地区灰鹤多为旅鸟或夏候鸟,少部分为冬候鸟,境内陇南山地、兰州黄河、甘南高原、祁连山地、黄土高原和河西走廊的灰鹤为迁徙灰鹤[3]。
本试验从陇南受伤的灰鹤泄殖腔内分离出1株大肠杆菌(Escherichiacoli,E.coli),对其进行生化试验、16S rRNA基因测序和遗传进化树分析,并通过药敏试验和小鼠致病试验对其进行耐药性和致病性分析,为大肠杆菌引起灰鹤腹泻的防治提供科学依据。
1 材料与方法
1.1 主要试剂 麦康凯琼脂培养基、伊红美蓝培养基(EMB)、鲜血琼脂培养基、革兰染液,均购自青岛海博生物技术有限公司;BGI D2 000 Plus DNA Ladder、BGI 2×Super PCR Mix,均购自武汉华大基因科技有限公司;细菌基因组提取试剂盒,购自天根生化科技(北京)有限公司;琼脂糖,购自厦门太阳马生物工程有限公司;磁珠法PCR清洁试剂盒,购自上海硕美生物科技有限公司;18种药敏纸片,购自湖南比克曼生物科技有限公司。PCR引物合成及测序由武汉华大基因科技有限公司完成。
1.2 主要仪器 PCR仪,伯乐生命医学产品(上海)有限公司产品;高速冷冻离心机,湖南湘仪实验室仪器开发有限公司产品;凝胶成像系统,上海天能科技有限公司产品;超净工作台,浙江孚夏医疗科技有限公司产品;恒温恒湿培养箱,上海跃进医疗器械有限公司产品;电热式压力蒸汽灭菌器,浙江新丰医疗器械有限公司产品。
1.3 样品采集及细菌分离纯化 用无菌棉签采集灰鹤泄殖腔内容物,置于装有无菌生理盐水的离心管内,充分混匀后,离心,将上清液接种于麦康凯琼脂平板上,37 ℃恒温培养18 h后,用接种环挑取红色菌落接种于另一麦康凯琼脂平板,继续37 ℃恒温培养18 h,如此反复纯化细菌5次,最后1次将菌株分别接种于鲜血琼脂培养基和伊红美蓝培养基,观察2种培养基上的菌落形态特征,再挑取单菌落进行革兰染色,显微镜下观察细菌的染色特点和形态特征。
1.4 生化鉴定 参照《兽医微生物学实验教程》[4]中生化试验培养基配制方法、操作步骤和结果判定方法,对分离菌进行生化鉴定,观察并记录结果。
1.5 16S rRNA基因PCR扩增及系统进化树分析 常规提取分离菌株的基因组DNA,制备DNA模板并进行16S rRNA的PCR扩增,PCR所用引物序列见表1。PCR反应体系(30 μL):1 μL DNA模板,15 μL 2×GC Buffer Ⅰ,2 μL引物(上、下游各1 μL),最后加ddH2O至30 μL。PCR反应条件:96 ℃预变性5 min;96 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,共35个循环;72 ℃终延伸10 min,于4 ℃保存。参照磁珠法PCR清洁试剂盒说明书纯化PCR产物,纯化后进行1.0%的琼脂糖凝胶电泳检测,观察条带大小,回收PCR产物后寄至武汉华大基因科技有限公司进行测序,测序结果进行NCBI-BLAST比对并用邻接法(Neighbor-Joining algorithm,N-J)构建系统发育树。

表1 引物信息
1.6 药敏试验 用纸片扩散法(Kirby-Bauer,K-B)[5]对分离菌进行药物敏感性试验,参照美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准,调整菌液浓度至5×108CFU/mL,将菌液均匀涂布于普通琼脂平板,静置片刻后,用无菌镊子将18种常用抗菌药药敏纸片贴于平板表面,37 ℃恒温培养18 h,游标卡尺测量抑菌圈直径,结果按耐药(R)、敏感(S)和中介(I)判定。
1.7 致病性试验 将12只BALB/c小鼠(体重18~22 g,雌雄各半)随机分成试验组和对照组,每组6只。试验组腹腔注射细菌悬液(生理盐水将菌液调配至浓度为2.12×109CFU/mL),每只0.5 mL,对照组腹腔注射等量生理盐水,观察小鼠死亡情况,剖检死亡小鼠,做剖检记录,并于病变明显部位取样分离病原菌。将剖检小鼠的心脏、肝脏、脾脏、肺脏和肾脏固定于4%多聚甲醛内,制作病理组织切片,观察各器官的组织形态学变化。
2 结果
2.1 细菌分离纯化 分离菌株可在鲜血培养基上生长,无溶血环;在麦康凯琼脂培养基上生长为红色菌落,菌落呈圆形、半透明,表面湿润光滑,边缘整齐;在伊红美蓝培养基上形成紫黑色菌落,菌落有金属光泽,呈圆形,表面光滑湿润,边缘整齐。革兰染色显示菌体呈长短不一的短杆状,两端钝圆,红色,散在分布。
2.2 生化鉴定 分离菌株可发酵葡萄糖、乳糖、蔗糖和麦芽糖,对甘露醇、MR试验和吲哚试验呈阳性反应,对硝酸盐、尿素酶、硫化氢、V-P试验、柠檬酸盐反应呈阴性反应。上述结果与《伯杰细菌鉴定手册》[6]比对,初步判定分离菌株为大肠杆菌,命名为HH1。
2.3 16S rRNA基因PCR扩增及系统进化树分析 将PCR产物进行1.0%的琼脂糖凝胶电泳检测,样品均可得到明亮的大小为1 500 bp的电泳条带(图1),与预期大小相符,符合测序条件。测序结果进行NCBI-BLAST比对,结果显示,HH1与大肠杆菌的同源性达99%。用MEGA 7.0软件构建系统进化树,结果显示,HH1与大肠杆菌(MT424913.1.seq、MH111527.1.seq、MK729001.1.seq、OK325789.1.seq、MW175585.1.seq)聚为一簇,亲缘关系最近(图2)。PCR扩增、系统进化树分析结果结合生化鉴定结果,判定HH1为大肠杆菌。
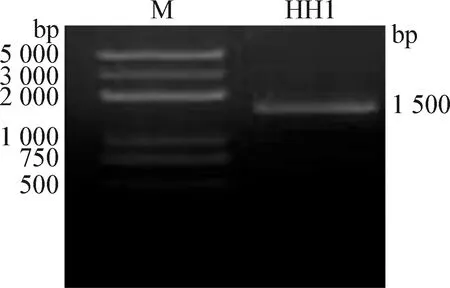
图1 分离菌16S rRNA的PCR扩增
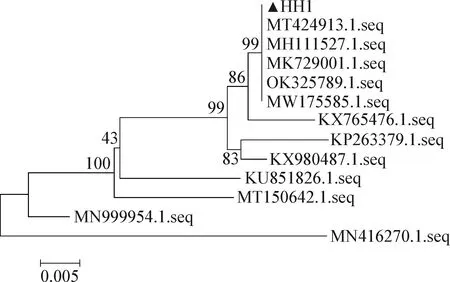
图2 分离菌16S rRNA序列的系统进化树(N-J法)
2.4 药敏试验 HH1对青霉素、红霉素、多西环素和四环素耐药,对庆大霉素、头孢氨苄、头孢哌酮、头孢唑林、头孢曲松、头孢他啶、头孢呋辛、哌拉西林、氨苄西林、卡那霉素、链霉素、阿米卡星、米诺环素和多黏菌素敏感(表2)。
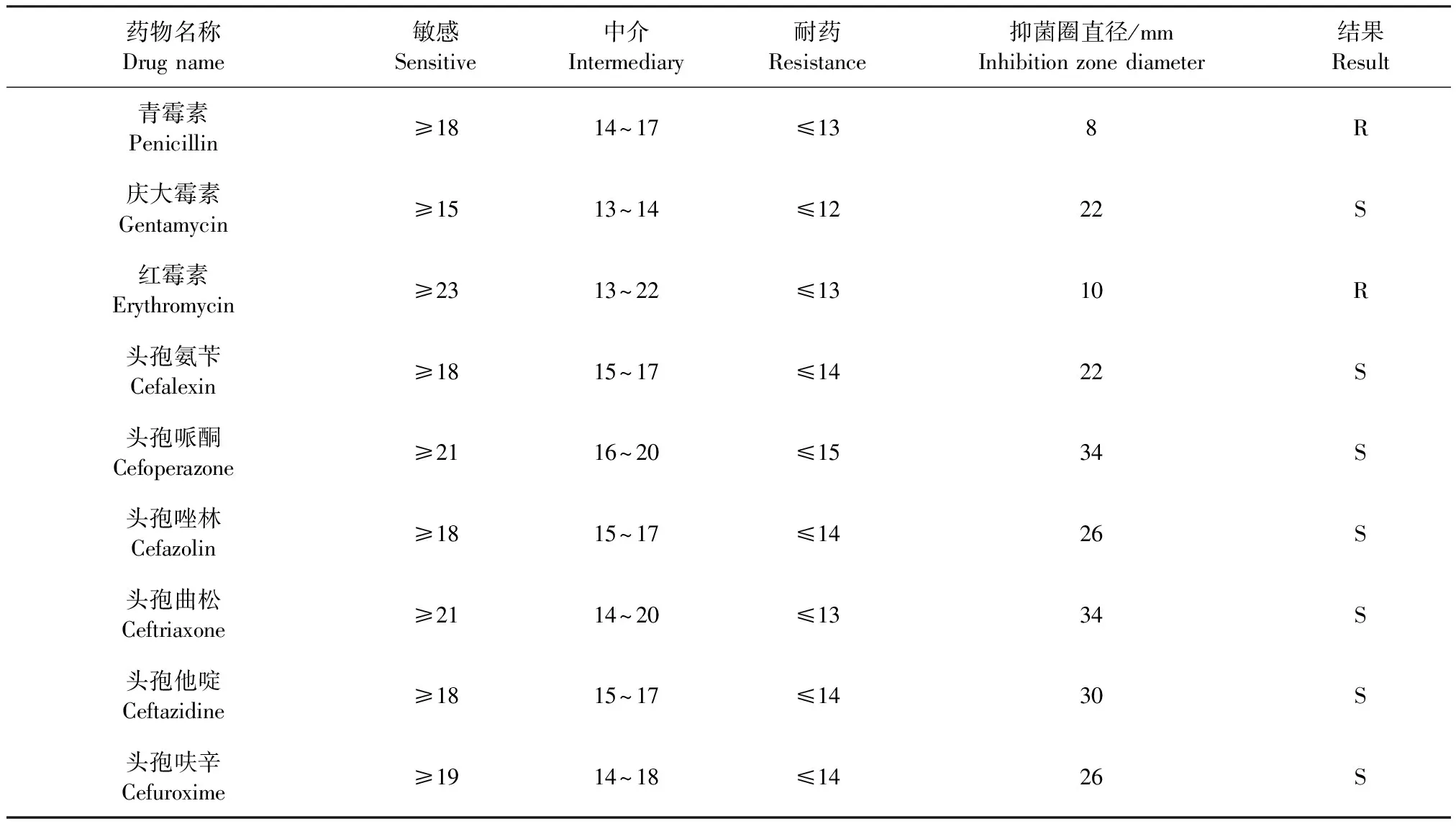
表2 药敏试验结果
2.5 致病性试验 试验组小鼠于腹腔接种细菌悬液8 h后开始出现死亡,至接种17 h后全部死亡,对照组小鼠未见异常。剖检死亡小鼠,可见小鼠胃呈明显臌气状,脾脏、肾脏出现轻微充血,肺脏有明显淤血斑块。从死亡小鼠的肺脏内分离病原菌,经鉴定为大肠杆菌,与攻毒菌株一致。病理组织切片观察可见,死亡小鼠肺脏肺泡内有明显的渗出,其余内脏组织未见明显病理变化。
死亡小鼠内脏病理切片结果显示,心脏未见明显异常,可见纵切心肌纤维及部分心肌纤维断面,心肌细胞和结缔组织细胞胞核清晰可见,心肌内毛细血管未见扩张;肝脏中央静脉和肝血窦内见少量红细胞,其他结构未见明显异常,肝细胞胞质呈粉红色,边界清晰,胞核呈圆形,蓝紫色,核仁清晰可见,肝细胞以中央静脉为中心呈索状排列,形成不规则的肝索;脾脏未见明显异常,组织切片观察可见明显的白髓和红髓区,白髓内可见中央动脉及动脉周围淋巴鞘,红髓内含较多红细胞,脾小梁清晰可见;肺脏切片可见呼吸性细支气管和大部分肺泡内有明显渗出,部分肺泡外周见少量炎性细胞,肺泡壁略增厚(图3);肾小管部分管腔及管腔之间有红细胞聚集,肾小球未见明显异常。
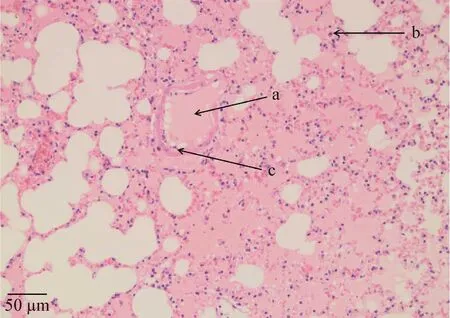
图3 分离菌致死小鼠肺脏病理切片观察(200×)
3 讨论
灰鹤是国家二级保护野生动物,被列入《濒危野生动植物种国际贸易公约》(CITES)附录Ⅱ中[7],据报道,截至21世纪初,我国分布的灰鹤总数为21 632~22 401只[3]。张成林等[8]对我国鹤类疾病发生情况进行统计分析,发现引起鹤类发病的主要原因为细菌感染、寄生虫感染和营养因素,细菌感染因素中大肠杆菌为引起鹤类发病的主要病原菌之一。张伟木等[9]证实,引起3例幼灰鹤死亡的致病性大肠杆菌血清型为O111B14。此外,在孔雀、蓑羽鹤和丹顶鹤等珍稀飞禽中均有因感染大肠杆菌而死亡的病例,因此,大肠杆菌正严重威胁着野生飞禽的生命健康[10-11],给保护珍稀野生飞禽工作带来诸多挑战。
药敏试验结果显示,HH1对青霉素、红霉素、多西环素和四环素具有耐药性。Dou等[12]报道,国内东部地区的243株禽致病性大肠杆菌中,有98%的菌株对四环素耐药;胡紫萌等[13]分离鉴定的禽致病性大肠杆菌对四环素的耐药率更是高达100%;郭长明等[14]分离的大肠杆菌对多西环素的耐药率为100%;彭严严等[15]分离的9株鹅源大肠杆菌全部含β-内酰胺类耐药基因;陈文静等[16]研究表明,鸭源致病性大肠杆菌100%对红霉素耐药,上述研究结果与本试验分离大肠杆菌的耐药性结果一致,这可能是灰鹤在采食或迁徙的过程中与家禽接触产生的相互感染。野生飞禽几乎不使用抗菌药,但其所携带致病菌却表现多重耐药性(对3种或3种以上抗菌药耐药),这可能会严重危害公共卫生安全,值得高度重视[17]。本试验为救治灰鹤的临床用药提供理论依据,并取得了较好的治疗效果。
本试验16S rRNA基因测序结果显示,分离菌株与大肠杆菌同源性最高,达99%。系统发育树分析结果显示,本试验分离菌株与大肠杆菌(MT424913.1.seq、MH111527.1.seq、MK729001.1.seq、OK325789.1.seq、MW175585.1.seq)为同一聚类,亲缘关系最近,而MH111527.1.seq和OK325789.1.seq均为来自于人类肠道内的大肠杆菌,表明该分离菌株有成为人兽共患病病原体的潜在性。
本试验小鼠致病性试验结果显示,分离菌株HH1主要引起小鼠肺泡腔内明显渗出,而对其他器官(心、肝、脾、肾)无明显致病作用。研究发现,禽类等多种动物的肺炎、败血症和肠炎等疾病多是因肠外致病性大肠杆菌引起的[18],近年来大肠杆菌引起动物呼吸系统病变死亡的报道较多,有学者分别从水貂肺脏[19]、狐狸肺脏[20]及因患呼吸系统疾病而死亡的水貂肺脏[21]内分离出致病性大肠杆菌。由此可见,本试验分离到的大肠杆菌极有可能为禽肠外致病性大肠杆菌,且该菌具有一定的器官侵害倾向。
