基于UHPLC-Q-Exactive-Orbitrap-MS的苦黄注射液化学成分分析
2022-11-16王允吉王海丹刘璐张引兰童宁曹辉南京中医药大学附属南京医院南京市第二医院药学部南京0003南京中医药大学附属江苏省中医院药理实验室南京009
王允吉,王海丹,刘璐,张引兰,童宁,曹辉*(.南京中医药大学附属南京医院/南京市第二医院药学部,南京 0003;.南京中医药大学附属江苏省中医院药理实验室,南京 009)
苦黄注射液源于张仲景《伤寒论》的茵陈蒿汤(茵陈、大黄、山栀),邹良才老中医改良茵陈蒿汤而得到由大黄、苦参、茵陈、柴胡和大青叶组成的苦黄注射液。该药具有清热利湿、疏肝退黄的功效,主治湿热型黄疸,即因湿热内蕴引起的黄疸型病毒性肝炎患者的退黄[1-2]。目前,有关苦黄注射液的研究多集中于临床疗效观察,研究表明苦黄注射液对黄疸型病毒性肝炎[3]、胆汁淤积性肝病[4]、原发性胆汁性肝硬化[5]等疾病均有较好的疗效。
关于苦黄注射液中的化学成分研究仅有针对某类或某几个特征性成分进行定量分析的报道[6-7],尚未见对苦黄注射液中化学成分进行全面分析的研究。超高效液相色谱-四极杆-静电轨道场离子阱质谱(UHPLC-Q-Exactive-Orbitrap-MS)技术具有高分离性能、高灵敏度及高检测能力,可以进行高精度的定量和定性分析,已广泛用于中药成分分析、药物动力学、体内药物分析等领域[8]。本研究首次采用UHPLC-Q-Exactive-Orbitrap-MS 对苦黄注射液中化学成分进行全面分析,并对其进行药材归属,为明确苦黄注射液药效物质基础,阐明其药理学作用机制提供实验依据。
1 材料
1.1 仪器
Thermo Q-Extractive 液相色谱-四极杆-静电场轨道阱高分辨质谱联用仪(含高压二元泵、自动进样器、柱温箱、四极杆-静电场轨道阱质量分析器)、Xcalibur 3.1 数据分析系统(美国Thermo公司);Heraeus Multifuge X1R 冷冻离心机(美国Thermo 公司);ACQUITY UPLC HSS T3 色谱柱(2.1 mm×100 mm,1.8 μm,美国Waters 公司);Milli-Q Direct 超纯水仪(德国默克Millipore 公司)。
1.2 试药
苦黄注射液(常熟雷允上制药有限公司,批号:2106281,规格:10 mL);乙腈、乙醇(HPLC 级,德国Merck 公司);甲酸(HPLC 级,美国Sigma-Aldrich 公司);纯水取自超纯水仪。
2 方法
2.1 供试品溶液制备
吸取苦黄注射液1 mL,加入纯乙醇溶液3 mL 沉淀后,于2~8℃冰箱中放置24 h 后,离心5 min(4 ℃、12 000 r·min-1),吸取上清液后经0.22 μm 微孔滤膜过滤后得到供试品溶液。
2.2 色谱条件
色谱柱:Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);流速:0.35 mL·min-1;柱温:35℃;0.1%甲酸水为流动相A,乙腈为流动相B,梯度洗脱(0~8 min,0%~25%A;8~23 min,25%~55%A;23~25 min,55%~80%A;25~26 min,80%~100%A;26~27 min,100%A;27~28 min,100%~0%A;28~30 min,0%A);进样量:5 µL。
2.3 质谱条件
离子源为HESI 源,正、负离子检测模式,毛细管电压为3500 V,毛细管温度为350 ℃,离子源温度为350℃,鞘气流速为9 L·min-1,辅助气流速为3 L·min-1,阶梯碰撞能量:25、35、45 eV,检测方式为Full MS/dd-MS2,一级质谱分辨率Full MS 70 000 FWHM(Full Width at Half Maximum),二级质谱分辨率dd-MS217 500 FWHM,扫描范围m/z100~1000 Da。
2.4 数据处理
通过查阅Scifinder、Chemspider 数据库和相关文献,收集整理了苦黄注射液中各类化学成分的结构式以及化合物的裂解规律。运用Xcalibur 3.0 软件进行质谱数据处理,通过高分辨质谱计算出分子式(误差范围±1×10-5),结合目前已有文献信息推测可能的化合物的裂解规律,并根据相同类型的化合物的裂解规律对化合物进行质谱鉴定。
3 结果
3.1 苦黄注射液中化学成分分析
采用UHPLC-Q-Exactive Orbitrap-MS 正负离子模式分析苦黄注射液乙醇沉淀后的(+)HESIMS、(-)HESI-MS 的质谱总离子流图(TIC)(见图1),通过UHPLC-Q-Exactive Orbitrap-MS 技术检测得到离子流峰的保留时间和质谱数据信息,进行数据处理,共鉴定出苦黄注射液中化学成分123 个[9-25],其中包括黄酮类36 个、酚酸类20 个、生物碱类19 个、蒽醌类15 个、氨基酸11 个、核苷类8 个、萜类6 个、脂肪酸类3 个,糖类1 个等,化合物结果见表1。
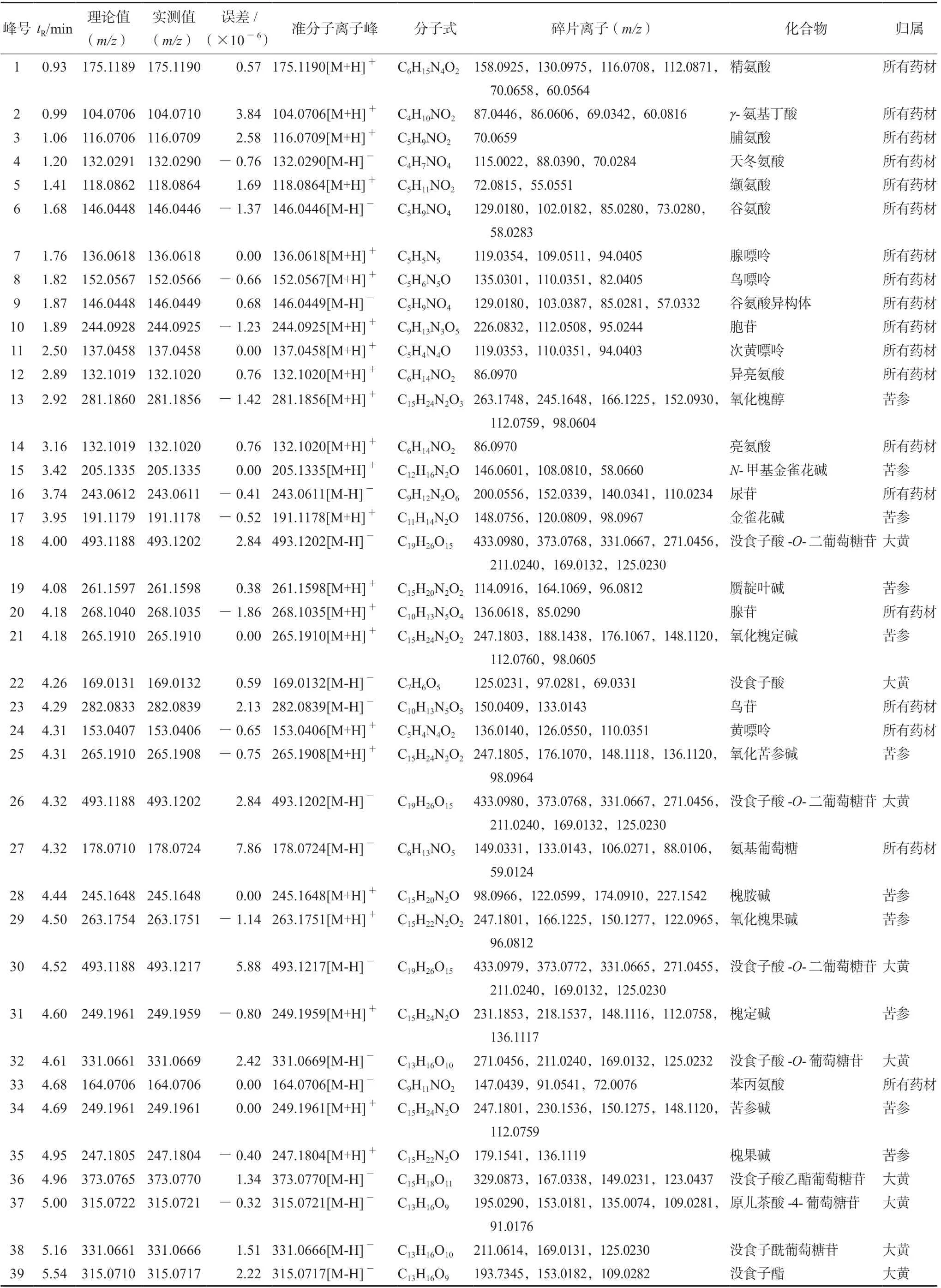
表1 苦黄注射液中化学成分的UHPLC-Q-Exactive-Orbitrap-MS 鉴定结果Tab 1 Identified chemical constituents in Kuhuang injection by UHPLC-Q-Exactive-Orbitrap-MS

续表1
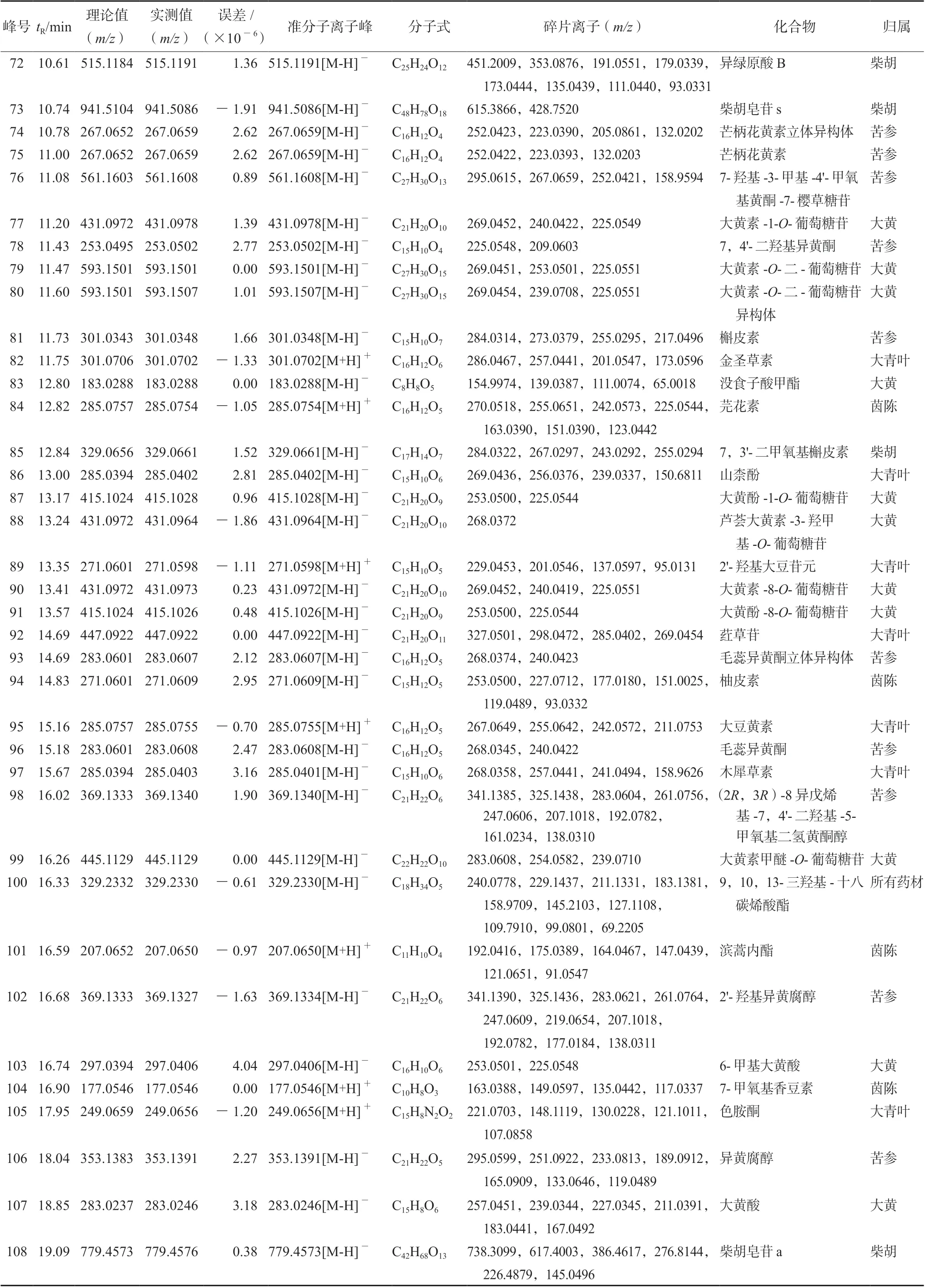
续表1

续表1
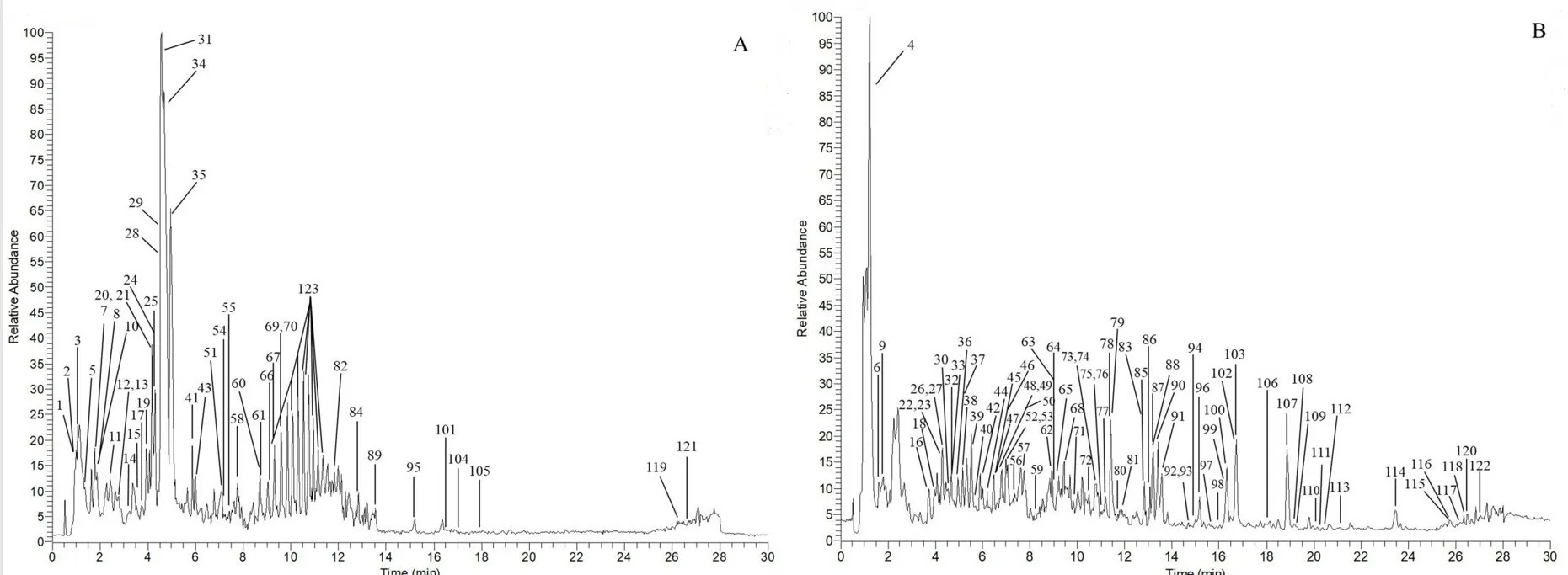
图1 ESI+模式(A)和ESI-模式(B)下苦黄注射液的总离子流图Fig 1 Total ion chromatogram of Kuhuang injection under the positive ion(A)and the negative ion(B)modes
3.2 苦黄注射液中主要化合成分的质谱裂解规律
3.2.1 黄酮类化合物的分析鉴定 苦黄注射液中共鉴定出黄酮类化合物36 种,该类成分主要来自于大黄、茵陈和大青叶。现以芫花素、柚皮素为例,依据多级碎片信息,解析苦黄注射液中黄酮类成分的质谱裂解规律。
峰84 保留时间为12.82 min,可观察到准分子离子峰m/z285.0754 [M+H]+,同时可观察到主要的碎片离子分别为m/z270.0518、255.0651、242.0573、225.0544、163.0390、151.0390、123.0442,分别对应的分子式为[M+HCH3]+、[M+H-CH2O]+、[M+H-C2H2O]+、[M+H-CO3]+、[M+H-C7H6O2]+、[M+H-C8H6O2]+、[M+HC9H6O3]+,根据正离子模式下的精确分子质量及特征碎片的质量,结合相关文献[9-11]可判断该化合物为芫花素,其裂解规律见图2。
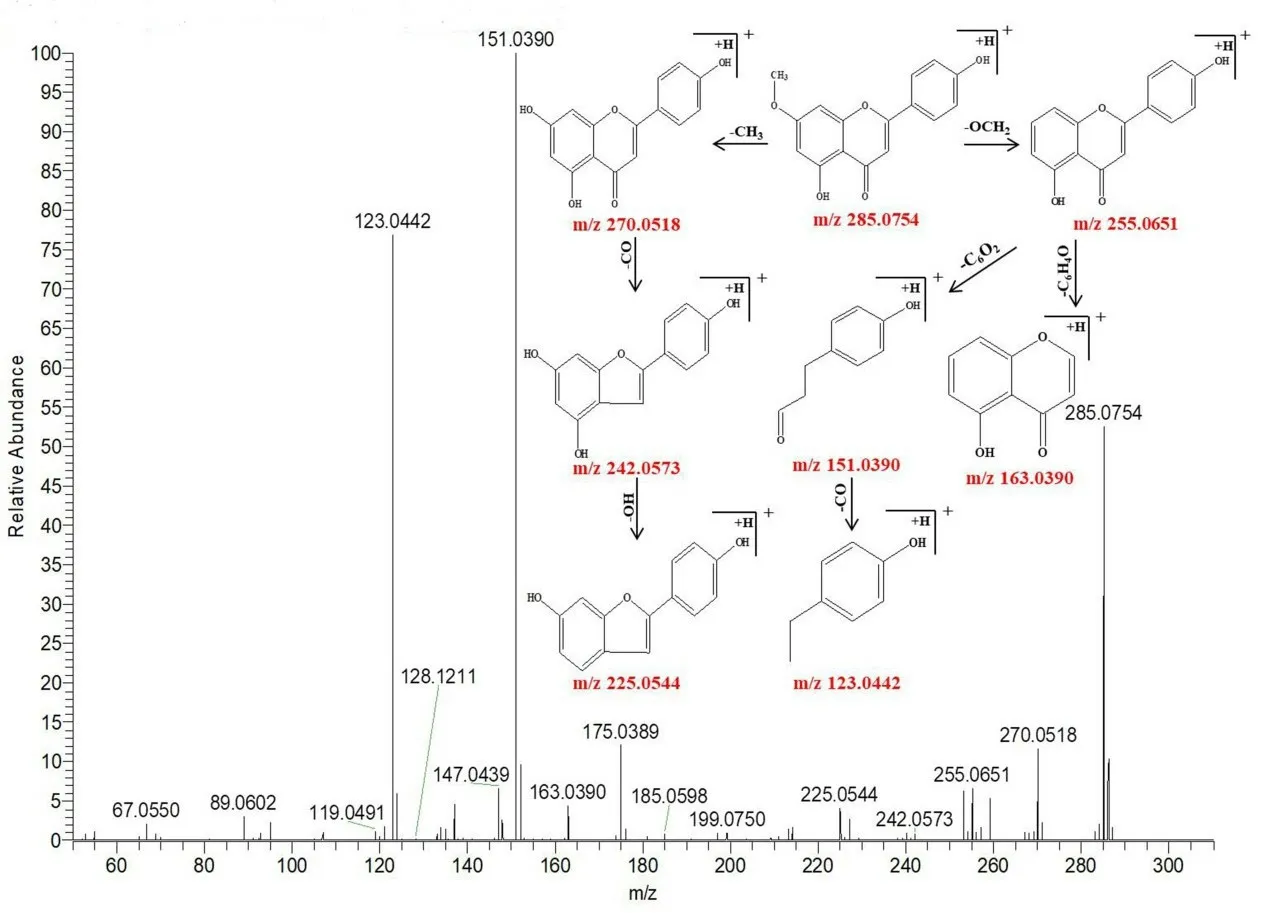
图2 芫花素可能的裂解途径Fig 2 Possible fragmentation pathways of genkwanin
峰94 保留时间为14.83 min,可观察到准分子离子峰m/z271.0609 [M-H]-,同时可观察到主要的碎片离子分别为m/z253.0500、227.0712、177.0180、151.0025、119.0489、93.0332,分别对应的分子式为[M-H-OH]-、[M-H-CO2]-、[MH-C6H6O]-、[M-H-C8H8O]-、[M-H-C7H4O4]-、[M-HC9H6O4]-,根据负离子模式下的精确分子质量及特征碎片的质量,结合相关文献[9-11]可判断该化合物为柚皮素,其裂解规律见图3。
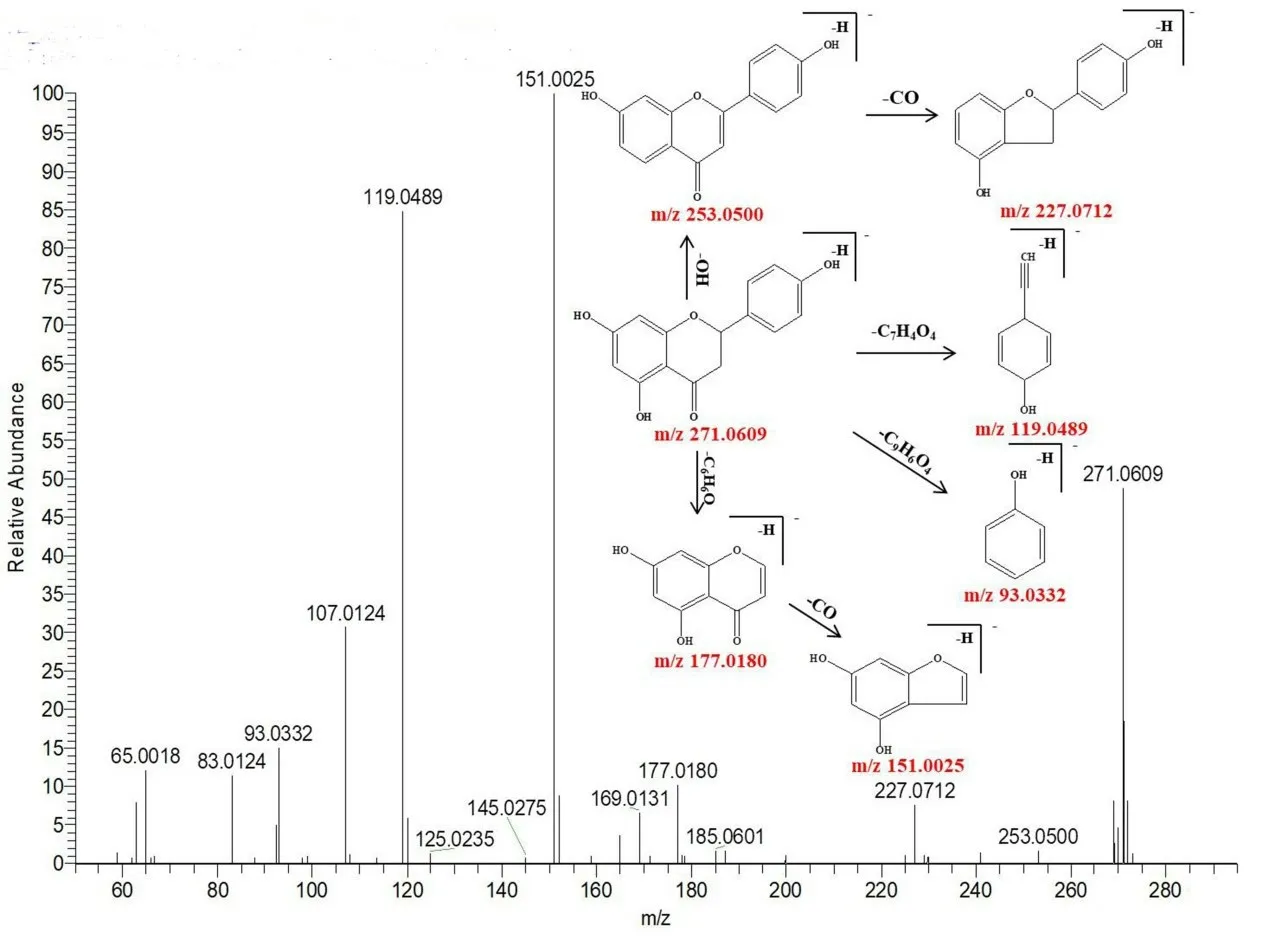
图3 柚皮素可能的裂解途径Fig 3 Proposed fragmentation pathways of naringenin
3.2.2 酚酸类及其化合物的分析鉴定 苦黄注射液中共鉴定出酚酸类成分20 种,该类成分主要存在于该组方中的大黄、柴胡和茵陈。
峰42 保留时间为5.90 min,可观察到该化合物的准分子离子峰为m/z353.0872 [M-H]-,与其分子式C16H18O9相符,其主要的碎片离子分别为m/z191.0551、179.0339、173.0441、161.0231、135.0438,归属各碎片离子分别为[M-H-C9H6O3]-、[M-HC7H10O5]-、[M-H-C9H8O4]-、[M-H-C7H12O6]-、[M-HC8H10O7]-,根据负离子模式下精确相对分子质量和二级质谱碎片信息,结合相关文献[10,12-13]可判断该化合物为绿原酸,其裂解规律见图4。
峰22 保留时间为4.26 min,可观察到该化合物的准分子离子峰为m/z169.0132 [M-H]-,与其分子式C7H6O5相符,其主要的碎片离子分别为m/z125.0231、97.0281、69.0331,归属各碎片离子分别为[M-H-CHO]-、[M-H-C3H4O3]-、[M-HC3O4]-,根据负离子模式下精确相对分子质量和二级质谱碎片信息,结合相关文献[15-17,21-22]可判断该化合物为没食子酸,其裂解规律见图5。

图5 没食子酸可能的裂解途径Fig 5 Proposed fragmentation pathways of gallic acid
3.2.3 生物碱类化合物的分析鉴定 苦黄注射液中共鉴定出种生物碱类化合物19 种,该类成分主要来自于苦参和大青叶。峰17 保留时间为3.95 min,可观察到该化合物的准分子离子峰为m/z191.1178 [M+H]+,与其C11H14N2O 分子式相符,其主要的碎片离子分别为m/z148.0756、120.0809,归属各碎片离子分别为[M+H-C2H5N]+、[M+HC3H5NO]+,结合相关文献[18-19]可判断该化合物为金雀花碱,其裂解规律见图6。
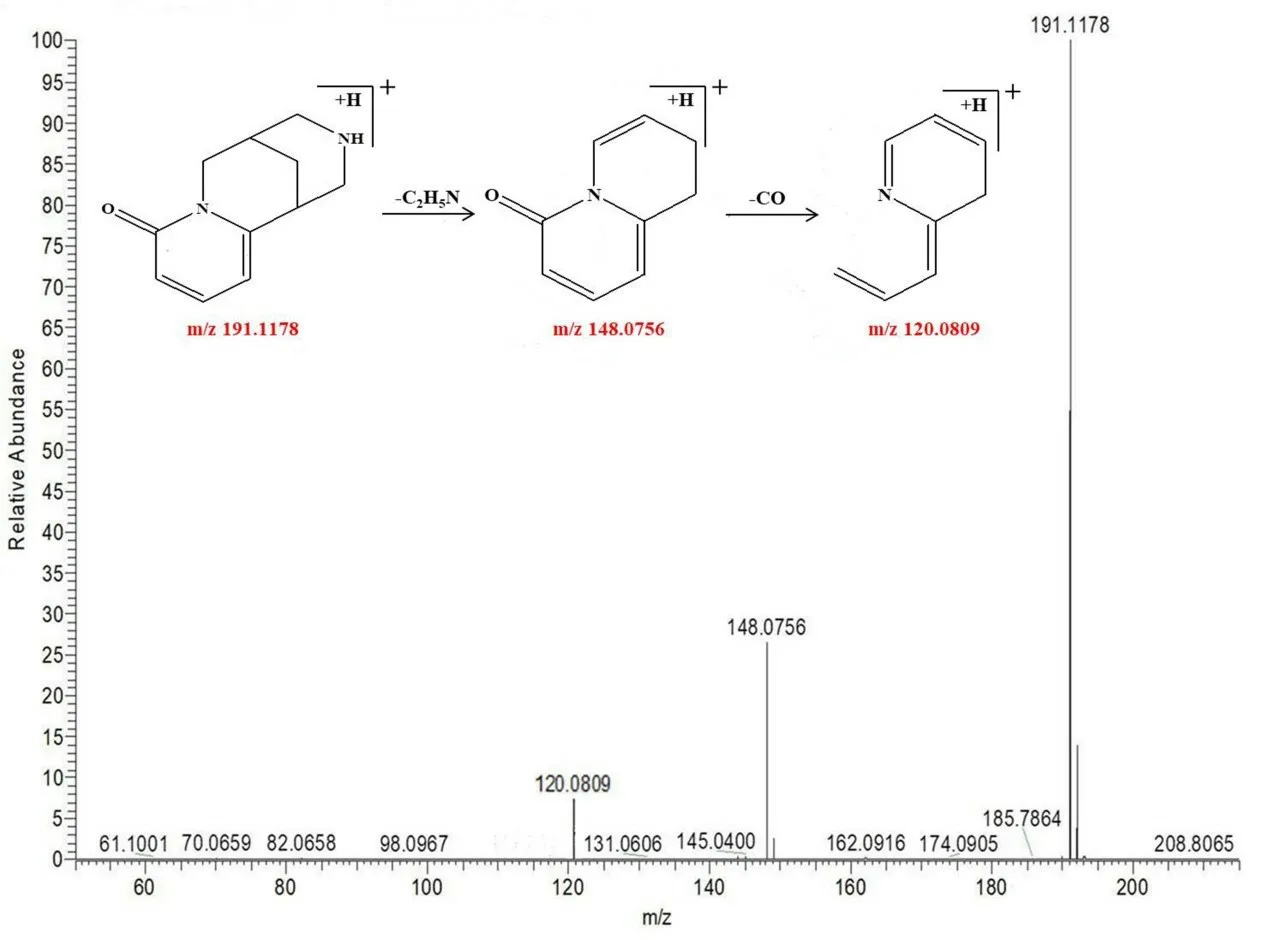
图6 金雀花碱可能的裂解途径Fig 6 Proposed fragmentation pathways of cytisine
峰34 保留时间为4.69 min,可观察到该化合物的准分子离子峰为m/z249.1961 [M+H]+,与其C15H24N2O 分子式相符,其主要的碎片离子分别为m/z247.1801、230.1536、150.1275、148.1120、112.0759,归属各碎片离子分别为[M+H-H2]+、[M+H-OH]+、[M+H-C5H8NO]+、[M+HC5H10NO]+、[M+H-C8H10NO]+,结合相关文献[18-20]可判断该化合物为苦参碱,其裂解规律见图7。

图7 苦参碱可能的裂解途径Fig 7 Proposed fragmentation pathways of matrine
3.2.4 蒽醌类化合物的分析鉴定 苦黄注射液中共鉴定出种蒽醌类化合物15 种,该类成分主要来自于大黄。现以大黄酸、大黄素、大黄酚为例,依据多级碎片信息,解析苦黄注射液中蒽醌类成分的质谱裂解规律。
其中峰107 保留时间为18.85 min,可观察到准分子离子峰m/z283.0246 [M-H]-,同时可观察到主要的碎片离子分别为m/z239.0344、211.0391、183.0441,分别对应的分子式为[M-H-CO2]-、[M-HC2O3]-、[M-H-C3O4]-,根据负离子模式下的精确分子质量及特征碎片的质量,结合相关文献[15-17,21-22]可判断该化合物为大黄酸,其裂解规律见图8。

图8 大黄酸可能的裂解途径Fig 8 Proposed fragmentation pathways of rhein
峰114 保留时间为23.44 min,可观察到准分子离子峰m/z269.0452 [M-H]-,可观察到主要的碎片离子分别为m/z241.0504、225.0553、210.0307、197.0596、181.0647,分别对应的分子式为[M-H-CO]-、[M-H-CO2]-、[M-H-C2H3O2]-、[MH-C2O3]-、[M-H-C3H3O3]-,根据负离子模式下的精确分子质量及特征碎片的质量,结合相关文献[15-17,21-22]可判断该化合物为大黄素,其裂解规律见图9。

图9 大黄素可能的裂解途径Fig 9 Proposed fragmentation pathways of emodin
峰118 保留时间为26.33 min,可观察到准分子离子峰m/z253.0501 [M-H]-,可观察到主要的碎片离子分别为m/z225.0503、183.0665,分别对应的分子式为[M-H-CO]-和[M-H-C3H3O3]-,根据负离子模式下的精确分子质量及特征碎片的质量,结合相关文献[15-17,21-22]可判断该化合物为大黄酚,其裂解规律见图10。
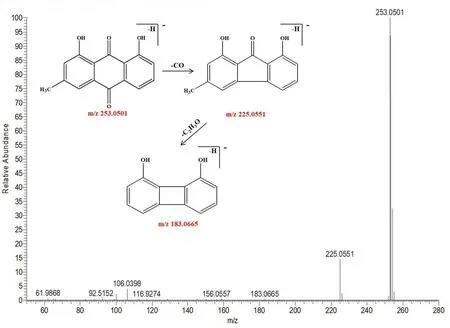
图10 大黄酚可能的裂解途径Fig 10 Proposed fragmentation pathways of chrysophanol
3.2.5 氨基酸与核苷类化合物分析鉴定 苦黄注射液中共鉴定出氨基酸与核苷类成分分别为11种和8 种,该类成分主要存在于本组方中的各味中药材。
峰1 保留时间为0.93 min,可观察到该化合物的准分子离子峰为m/z175.1190 [M+H]+,与其分子式C6H15N4O2相符,其主要的碎片离子分别为m/z158.0925、130.0957、116.0708、112.0871、70.0658、60.0564,归属各碎片离子分别为[M+HOH]+、[M+H-COOH]+、[M+H-CH6N3]+、[M+HCH6NO2]+、[M+H-C2H8N3O2]+、[M+H-C5H10NO2]+,根据正离子模式下精确相对分子质量和二级质谱碎片信息,结合数据库HMDB 和文献[23]中化合物信息,可判断该化合物为精氨酸,其裂解规律见图11。

图11 精氨酸可能的裂解途径Fig 11 Proposed fragmentation pathways of arginine
峰7 保留时间为1.76 min,可观察到该化合物的准分子离子峰为m/z136.0618 [M+H]+,与其分子式C5H5N5相符,其主要的碎片离子分别为m/z119.0354、109.0511,94.0405,归属各碎片离子分别为[M+H-NH3]+、[M+H-CHN]+、[M+HCH3N2]+,结合数据库HMDB 和文献[23]中化合物信息,可判断该化合物为腺嘌呤,其裂解规律见图12。

图12 腺嘌呤可能的裂解途径Fig 12 Proposed fragmentation pathways of adenine
4 讨论
本研究利用UHPLC-Q-Exactive Orbitrap-MS技术对苦黄注射液的化学成分进行了系统分析,通过分析正负离子模式下质谱提供的准分子离子[M+H]+和[M-H]-数据,并结合质谱的高分辨率可得到化合物的可靠相对分子质量,从而快速分析苦黄注射液中的组分结构,并对其中12 种主要成分可能的裂解规律进行了描述,以期为苦黄注射液的质量控制以及后续阐明苦黄注射液的药效物质基础提供了详实的数据支撑。
本次研究中鉴定出的化合物中,黄酮类、酚酸类、生物碱类和蒽醌类成分中有保肝退黄的相关报道[26-33]。如苦参的生物碱类化学成分苦参碱和氧化苦参碱可通过抑制Notch 信号通路促进肝卵圆细胞向肝细胞分化,减轻肝损伤[26];也可通过与表皮生长因子受体(EGFR)结合在细胞表面,抑制其功能,阻断与EGFR 相关的下游信号通路,可减缓肝纤维化的发生和发展,保护肝实质细胞,从而改善肝功能[27];还具有抗乙肝病毒活性作用[28]。柴胡的主要成分柴胡皂苷对胆碱酯酶有抑制作用,能发挥拟胆碱样作用,调节消化系统和神经系统的功能[29],也可抑制机体脂质过氧化作用的发生,对生物细胞膜产生保护作用,减少自由基与生物细胞膜的接触,避免自由基对细胞膜的破坏从而降低肝损伤[30-31]。茵陈中主要活性物质绿原酸能减轻肝组织的慢性炎性反应及汇管区胆管增生反应,减缓肝纤维化进程[32]。大黄中的大黄素、大黄酸、芦荟大黄素和鞣质等成分能促进胆汁、胆汁酸和胆红素分泌,引起胆囊收缩,增强十二指肠和胆管舒张,疏通胆道和微细胆小管内瘀积的胆汁,而起利胆、退黄作用[33]。上述化合物的药理作用与苦黄注射液清热利湿、疏肝退黄的功效一致,且在谱图中有明显的峰形,可能是苦黄注射液主要的药效物质基础。
