食物蛋白诱导的直肠结肠炎与沙门菌肠炎临床对比分析
2022-11-16舒赛男
陈 凡 简 翠 舒赛男
华中科技大学同济医学院附属同济医院 1.儿科,2.检验医学中心(湖北武汉 430030)
腹泻是婴幼儿常见就诊原因,在低收入和中等收入国家,是5岁以下儿童患病和死亡的主要原因,其病因分为感染性和非感染性[1]。食物蛋白诱导的直肠结肠炎(food protein-induced proctocolitis,FPIP)和沙门菌肠炎是婴幼儿腹泻的常见病因。FPIP,又称过敏性结肠炎,是一种由非IgE介导的食物过敏相关胃肠道疾病,主要表现为血丝便和黏液便为特征的腹泻,通常在生后几天到6个月内发病,多见于母乳喂养儿童,饮食回避可疑过敏食物72~96小时临床症状可好转,由于皮肤点刺试验和血清食物特异性IgE(sIgE)常为阴性以及粪常规检出白细胞、红细胞,容易被误诊为细菌性肠炎。沙门菌肠炎是一种食源性急性传染病,主要通过接触被污染的食物、动物等传播,表现为发热、腹泻、血便和呕吐等,部分病例可进展为严重肠道外侵袭性感染(菌血症、骨髓炎和脑膜炎等),及时诊断和恰当的抗感染治疗尤为重要。本研究采用回顾性研究方法,对婴幼儿期FPIP和沙门菌肠炎临床资料进行对比分析,总结临床特征差异,为早期鉴别两种肠炎提供依据。
1 对象与方法
1.1 研究对象
选择2013年1月至2019年12月收治的1~36月龄FPIP和沙门菌肠炎患儿为研究对象。FPIP组纳入标准[2]:①一般状况良好的患儿出现血便和/或腹泻,回避可疑食物后症状缓解,再次接触,症状复现;②对于临床症状不典型,常规治疗无反应和/或需要排除其他疾病的患儿,进行结肠镜检查和病理活检,肠黏膜组织病理学符合Odze等[3]提出的组织学标准。排除标准:患有感染性肠炎、炎症性肠病、肠息肉、梅克尔憩室、凝血功能障碍、免疫缺陷等疾病。沙门菌肠炎组纳入标准:免疫功能正常的患儿粪便培养提示沙门菌阳性,有腹泻或发热表现。
1.2 方法
1.2.1 临床资料收集 收集患儿的临床资料,包括性别、入院时间、入院年龄、发病年龄、喂养史、湿疹史、特应性疾病家族史、发病诱因,临床表现,辅助检查包括血常规、C反应蛋白(CRP)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、25 羟维生素D、粪常规、食物过敏原sIgE、粪便培养及药敏试验,治疗包括抗生素种类及疗程。
1.2.2 相关诊断标准 ①贫血:采用国内小儿血液会议(1989年)及世界卫生组织定义[4],即1~4月龄血红蛋白(Hb)<90 g/L,4~6 月龄<100 g/L,6 月龄~6 岁<110 g/L。②肝功能异常:采用国家卫生健康委员会发布的《儿童临床常用生化检验项目参考区间》,ALT在28 天~1 岁>71 U/L,1~2 岁>42 U/L,2~13 岁>30 U/L为升高;AST在28 天~1 岁>80 U/L,1~2 岁>59 U/L,2~13 岁>44 U/L为升高。③维生素D缺乏:血清25羟维生素D含量<20 ng/mL。④食物过敏原sIgE 检测(包括蛋清、牛奶、花生、大豆、牛肉、羊肉、鱼、螃蟹和虾)判定标准:阴性为<0.35 IU/mL,阳性≥0.35 IU/mL。
1.2.3 细菌培养及药敏试验 粪便标本常规接种麦康凯平皿和XLD平皿(广州市迪景微生物科技有限公司),严格按照《全国临床检验操作规程》进行细菌培养。将可疑沙门菌株用Vitek 2 Compact全自动细菌鉴定仪(法国生物梅里埃公司)或MALDITOF MS仪(德国Bruker公司)鉴定,用沙门菌属血清诊断试剂(购自宁波天润生物药业有限公司)进行血清分型。药敏试验采用纸片扩散法(K-B 法)。操作及结果判读参照美国临床实验室和标准化委员会(CLSI)标准,质控菌株为大肠埃希菌ATCC 25922、ATCC 35218和铜绿假单胞菌 ATCC 27853。同一患儿选取首次药敏试验结果。
1.2.4 粪菌移植治疗 获医院伦理委员会审核批准(TJ-C20140712),所有受菌者和供菌者均签署知情同意书,采用结肠镜及保留灌肠方式,按照国内儿童粪菌移植技术规范[5]进行操作,移植次数2~4次。
1.3 统计学分析
采用SPSS 23.0统计软件进行数据分析。非正态分布计量资料以中位数(P25~P75)表示,组间比较采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
FPIP组191例,男106例、女85例,中位发病年龄3.8(1.5~7.4)月;沙门菌肠炎组120例,男75例、女45例,中位发病年龄14.7(9.9~20.0)月。与沙门菌肠炎组相比,FPIP组入院和发病年龄均较小,病程较长,湿疹史比例较高,差异有统计学意义(P<0.001)。FPIP组的发病年龄以<6 月为主,沙门菌肠炎组以6~24月龄为主。见表1。FPIP全年散发,沙门菌肠炎发病主要分布于夏秋季节(6~10 月,图1)。

表1 FPIP组与沙门菌肠炎组一般资料比较

图1 季节分布特征
FPIP组28例(14.7%)患儿起病前有食物种类改变,如转奶、添加新辅食、进食高敏食物等;沙门菌肠炎组13例(10.8%)起病前有可疑不洁饮食史,如冰冻葡萄、西瓜、车厘子、酸奶、黄鱼、生鸡蛋,外出就餐等,1例起病前有海狮接触史。
2.2 两组临床症状比较
FPIP组发生腹泻172例(90.1%),其中急性腹泻31例、迁延性腹泻94例、慢性腹泻47例;沙门菌肠炎组腹泻113例(94.2%),急性腹泻101例、迁延性腹泻12 例、慢性腹泻0 例。两组之间腹泻发生率差异无统计学意义(P>0.05);腹泻类型差异有统计学意义(P<0.05,表2)。
与沙门氏菌肠炎组比较,FPIP 组肉眼血便、黏液便、黏液血便的发生率较高,而呕吐和发热的发生率较低,差异均有统计学意义(P<0.05)。FPIP组有5例合并轻度营养不良,沙门菌肠炎组无营养不良发生。见表2。
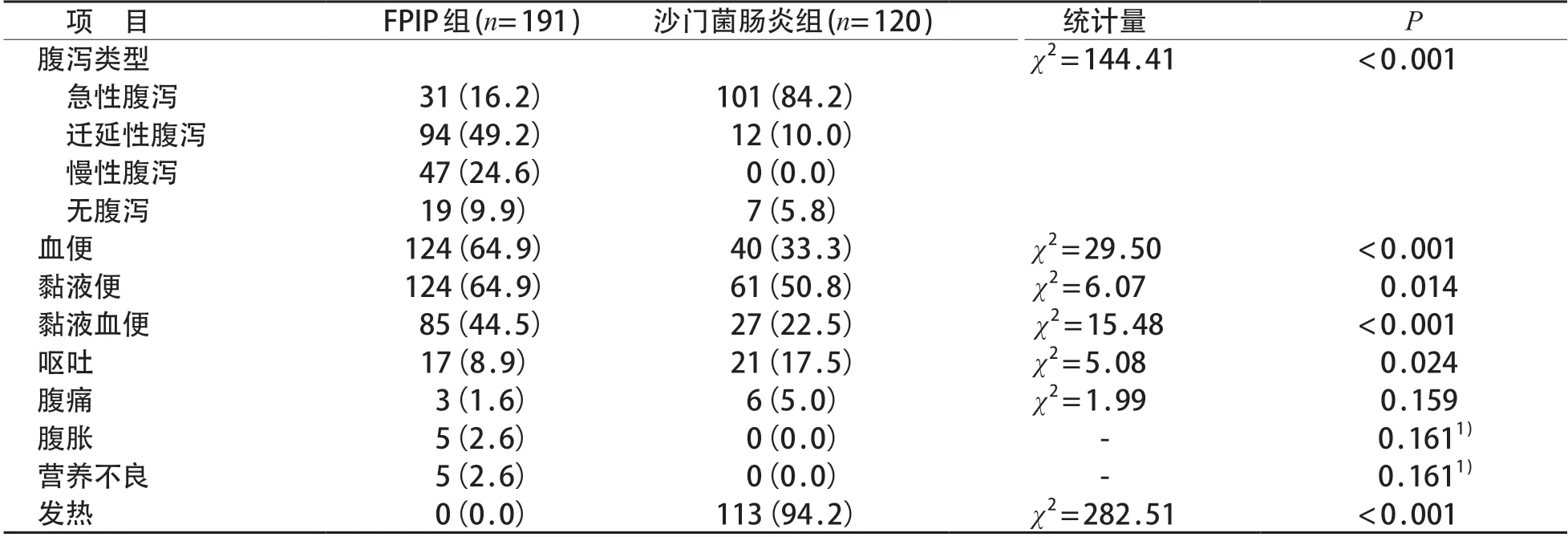
表2 FPIP组与沙门菌肠炎组临床症状比较[n (%)]
2.3 两组实验室检查比较
与沙门菌肠炎组比较,FPIP组CRP>10 mg/L,贫血,粪常规可见红细胞、白细胞以及红白细胞均可见的比例较低,嗜酸性粒细胞(EOS)>0.5×109/L-1、血小板(PLT)>500×109/L的比例较高,中性粒细胞(NEU)计数和25羟维生素D水平较低,EOS和PLT计数较高,差异有统计学意义(P<0.05)。见表3。FPIP组有2例出现低白蛋白血症(白蛋白分别为13.9 g/L和27.9 g/L),沙门菌肠炎组白蛋白水平均正常。
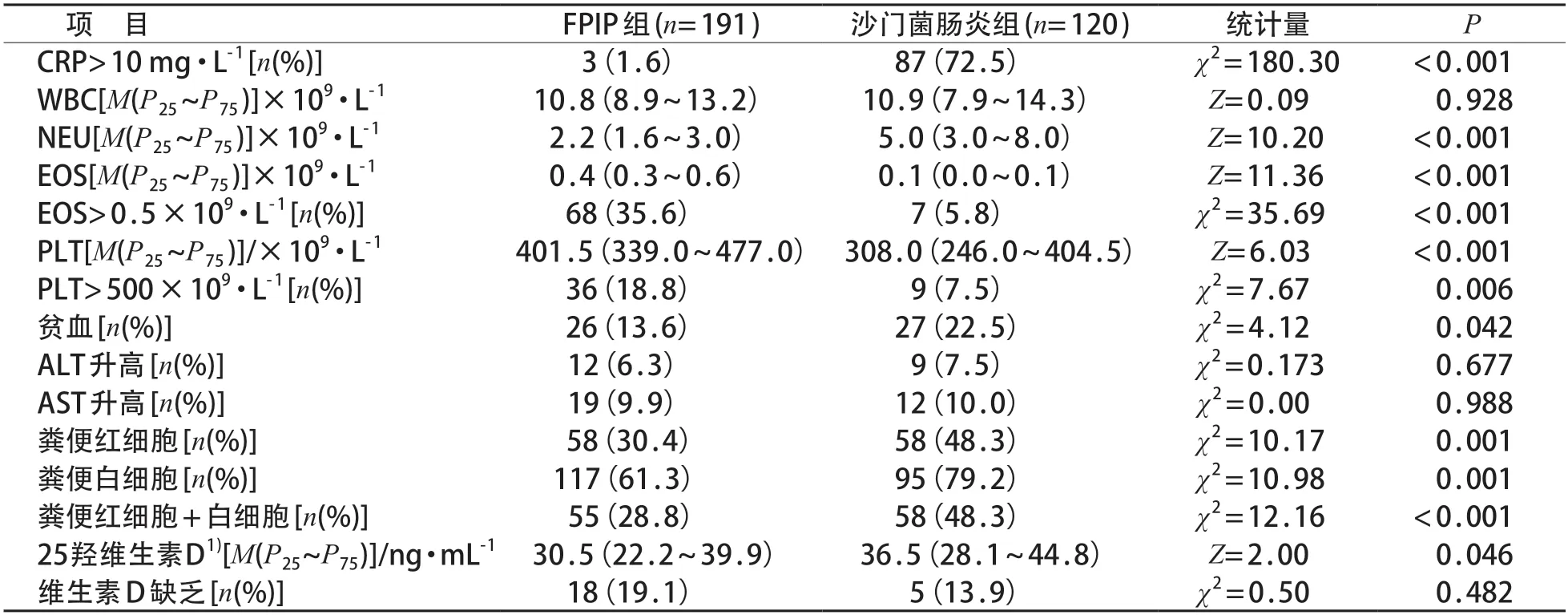
表3 FPIP组与沙门菌肠炎组实验室检查比较
161例FPIP患儿进行食物过敏原sIgE检测,45例阳性(牛奶25例、蛋清15例、牛肉15例、羊肉15例、鱼7例、大豆6例、花生4例、虾4例、螃蟹3例);38例沙门菌肠炎患儿进行sIgE检测,24例阳性(牛奶16 例、蛋清9 例、牛肉9 例、羊肉3 例、大豆3 例、花生3例、螃蟹3例、鱼2例)。沙门氏菌肠炎组食物过敏原sIgE阳性率高于FPIP组,差异有统计学意义(χ2=16.82,P<0.001)。
沙门氏菌肠炎组有63 株沙门氏菌进行了血清型鉴定,以鼠伤寒沙门氏菌血清型最多(81.0%,51/63),其他血清型包括汤普逊沙门氏菌 3例,肠炎沙门氏菌、德比沙门氏菌、猪沙门氏菌各2例,伦敦沙门氏菌、新港沙门氏菌、鸡沙门氏菌 各 1 例。药敏结果,120株沙门氏菌对氨苄西林、氯霉素、甲氧苄啶-磺胺甲噁唑、氨苄西林-舒巴坦、头孢曲松、环丙沙星耐药率分别为75.0%、44.2%、35.0%、29.2%、20.0%和6.7%。其中,对≥3种抗菌药物耐药的多重耐药株有53株(44.2%)。
2.4 治疗
FPIP组185例(96.9%)患儿采用饮食回避过敏食物,临床症状好转;6例因常规治疗(饮食回避、抗组胺药、白三烯受体拮抗剂、益生菌)效果不明显,临床症状严重,病程较长,患儿家长拒绝激素治疗,采用粪菌移植治疗。移植2~4次之后患儿腹泻或血便症状改善明显,无明显不良反应。
FPIP 组住院前后共90 例(47.1%)应用抗生素治疗,抗生素种类涉及24 种,前5 种最常用抗生素依次为头孢噻肟(16/90,17.9%)、头孢哌酮(14/90,15.6%)、头孢克洛(8/90,8.9%)、头孢米诺(7/90,7.8%)和头孢地尼(6/90,6.7%),抗生素治疗中位疗程5.0(3.0~8.0)天。沙门氏菌肠炎组住院前后116例(96.7%)应用抗生素治疗,抗生素种类涉及36种,前5种最常用抗生素依次为头孢哌酮(72/116,62.1%)、头孢地尼(38/116,32.8%)、头孢曲松(25/116,21.6%)、头孢噻肟(23/116,19.8%)、哌拉西林-他唑巴坦(20/116,17.2%);应用碳青霉烯类(美洛培南/亚胺培南)8例,大环内酯类(阿奇霉素)5例,氟喹诺酮类(左氧氟沙星)1例,甲氧苄啶-磺胺甲噁唑1 例。抗生素治疗中位疗程10.0(7.0~14.0)天。另有4例患儿未使用抗生素,仅对症支持治疗好转出院。沙门菌肠炎组抗生素使用率高于FPIP 组,差异有统计学意义(χ2=80.90,P<0.001)。
3 讨论
本研究FPIP组患儿相对于沙门菌肠炎组发病年龄更早。FPIP组多在6月龄以内发病,与相关研究报道基本一致[6],可能与此年龄段患儿胃肠道功能和免疫系统发育不完善有关。而沙门菌肠炎大部分在6~24月龄发病,12~24月龄比例最高,与相关研究报道一致[7]。6月龄以上儿童接触食物和活动范围增加,但2岁以内儿童免疫系统发育尚不成熟,故沙门菌感染以6~24月龄儿童患病居多。FPIP病程明显长于沙门菌肠炎,除了与疾病本身致病机制有关,也可能与照料者就医意识有关。FPIP短期内一般不影响生长发育,不易引起家长重视,或被误认为细菌性肠炎,而反复使用抗生素可导致病情迁延;沙门菌肠炎往往腹泻频繁,症状较明显,影响患儿精神食欲,通常就诊及时。
详细的病史询问有助于鉴别FPIP和沙门菌肠炎。FPIP全年散发,无明显季节分布差异,但有研究认为食物过敏的发生与出生季节密切相关,秋季和冬季出生的儿童食物过敏发生率更高[8]。本研究沙门菌肠炎病例主要集中于夏秋季节,与宁波地区报道一致[9]。武汉为亚热带季风气候,每年6至10月气温最高,高温有利于沙门菌在食物和环境中定殖和生长,并且在高温条件下沙门菌的毒力基因表达可能会上调[10],因此夏秋季节沙门菌肠炎病例数较多。FPIP是免疫机制介导的食物不良反应,与进食高敏食物有关,儿童常见食物过敏原主要有牛奶、鸡蛋、大豆、小麦、坚果、花生、鱼、海鲜等[11]。人类感染沙门菌主要通过摄入被污染的食物,如动物源性食品(鸡蛋、家禽、奶制品、牛肉等)和水果蔬菜,此外还可以通过人与人之间的接触或与猫、狗、啮齿动物、爬行动物或两栖动物等宠物接触而导致感染[12]。本研究部分FPIP患儿发病前摄入高敏食物,部分沙门菌肠炎患儿有可疑不洁饮食史。此外,有研究显示湿疹是FPIP的危险因素[13],而本研究23.0%的FPIP患儿有湿疹史,高于沙门菌肠炎组(6.7%)。
FPIP 是在食物蛋白驱动下,EOS 浸润直肠和结肠黏膜上皮,导致肠黏膜炎症反应,从而引起血便、腹泻等亚急性和/或慢性临床症状,较少出现呕吐、腹胀、腹痛等症状,短时间内一般不影响生长发育,但是严重者可出现贫血、低蛋白血症和营养不良等[14]。沙门菌肠炎病变主要位于回肠末端、盲肠和结肠,通常具有自限性,发热一般在72小时内消退,腹泻持续3~7天,部分也会迁延为慢性腹泻[15]。与沙门菌肠炎对比,FPIP 更容易出现血便和黏液便,这与FPIP主要累及直肠和乙状结肠有关,而沙门菌感染更容易出现呕吐。
沙门菌肠炎通常有白细胞和中性粒细胞增多以及CRP升高,本研究FPIP组白细胞升高比例与沙门菌肠炎组比较,差异无统计学意义,这可能与过敏反应相关的炎症介质及其趋化因子的存在和释放有关。EOS参与先天性和获得性免疫反应,近年研究报道EOS增高与FPIP有一定相关性。一项荟萃分析显示,在263名FPIP儿童中,43.8%出现EOS增高[16];有文献报道EOS 增高与FPIP 临床症状的严重程度具有相关性[17]。本研究FPIP组亦有31.4%患儿出现EOS 增高,但是EOS 增高在辅助诊断FPIP 中的临床价值尚需要大样本、多中心的临床研究来验证。血小板可以参与过敏性疾病炎症反应的发生发展,哮喘、过敏性鼻炎和湿疹等过敏性疾病存在血小板过度活化现象[18-19]。本研究FPIP组易出现血小板增多,考虑与肠道过敏炎症反应有关。FPIP 和沙门菌肠炎均可有肠黏膜损伤表现,粪便中出现红细胞和白细胞。本研究沙门菌肠炎组粪常规红细胞、白细胞检出率高于FPIP组,但是应注意到FPIP组粪常规白细胞检出率高达61.3%,提示粪便白细胞并非细菌性肠炎特有,这也是FPIP易被误诊为细菌性肠炎,应用抗生素的主要原因。
维生素D 具有免疫调节功能,参与多种疾病的发生发展,临床上主要通过25羟维生素D水平来反映体内维生素D 的营养状况。维生素D 与食物过敏是否具有相关性,观点不一。有学者认为维生素D不足可能会增加食物过敏的发生风险,研究也表明食物过敏患儿常伴有维生素D缺乏[20-21]。本研究发现,虽然维生素D缺乏发生率在FPIP组和沙门菌肠炎组间差异无统计学意义,但FPIP组维生素D含量低于沙门菌肠炎组,可能与FPIP 组患儿病程较长,肠黏膜受损导致维生素D 吸收不良;过敏者进行饮食回避导致供给量不足以及患儿年龄小生长需求更旺盛有关,提示食物过敏患儿应注意足量维生素D的补充。
sIgE 检测对诊断IgE 介导的食物过敏有辅助作用,但应注意的是,sIgE阳性仅表示机体处于致敏状态,不一定代表存在食物过敏。本研究FPIP 组sIgE阳性率比沙门菌肠炎组低,分析其原因可能有多种。①FPIP为非IgE介导的食物过敏,sIgE通常为阴性;②FPIP患儿年龄较沙门菌肠炎者明显小,体内免疫球蛋白水平偏低,故用同一标准衡量时,阳性率相对低。此外,细菌感染可能掩盖了机体过敏状态。虽然沙门菌肠炎组患儿在此次病程中主要表现为急性感染性肠炎,但是可能部分患儿处于食物致敏状态。
FPIP首选饮食回避治疗,本研究绝大多数FPIP患儿经回避过敏食物后症状好转,但仍有6 例经常规饮食回避后疗效不佳,在粪菌移植治疗后临床症状改善明显,这为FPIP的治疗提供了新的方法和思路。已有大量临床研究报道利用粪菌移植治疗包括难治性艰难梭菌感染、炎症性肠病、慢性功能性便秘、肠易激综合征等肠道疾病以及代谢综合征、肥胖、自闭症等肠道外疾病[22]。目前粪菌移植在儿童食物过敏性疾病中的应用仅有少量文献报道[23-24],尚需要更多、更深入的研究。本研究发现有47.1%的FPIP 病例应用抗生素治疗,以第二、三代头孢菌素为主,中位疗程5.0天,表明FPIP早期诊断困难,误诊率较高。婴幼儿暴露于抗生素,不仅会增加发生食物过敏风险,还是食物免疫耐受延迟的危险因素[25-26]。应用抗生素可造成肠道菌群进一步失调,加重腹泻、便血等症状,导致病情迁延不愈,因此提高对FPIP的认识,减少抗生素使用十分必要。
目前沙门菌的抗生素耐药率逐年上升,全球面临着多重耐药的威胁,给治疗带来严峻考验。本研究显示,沙门菌对以往的一线抗菌药物如氨苄西林、氯霉素、磺胺甲噁唑普遍耐药;对氨苄西林-舒巴坦和第三代头孢菌素(头孢曲松)的耐药率分别为29.2%、20.0%,与相关研究报道相近[7]。尽管沙门菌对环丙沙星的耐药率较低,但是儿童不宜常规使用氟喹诺酮类药物。此外,本研究中多重耐药菌株比例高达44.2%。儿童沙门菌耐药形势严峻,要求临床医师应慎重用药,加强抗生素管控,同时也需要更多的药物研究来指导儿童的治疗。有关沙门菌肠炎的抗生素治疗,国内外指南建议:对于有肠外侵袭性感染、免疫缺陷、慢性基础疾病、年龄<3月、早产儿或病情严重的沙门菌肠炎患儿经验性使用抗生素治疗;对于无基础疾病的一般性肠炎应用抗生素反而会延长粪便排菌时间,增加耐药率,一般不推荐使用[27-29]。本研究沙门肠炎抗生素使用率达96.7%,可能与本单位是省级三甲医院,部分病例来源于其他医疗机构转诊的危重症患儿有关。本研究中沙门菌血清型以鼠伤寒沙门菌为主,大多数病例使用第三代头孢菌素抗感染治疗,中位抗生素疗程10 天。抗生素的种类与国内指南[28]关于鼠伤寒沙门菌抗生素选择的建议基本相符。
综上所述,FPIP 和沙门菌肠炎早期鉴别困难,但是两者仍有临床差异能帮助临床医师早期鉴别。对于<6月龄有血丝便无发热的肠炎患儿,要考虑到FPIP,减少抗生素的滥用;对于沙门菌肠炎应当结合病情,依据药敏试验结果,谨慎选用抗生素。
