老年急性髓系白血病患者化疗后肺部感染影响因素分析
2022-11-16朱文艳王志清高华强华海应
朱文艳,王志清,张 艳,赵 莹,吴 霜,李 锦,高华强,华海应
(江南大学附属医院血液科,江苏无锡 214041)
急性髓系白血病(acute myeloid leukemia,AML)是一类以外周血和骨髓中髓样前体细胞的克隆扩增为特征的侵袭性血液恶性肿瘤,具有发病急、预后差的特点[1]。根据美国国家癌症研究所报道,美国AML患者的3年生存率不足4.0%[2]。若不采取有效诊疗措施,AML患者平均生存期仅为数月,病情严重者甚至在确诊数天后即死亡[3]。化疗是AML的主要治疗手段,能有效减少AML的肿瘤负荷。研究发现,强化化疗方案可使≤60岁AML患者完全缓解率超过78.6%,其中7年总生存率达40.7%[4]。但是,化疗后由于中性粒细胞(neutrophils cells,NC)缺乏等原因极易出现细菌和真菌感染,感染部位尤其以肺部感染最为多见[5]。严重肺部感染可引起呼吸衰竭、感染性休克或心功能不全,增加AML患者致死风险[6]。探讨影响AML患者化疗后肺部感染的因素可针对危险因素做出处理,实现化疗后肺部感染的早预防,但探讨影响AML患者化疗后肺部感染的因素的研究较少,且研究尚无统一的观点,如李书坛等[7]研究显示109例AML 患者化疗后发生感染168例次,主要感染部位为上呼吸道和肺部,影响AML 患者感染的因素包括年龄>40 岁、春夏季住院、糖皮质激素治疗、高强度化疗、白细胞(white blood cells,WBC)、中性粒细胞(neutrophils cells,NC)和血红蛋白(hemoglobin,Hb)水平,LIEN等[8]研究显示吸烟和在化疗期间接受肠外营养的患者更倾向于肺部感染。LIEN等[8]认为影响AML患者化疗后肺部感染存在明显的地域特征,由此可见,分析本地区AML患者化疗后肺部感染的影响因素具有重要的现实意义。本研究旨在分析本院2015年1月至2020年1月收治的200例AML患者,分析化疗后肺部感染的影响因素,为本地区防治AML患者化疗后肺部感染提供参考。
1 资料与方法
1.1 一般资料
选取2015年1月至2020年1月在本院接受化疗的200例AML患者,平均年龄(66.78±5.68)岁,其中男113例,女87例。法、英、美分型系统(FAB)分型:M0型12例,M1型1例,M2型127例,M4型21例,M5型39例。根据2018版《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南》中肺部感染的诊断标准[9],化疗后是否发生肺部感染,将200例AML患者分为2组:感染组(发生肺部感染)115例,对照组(未发生肺部感染)85例,病原学研究显示,感染组中102例为细菌感染,13例为真菌感染。纳入标准:(1)年龄≥60岁;(2)参照世界卫生组织造血和淋巴组织肿瘤分类标准,经分子生物学、骨髓与血液形态学、遗传学、免疫组织化学染色确诊为AML[10];(3)首次确诊,且来本院治疗前未经过放化疗或抗癌治疗。排除标准:(1)化疗前有急性或慢性感染者;(2)进行骨髓移植的患者;(3)急性早幼粒细胞白血病(M3型AML);(3)患者或家属未签署知情同意书,化疗期间转院或中途参与其他研究的患者。研究经本院医学伦理委员会批准通过。
1.2 治疗方案
本研究中,参考成人AML中国诊疗指南[11]的推荐,AML患者采取以下任一常规诱导缓解治疗方案:(1)去甲氧柔红霉素(idarubicin,IDA) 12 mg·m-2·d-1×3 d,联合阿糖胞苷(cytosine arabinoside,Ara-C) 100~200 mg·m-2·d-1×3 d;(2)柔红霉素(daunorubicin,DNR) 60~90 mg·m-2·d-1×3 d,联合Ara-C 100~200 mg·m-2·d-1×7 d;(3)阿柔比星(aclarubicin,Acla) 20 mg·m-2·d-1×4 d或7 d,联合Ara-C 100~200 mg·m-2·d-1×7 d。其中 Ara-C 100~150 mg·m-2·d-1×7 d、DNR 60~75 mg·m-2·d-1×3 d、Acla 20 mg·m-2·d-1×4 d为一般强度,Ara-C 151~200 mg·m-2·d-1×7 d、DNR 76~90 mg·m-2·d-1×7 d、Acla 20 mg·m-2·d-1×7 d为高强度,联合用药中任何一种药物采用高强度均纳入高强度化疗。
1.3 观察指标
收集患者资料,对可能影响AML患者化疗后肺部感染的因素进行分析。社会人口学资料包括:性别、年龄、身高、BMI、吸烟。临床资料包括:基础类疾病、FMS样酪氨酸激酶3(FMS-like tyrosine kinase 3,FLT3)内部串联重复(FLT3 internal tandem duplication,FLT3-ITD)、血常规、住院时间、中心静脉置管时间、化疗相关参数(季节、周期、强度和阶段)。其中血常规包括:NC<0.5×109/L持续时间、NC<2.0×109/L持续时间、Hb、WBC、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、血小板(platelet,PLT)。
1.4 统计学处理

2 结 果
2.1 2组患者化疗后肺部感染单因素比较
200例AMI患者住院化疗期间无死亡案例。单因素分析结果显示,2组的年龄、性别、高血压、糖尿病、其他心脑血管疾病、过敏史、化疗方案、WBC、化疗季节、化疗周期、中心静脉置管时间差异无统计学意义(P>0.05),2组的吸烟、恶性肿瘤、FAB分型、FLT3-ITD、Hb、CR、PCT、NC、PLT、化疗强度、化疗阶段、住院时间、NC<0.5×109/L持续时间及NC<2.0×109/L持续时间差异有统计学意义(P<0.05)。见表1。

续表1 2组患者化疗后肺部感染单因素分析
2.2 2组患者化疗后肺部感染多因素比较
将单因素分析存在统计学差异的因素分别赋值,是否感染作为因变量进行logistic回归分析,结果显示,FLT3-ITD、NC、CRP及NC<0.5×109/L持续时间是影响AML患者化疗后肺部感染的因素(P<0.05),其中FLT3-ITD阳性、高CRP及NC<0.5×109/L持续时间较长是AML患者化疗后肺部感染的危险因素(P<0.05),高NC是AML患者化疗后肺部感染的保护因素(P<0.05)。见表2、3。

表2 影响患者化疗后肺部感染因素赋值
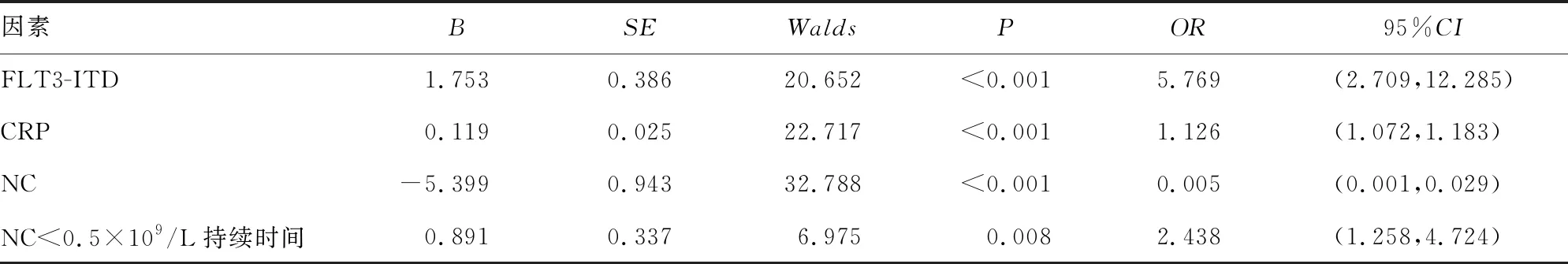
表3 2组患者化疗后肺部感染logistic回归分析
3 讨 论
化疗是临床治疗AML的主要手段,可有效延长患者生存期。对于AML患者,诱导化疗是一个动态的过程,FERRARA等[12]研究发现,AML诱导化疗期间的30 d死亡率为5%~60%之间,导致AML患者早期死亡的主要原因为肺部感染。由于肿瘤细胞大量增生,血液系统被肿瘤细胞破坏,加之反复大量使用的化疗药物具有药物毒性作用,使人体免疫屏障破坏更为严重,较为典型的是NC水平显著降低,呼吸道是人体与外界环境相通的主要通道,极易被病原体等微生物入侵。有报道显示,随着年龄增加,主要器官功能衰竭,肺部感染率及病死率增高,每增加1岁,肺部感染患者的死亡风险增加1.04倍[13],正如本研究结果显示,200例AML患者经至少1次化疗后,发生肺部感染115例,感染率为57.50%,且单因素分析亦显示,化疗强度、化疗阶段是AML患者化疗后发生肺部感染的影响因素。进一步采用logisitc分析结果显示,NC降低、NC<0.5×109/L持续时间及NC<2.0×109/L持续时间也是影响AML患者化疗后肺部感染的危险因素,可见本文结果也证实了NC水平显著降低及低水平持续时间较长与AMI患者发生肺部感染存在因果关系,高NC是AML患者化疗后肺部感染的保护因素。
FLT3受体属于受体酪氨酸激酶家族,在调节造血过程中有着至关重要的作用。FLT3基因突变是AML中最普遍的遗传异常之一,主要发生在具有正常细胞遗传学的AML患者中,通常表现为ITD或酪氨酸激酶结构域(TKD)点突变。报道显示,ITD导致的FLT3突变,即FLT3-ITD阳性是AML肺部感染的危险因素[14],与本研究结果一致。因为FLT3-ITD突变使FLT3近膜区的结构发生改变,并诱导细胞大量增殖,致使AML患者外周血WBC增加[15],另一方面,FLT3-ITD突变导致的AML患者白血病细胞免疫标记紊乱。本研究中感染组的WBC虽有增加,但与对照组比较,差异无统计学意义(P>0.05),该结果提示,具有增高趋势的WBC未能改善AML患者的感染状况,另外,FLT3-ITD突变有增高WBC的作用,但也存在细胞免疫标记紊乱,细胞免疫标记紊乱作用可能在一定程度地降低了增高WBC对感染AML的保护效应。
CRP是一种能与肺炎链球菌C多糖体形成复合物的急性时相蛋白,由肝细胞合成并分泌。正常情况下,CRP在健康人体内含量甚微,而在机体存在感染或组织损伤时会迅速升高,当感染得到有效控制后,则会迅速下降,因此CRP水平可以灵敏地反映患者感染严重程度及控制情况[16]。CRP也是临床常用的反映机体炎症的指标。CHEN等[17]研究发现,CRP水平与肺炎的严重程度呈正相关。本研究中,CRP每增加1个单位,AML患者化疗后发生肺部感染的风险即增加1.126倍。血清CRP水平升高不仅是对炎症水平的反映,也是对肿瘤细胞水平的反映[18-19]。首次诱导化疗之前的AML患者体内有大量肿瘤细胞,这可能影响了血清CRP水平。
NC减少是化疗后宿主防御的主要缺陷。50%~90%的AML患者在诱导化疗和强化巩固化疗期间会出现NC减少症,其程度取决于疾病病程和化疗强度。有研究报道,NC减少症和NC减少的持续时间与感染的敏感性密切相关,从NC减少症中恢复是生存的重要保护因素[7]。
除此,单因素分析也显示吸烟、Hb、PCT、PLT、住院时间可影响AML患者化疗后肺部感染。其中吸烟可降低患者的抵抗力,减弱肺细胞对病毒菌的吞噬能力,加之吸烟可增多气道内分泌,产生的黏液可堵塞气流,本研究中的患者均为老年人,吸烟的54例患者中,烟龄大多超过15年,增加了肺部感染风险[20-21]。Hb降低是肺部感染的危险因素,原因在于Hb可降低血浆胶体渗透压,血液黏稠度增加,导致脏器灌流不足及微循环障碍,加之老年人血液循环减慢且多存在不同程度的基础疾病,因而进一步加重血液微循环问题,另外Hb降低可降低机体免疫力,进一步增加感染风险[22]。PCT在健康人外周血水平较低,但若存在细菌、真菌感染或器官功能衰竭,PCT则显著增高,且增高程度与感染严重程度紧密相关[23]。PLT是凝血的重要指标,AML患者出血风险较大,一旦发生出血,病原菌极容易定植于皮肤黏膜破损处,增加患者感染风险[24],有报道[25]显示PLT<30×109/L的患者的感染概率超过PLT正常患者的9倍。住院时间较长增加了患者暴露于病原菌环境的概率,因而增加了肺部感染的风险。
本研究存在不足,本研究结果与既往相关报道有存在差异的地方,如有研究报道显示50岁、70岁和80岁的AML发病率不同,其中80岁发病率最高[26]。老年人由于免疫力低下和器官生理功能退化,增加了机体受病原菌侵袭的风险,但本研究未显示出年龄与AML患者肺部感染的相关性,可能与样本量有限,年龄跨度较小且为单中心研究,纳入的病例有高度相似的饮食习惯有关。
综上所述,FLT3-ITD阳性、高CRP及NC<0.5×109/L持续时间长是AML患者化疗后肺部感染的高危因素,NC增高是AML患者化疗后肺部感染的保护因素。对于AML患者,对于在化疗前进行FLT3-ITD检测,在化疗早期检测外周血CRP、NC,预防性地给予抗生素和支持治疗,可降低患者肺部感染风险。
