微小染色体家族在肝癌中的表达和预后价值及其作用机制
2022-11-15尹清臣王景梅侯丽艳贾如江
尹清臣, 王 磊, 王景梅, 侯丽艳, 贾如江
(邯郸市中心医院普一科, 邯郸 056102)
肝癌是恶性程度最高的肿瘤之一, 发病率和死亡率均较高[1], 预后差, 5年生存率低至30%[2-3]。到2030年, 预计肝癌将成为癌症相关死亡的第三大原因[4]。肿瘤细胞失控性的无限增殖是恶性肿瘤发生的本质, DNA 复制过程异常改变, 细胞周期的调控机制失常均与肿瘤细胞无限增殖密切相关[5]。微小染色体家族(minichromosome maintenance, MCMs)广泛存在于真核生物细胞中, 参与DNA复制前复合物的形成、DNA复制的起始及DNA的延长。MCM2~7这6个保守且高度同源的蛋白组成的环形结构的亲水性六聚体复合物, 是真核细胞DNA复制前复合体的关键组分, 与DNA复制的稳定性和准确性存在密切联系, 是DNA复制与延伸所必需的重要组分[6]。许多研究阐明了MCMs家族基因在转录调控、染色质重塑以及检测点反应等基因稳定性等多个方面发挥重要作用[7-8]。其功能失调可导致染色体缺陷, 进而可能导致肿瘤的形成[9-10]。本研究基于生物信息学方法, 分析MCMs在肝癌中的表达, 分析其临床意义及其与肝癌患者预后的关系, 并探讨其相关机制, 以期为肝癌的精准治疗提供新的靶点。
1 材料与方法
1.1 利用在线UALCAN和GEPIA数据库进行基因表达分析
UALCAN数据库[11](http://ualcan.path.uab.edu/index.html)是一个有效的在线分析和挖掘肿瘤数据的网站, 主要是基于TCGA数据库(The Cancer Genome Atlas, http://cancer.gov/)中的相关肿瘤数据进行分析, 它可以对相关基因进行生物标记鉴定、表达谱分析、生存分析等。GEPIA数据库(http://gepia.cancer-pku.cn/)是由北京大学开发的基因表达谱动态分析数据库, 该数据库结合TCGA和GTEx数据库(https://gtexportal.org)的数据, 分析基因在不同肿瘤中的表达情况。本研究利用在线数据库UALCAN统计MCMs的MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因在肝癌组织和正常组织中的表达量, 进一步利用GEPIA数据库扩大分析这6个基因在肝癌与正常肝脏组织中的表达差异。
1.2 GEPIA数据库对肝癌临床分期表达进行分析
进一步利用GEPIA数据库, 在线分析MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因表达与肝癌患者临床分期的关系。
1.3 在线UALCAN数据库对蛋白表达进行分析
利用在线数据库UALCAN分析MCMs家族中的MCM2、MCM3、MCM4、MCM5、MCM6、MCM7蛋白在肝癌组织和正常组织中的表达差异。
1.4 HPA 数据库和GEPIA数据库预后分析
利用HPA数据库检索MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因在TCGA 标本库中的表达量, 分析这6个基因的表达与肝癌患者生存的关系。利用GEPIA数据库分析MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因表达与肝癌患者无病生存率(disease-free survival, DFS)、总生存率(overall survival, OS)的关系。
1.5 GEPIA数据库分析MCMs基因表达相关性
利用GEPIA数据库分析MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因在肝癌中表达的相关性。
1.6 String-DB数据库
String-DB数据库[13](https://string-db.org)是生物基因和蛋白质相互作用分析的检索平台, 包含了已证实和可预测的蛋白-蛋白相互作用生物数据库, 也包括蛋白质之间的间接功能相关性。本研究中输入“MCM2”, 物种选择“Homo sapiens”, 置信度选择“Medium0.4”, 最大数相互作用选择连接数不超过20, 进行检索、数据分析, 并进行KEGG信号通路富集分析。
1.7 利用Metascape数据库进行富集分析
进一步采用Metascape数据库[14](https://metascape.org/)对MCM2、MCM3、MCM4、MCM5、MCM6、MCM7及相关作用基因进行基因本体(gene ontology, GO)富集分析。
1.8 统计学分析
2 结果与分析
2.1 应用UALCAN和GEPIA数据库分析MCMs基因在肝癌中的表达情况
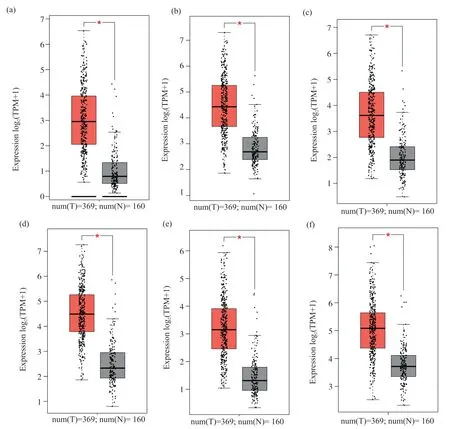
应用UALCAN数据库分析371例肝癌组织和50例正常肝组织中基因的表达, 使用每千个碱基的转录每百万映射读取的转录本数(transcripts per kilobase of exon model per million mapped reads, TPM)作为均一化后的基因表达单位, 结果显示, MCMs基因家族中MCM2(0.927 TPMvs8.501 TPM)、MCM3(5.918 TPMvs23.652 TPM)、MCM4(2.443 TPMvs8.259 TPM)、MCM5(5.343 TPMvs23.254 TPM)、MCM6(1.625 TPMvs8.205 TPM)、MCM7(8.631 TPMvs30.707 TPM)基因在肝癌中表达明显升高, 表达差异有统计学意义(P<0.05)(图1)。应用在线GEPIA数据库分析369例肝癌组织和160例正常肝组织中MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因的表达差异, 发现差异有统计学意义(P<0.05)(图2)。

2.2 GEPIA数据库在线分析MCMs基因表达与肝癌临床分期的关系
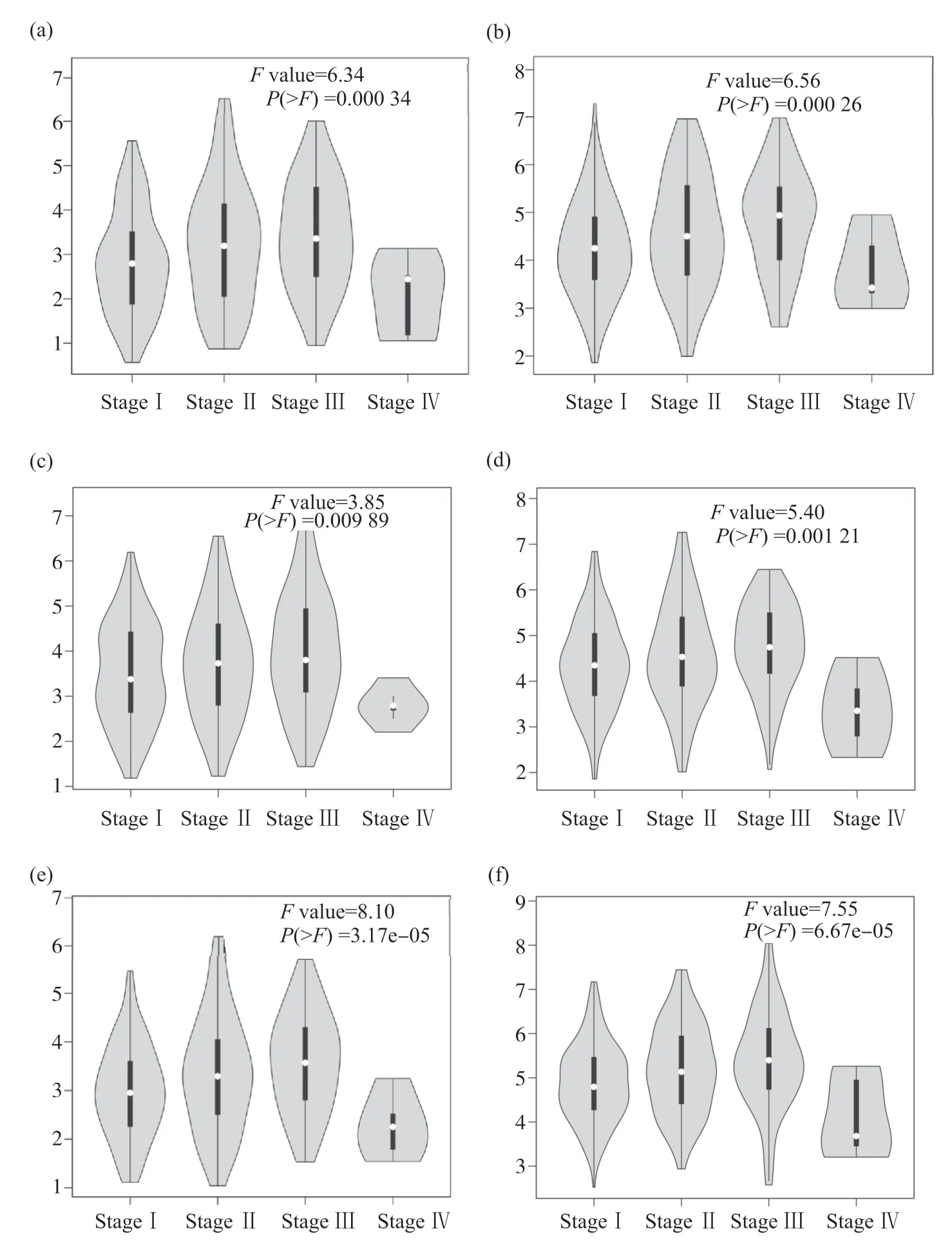
利用GEPIA数据库在线分析MCMs基因表达与肝癌临床分期的关系, 结果显示, 369例肝癌中Ⅰ期170例、Ⅱ期84例、Ⅲ期83例、Ⅳ期4例, 分期不明确的28例, 除外分期不明确的28例患者外, 分析结果显示,MCM2、MCM3、MCM4、MCM5、MCM6、MCM7与患者临床分期差异有统计学意义(P<0.05), 在Ⅰ期、Ⅱ期、Ⅲ期中, 随着分期升高, MCMs基因表达明显升高, 在Ⅳ期患者中, MCMs基因表达明显降低(图3)。
2.3 在线MCMs蛋白表达分析
在线数据库UALCAN统计结果显示, MCMs蛋白在165例肝癌组织和165例正常组织中的表达差异明显, 在肝癌组织中MCM2、MCM3、MCM4、MCM5、MCM6、MCM7蛋白表达明显升高, 差异有统计学意义(P<0.05)(图4)。
2.4 在线数据库检测MCMs基因与肝癌预后的关系
在GEPIA数据库中利用Kaplan-Meier法分析MCMS基因与肝癌预后的关系, 结果提示,MCM2、MCM3、MCM5、MCM6、MCM7基因高表达组的肝癌患者OS、DFS(P<0.05)明显差于低表达组, 只有MCM4基因高表达组差于与低表达组, 但是无统计学意义(图5)。进一步利用HPA数据库共分析365例患者的肝癌组织基因表达, 使用每千个碱基的转录每百万映射读取的基因片段数(fragments per kilobase of exon model per million mapped fragments, FPKM)作为均一化后的基因表达单位, 结果显示,MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因平均表达数值为4.7、15.6、5.2、6.4、6.0、16.1 FPKM。依据Kaplan-Meier预后分析结果, 选择MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因表达的最佳临界值, 其表达数值分别为12.36、14.32、8.72、12.04、12.41、17.13 FPKM, 此时显示, MCMs基因表达与肝癌患者预后存在明显相关性。5年生存率MCM2、MCM3、MCM4、MCM5、MCM6、MCM7高表达组预后较差(P<0.05)。
2.5 GEPIA数据库分析MCMs表达相关性
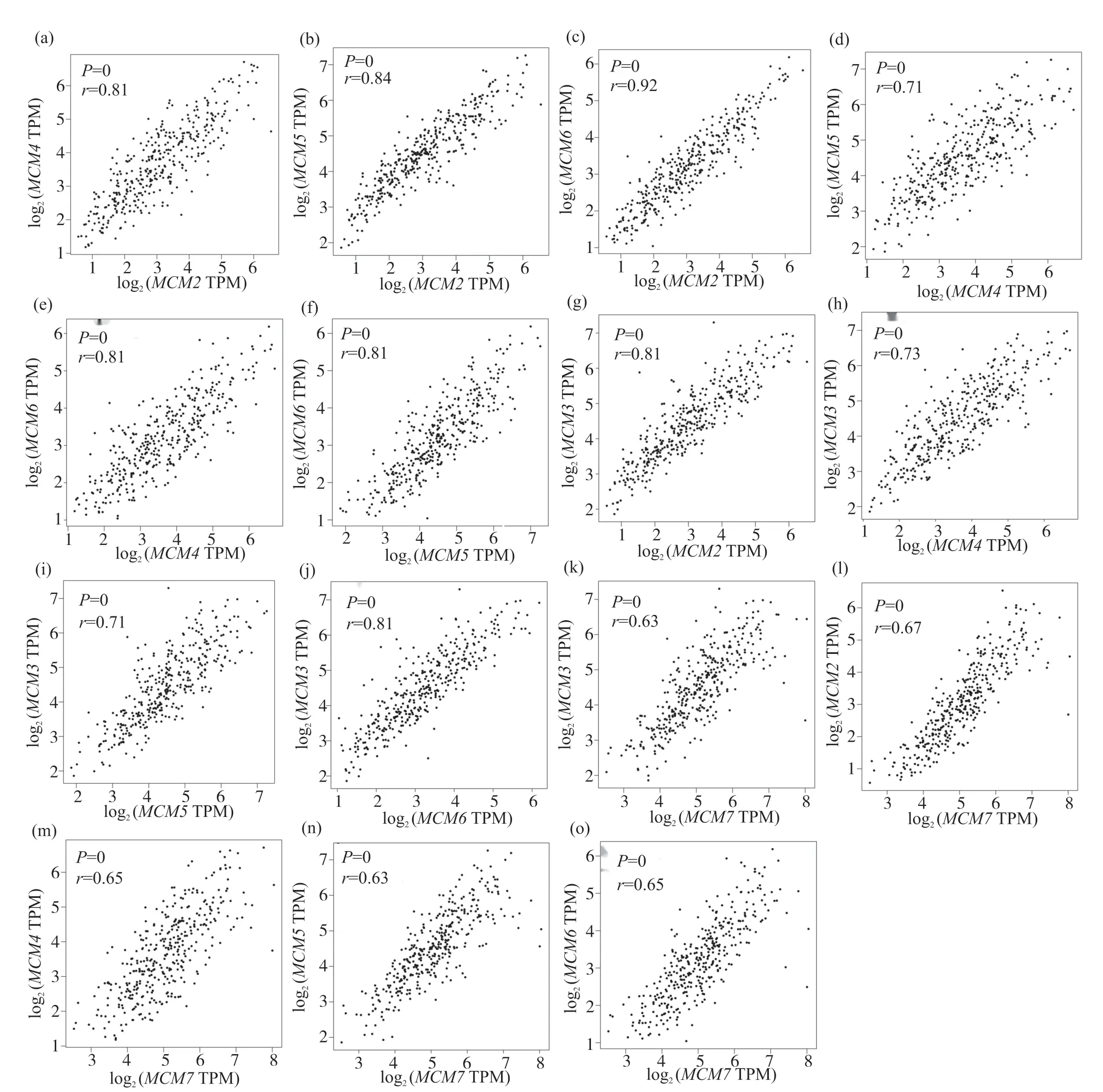
利用G E P I A数据库分析肝癌中M C M 2、MCM3、MCM4、MCM5、MCM6、MCM7基因表达相关性, 结果显示,MCM2与MCM3(r=0.81)、MCM2和MCM4(r=0.81)、MCM2和MCM5(r=0.84)、MCM2与MCM6(r=0.92)、MCM2与MCM7(r=0.67)、MCM3和MCM4(r=0.73)、MCM3和MCM5(r=0.71)、MCM3和MCM6(r=0.81)、MCM3和MCM7(r=0.63)、MCM4和MCM5(r=0.71)、MCM4和MCM6(r=0.81)、MCM4和MCM7(r=0.65)、MCM5和MCM6(r=0.81)、MCM5和MCM7(r=0.63)、MCM6和MCM7(r=0.65)表达关系密切, 具有明显相关性,差异有统计学意义(P<0.05)(图6)。
2.6 String-DB数据库
利用String-DB数据库检索得到如下结果(图7):蛋白质相互作用网络(protein-protein interaction networks, PPI)富集分析结果显示, 与MCM2、MCM3、MCM4、MCM5、MCM6、MCM7具有密切相互作用的蛋白有MCM10、ORC1、ORC2、ORC4、ORC5、GINS1、GINS2、GINS3、GINS4、CDC6、CDC7、CDC45、ASF1B、CDT1、WDHD1等(P<1.0e-16)。
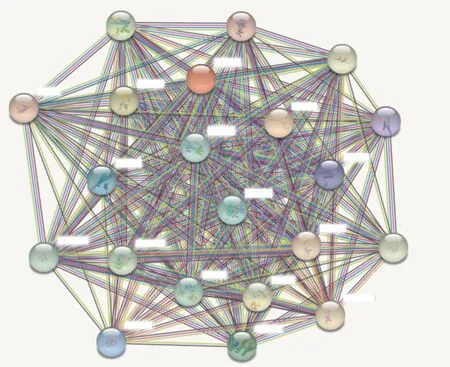
图7 与MCM2、MCM3、MCM4、MCM5、MCM6、MCM7相关蛋白网络分析Fig. 7 Analysis of the protein network associated with MCM2, MCM3, MCM4, MCM5, MCM6, MCM7
2.7 Metascape对基因进行GO富集分析
利用Metascape数据库对MCM2、MCM3、MCM4、MCM5、MCM6、MCM7及相关作用基因进行GO富集分析, 结果显示,MCM2、MCM3、MCM4、MCM5、MCM6、MCM7主要富集在DNA依赖的DNA复制、复制前体复合物的活化、DNA解螺旋、核基因的复制、DNA调控的复制、CDC6相关的起始识别复合物的调节、DNA复制检查点的调控、蛋白-DNA复合物的组装等信号通路(表1)。

表1 GO 富集分析结果Tab.1 GO results of enrichment analysis

3 讨论
MCM家族包括MCM2~7, 在DNA复制过程中起主要作用, 控制细胞周期从G1期向S期进展[15-16], 且MCM4、MCM6和MCM10的表达水平与肿瘤进展呈正相关关系[17-19]。Samad 等[20]研究发现, MCM2可作为乳腺癌的预后标志物。有研究表明, 胃癌组织中MCM8表达显著升高, MCM8高表达的胃癌患者总体生存率显著降低[21];MCM2、MCM6高表达可导致肝内胆管癌的预后不良[22];MCM7基因在肝癌组织和细胞中高表达, 且与肝癌患者预后不良有关,MCM7基因沉默抑制细胞活性, 促进细胞凋亡, 阻滞肝癌细胞周期从G1期向S期进展[23]。MCMs家族在DNA 复制与细胞周期进程和检查点调控结合等方面具有重要作用, 有望成为肝癌治疗中的重要靶点[24]。
本研究对TCGA和GTEx数据库的数据分析表明,MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因在肝癌中高表达, MCM2、MCM3、MCM4、MCM5、MCM6、MCM7蛋白在肝癌组织表达升高。这些结果充分表明, MCMs家族基因水平和蛋白水平在肝癌中表达较正常肝组织均明显升高。MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因表达在Ⅰ期、Ⅱ期、Ⅲ期中随着分期升高表达明显升高, 在Ⅳ期患者中MCMs基因表达明显降低, 分析原因可能与患者Ⅳ期病例数目过少有关。
HPA数据库预后分析显示,MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因高表达组预后较差。GEPIA数据库提示,MCM2、MCM3、MCM4、MCM5、MCM6、MCM7基因高表达组肝癌患者的OS、DFS明显差于低表达组, 只有MCM4高表达组差于与低表达组, 但是无统计学意义。这些结果充分表明, MCMs家族在肝癌中高表达与患者不良预后有关, 可以作为肝癌预后预测的重要分子标记。

本研究通过String-DB数据库在PPI网络中预测的与MCM2、MCM3、MCM4、MCM5、MCM6、MCM7具有相互作用的蛋白如下:MCM10、ORC1、ORC2、ORC4、ORC5、GINS1、GINS2、GINS3、GINS4、CDC6、CDC7、CDC45、ASF1B、CDT1、WDHD1等。GO 富集分析发现, MCMs主要富集在DNA依赖的DNA复制、复制前体复合物的活化、DNA解螺旋、核基因的复制、DNA调控的复制、CDC6相关的起始识别复合物的调节、DNA复制检查点的调控、蛋白-DNA复合物的组成等信号通路上。结合以往对MCMs功能研究的成果, 可以预测MCMs家族在肝癌中的高表达, 主要通过参与DNA合成、复制的相关具体环节, 进而干扰了DNA合成、复制的过程, 导致肝癌的发生发展。
本研究认为, MCMs家族在肝癌中高表达, 并且表达具有明显的相关性, 构成MCMs家族在肝癌中的功能模块, 通过参与DNA合成、复制的具体生物过程, 导致肝癌的发生与发展。MCMs家族在肝癌中表达升高, 可能是肝癌发生的早期事件, 并且还能够直接反应肝癌细胞的增殖水平, 从而影响肝癌患者的预后, 是肝癌早期发生和预后的重要生物学指标。本研究对MCMs家族成员在肝癌中的作用研究具有重要的参考价值。MCMs家族在肝癌中功能模块的发现, 有望为肝癌的早期筛查和靶向治疗提供新的方向。但是本研究以生物信息学为主要研究工具, 仍需要进一步试验研究证实, 以期为肝癌的早期诊断和临床治疗提供新的靶点。
