紫苏WRI1转录因子的鉴定、表达分析 及低温胁迫响应
2022-11-15黄旭升周雅莉史先飞董书言李润植王计平
黄旭升, 周雅莉, 史先飞, 高 宇, 董书言, 李润植, 王计平
(山西农业大学分子农业与生物能源研究所, 太谷 030801)
紫苏[Perilla frutescens(L.)Britt.] 别名桂荏、红苏、香苏、赤苏、红紫苏等, 是唇形科紫苏属一年生草本植物[1], 原产于亚洲东部, 在我国已有2 000多年的栽培历史[2]。紫苏对环境的适应性非常强, 对土壤条件要求不高, 在砂土、壤土和黏土均能良好地生长, 在我国各地广泛种植[3]。作为一种新型的多用途的经济作物, 紫苏种质资源丰富, 也是国家卫生部首批颁布的既是药品又是食品的60种药食植物之一[4]。紫苏含有特殊的营养成分和丰富的活性物质, 具有多种应用价值, 其研究与应用越来越引起国内外的广泛关注。紫苏籽出油率高达46%~58%, 其中不饱和脂肪酸[油酸(C18:1, 约17.1%)、亚油酸(C18:2, 约15.7%)和亚麻酸(C18:3, 约60.7%)] 含量占总油脂含量的90%左右[5-6]。α-亚麻酸(ALA, 18:3Δ9, 12, 13)是一类健康有益型高值脂肪酸, 是人体维持生命不可或缺的必需脂肪酸[7]。目前市场上主要油料作物[如大豆(Glycine max)、油菜(Brassica napus)、玉米(Zea mays)、花生(Arachis hypogaea)和向日葵(Helianthusa nnuus)] 种子中α-亚麻酸含量均低于总油脂含量的10%[8], 因此, 优质的紫苏籽油能够作为人类膳食中α-亚麻酸的理想来源。
植物脂肪酸的代谢过程有着高度的复杂性, 目前已克隆获得了一些相关的关键酶基因[9-10], 但通过分子生物学手段改造单个酶基因以提高植物脂肪酸含量的困难较大[11]。研究发现, 一些转录因子如LEC1(LEAFYCOTYLEDON1)、WRI1(WRINKLED1)和FUS3(FUSCA3)等可调控植物油脂合成途径中关键酶基因的表达, 进而影响植物油脂含量[12]。WRI1是一类植物特异转录因子, 属于AP2/EREBP(APETALA2/ethylene-responsive element binding protein)转录因子超家族中的AP2亚家族, 包含2个高度保守的AP2结构域[13]。Focks和Benning[14]于1998年首次在拟南芥(Arabidopsis thaliana)中发现了WRI1转录因子。Cernac和Benning[15]于2004年发现, 拟南芥WRI1缺失突变体和过表达AtWRI1植株种子中含油量分别降低约80%和提高约20%。Ma等[16]将油棕(Elaeis guineensis)WRI1转入拟南芥WRI1缺失突变体中, 发现突变体表型得到恢复, 说明油棕WRI1具有和拟南芥WRI1相似的功能。在甘蓝型油菜中过表达BnWRI1, 发现其种子含油量升高18%~38%, 叶片含油量升高28%~63%[17]。Yang等[18]将蓖麻(Ricinus communis)WRI1转入烟草中, 发现烟草细胞油脂含量升高。
目前, 已从多种植物中克隆得到WRI1转录因子, 它们均在植物油脂合成代谢途径中发挥着重要作用, 但紫苏WRI1的功能和作用机制尚不清楚。本研究从紫苏基因组中鉴定得到WRI1, 并克隆获得其完整编码序列(coding sequence, CDS), 通过生物信息学分析工具预测WRI1转录因子的序列特征、理化性质及系统进化关系等, 应用半定量PCR(semi-quantitative reverse transcription polymerase chain reaction, sqRT-PCR)和实时荧光定量PCR(quantitative real-time reverse transcription polymerase chain reaction, qRT-PCR)技术分析WRI1在紫苏不同组织的时空表达特征及其在低温胁迫下的表达模式, 为进一步探究紫苏WRI1在低温胁迫响应和油脂代谢中的生物学功能及在其他植物油脂品质改良中的应用奠定基础。
1 材料与方法
1.1 试验材料与处理
本试验选择含油量较高的紫苏优选品种‘晋紫苏1号’为材料, 将其种植于山西农业大学农学院试验田。试验取材为‘晋紫苏1号’的根、茎、叶、花以及开花后10、20、30和40 d的种子, 液氮速冻后立即存于-80 ℃超低温冰箱。
选择籽粒饱满的 ‘晋紫苏1号’种子, 自来水冲洗20 min后用0.01%的升汞溶液浸泡8 min(期间摇晃2~3次), 无菌水冲洗3~4次后置于放有双层发芽纸的培养皿中, 放于光照培养箱中萌发, 25℃光暗交替(光照:黑暗=16 h∶8 h), 相对湿度为60%, 光照为15 000 lx, 期间保持发芽床湿润。待生长至含有两片真叶时, 筛选并保留长势一致、状态良好的幼苗, 转移至霍格兰营养液[Ca(NO3)2·4H2O 945.0 mg/L, KNO3607.0 mg/L, NH4H2PO4115.0 mg/L, MgSO4·7H2O 493.0 mg/L][19]中继续生长, 待幼苗长至6片真叶时对其进行4℃低温胁迫处理。分别取胁迫0、3、6、9、12、24、48 h的幼苗, 液氮速冻后放于-80℃超低温冰箱备用。
1.2 紫苏PfWRI1的鉴定
从GenBank中下载紫苏基因组序列、CDS序列、全基因组蛋白序列和GFF注释文件, 将全基因组蛋白质序列建立本地数据库。从拟南芥基因组数据库TAIR(https://www.arabidopsis.org /)中查找AtWRI1, 得到其CDS序列, 以AtWRI1蛋白质序列(NP_001030857.1)为探针, 使用BioEdit软件进行本地BLAST同源检索, 通过SMART在线软件(http://smart.embl-heidel-berg.de/)和CDD数据库(Conserved Domains Datebase, http://ncbi.nlm.nih.gov/Structure/cdd/Wrpsb.cgi)进一步筛选包含2个AP2保守结构域的蛋白序列, 得到紫苏WRI1。
1.3 紫苏总RNA的提取、cDNA的合成及PfWRI1基因CDS克隆
使用艾德莱公司的EASY spin植物RNA快速提取试剂盒RN09(北京艾德莱生物科技有限公司)提取紫苏不同组织和低温胁迫下各样品的总RNA。用BioDrop蛋白核酸浓度分析仪和琼脂糖凝胶电泳检测各样品总RNA的量。使用GenStar(北京康润诚业生物科技有限公司)的反转录试剂盒反转录合成第一链cDNA。根据鉴定得到的PfWRI1序列设计PCR扩增引物(表1)。以紫苏不同组织的cDNA混样为模板, 使用novoprotein(苏州近岸蛋白质科技股份有限公司)的Pfu DNA Polymerase高保真酶通过扩增获得PfWRI1基因的CDS区域。PCR扩增程序为:94℃ 1 min 30 s;94℃ 30 s, 60℃ 30 s, 72℃ 2 min, 30次循环;72℃ 5 min。反应结束后通过琼脂糖凝胶电泳检测PfWRI1基因PCR扩增产物, 目的片段经割胶回收和纯化后连接到克隆载体pMD18-T上, 将重组质粒pMD18-T-PfWRI1转入大肠杆菌DH5α感受态中。通过菌落PCR筛选得到阳性克隆, 送安徽通用生物公司进行测序验证。

表1 引物信息Tab. 1 Primers used in this study
1.4 紫苏PfWRI1基因序列特征及系统进化关系 分析
通过在线软件GSDS(Gene Structure Display Server, http://gsds.gao-lab.org/index.php)分析紫苏Pf-WRI1基因的外显子和内含子分布情况。使用在线软件 ProParam (http://web.expasy.org/protparam/)和Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plantmulti/)预测PfWRI1编码蛋白的分子量、氨基酸数、理论等电点等基本理化性质和亚细胞定位。利用
SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)网站对PfWRI1蛋白的二级结构和三级结构进行预测。运用 Jalview软件对紫苏PfWRI1和其他已报道物种的WRI1蛋白质序列进行多序列比对分析, 使用MEGA11通过邻接法(neighbor-joining, NJ)构建WRI1蛋白序列的系统进化树, 自举检验值(Bootstrap)设定为1 000, 其余参数设置为默认。应用在线网站STRING (http://string-db.org/cgi/input.pl)构建紫苏PfWRI1蛋白的互作网络, 以拟南芥作为参照植物, 通过选择数据库中与紫苏PfWRI1序列相似且得分最高的蛋白质构建蛋白互作网络图。
1.5 紫苏PfWRI1基因表达特性分析
根据PfWRI1基因编码序列设计序列特异性引物, 目的基因PfWRI1和内参基因Actin2的引物序列见表1。以紫苏不同组织(根、茎、叶、花及开花后10、20、30和40 d的种子)的cDNA为模板, 进行sqRT-PCR和qRT-PCR扩增, 分析PfWRI1基因的时空表达特性。以低温胁迫处理不同时间紫苏幼苗的cDNA为模板, 选择冷胁迫相关的Marker 基因DREB1A[20]作为阳性对照, 分别对PfDREB1A和PfWRI1进行qRT-PCR分析(引物序列见表1), 以探究PfWRI1基因在紫苏幼苗中响应低温胁迫的分子机制。按照2×E-Taq PCR Master Mix(杭州新景生物试剂开发有限公司)试剂盒进行sqRT-PCR, 反应体系为:2×E-Taq PCR Master Mix 5.0 μL, cDNA模板0.5 μL, 正向引物0.2 μL, 反向引物 0.2 μL, ddH2O 4.1 μL。扩增反应程序为:94℃预变性3 min;94℃变性30 s, 60℃退火30 s, 72℃延伸30 s, 25次循环;72℃终延伸5 min。
以各样品的cDNA为模板, 使用TB Green®Premix Ex Taq™ II(Tli RNaseH Plus)试剂盒[TaKaRa, 宝日医生物技术(北京)有限公司] , 在Bio-Rad CFX 96 TM实时荧光定量PCR仪上进行qRT-PCR扩增, 分析PfWRI1在紫苏不同组织和低温胁迫下的表达量。每个样品设置3次生物学重复和3次技术重复。反应体系为:TB Green-Premix Ex Taq 5.0 μL, cDNA 0.5 μL, 正向引物0.2 μL, 反向引物0.2 μL, ddH2O补足至10.0 μL。采用三步法进行qRT-PCR扩增, 反应程序为:95℃ 2 min;95℃ 20 s, 60℃ 20 s, 72℃ 20 s, 40次循环。使用Excel和DPS处理数据。
2 结果与分析
2.1 紫苏PfWRI1的鉴定与基因结构分析
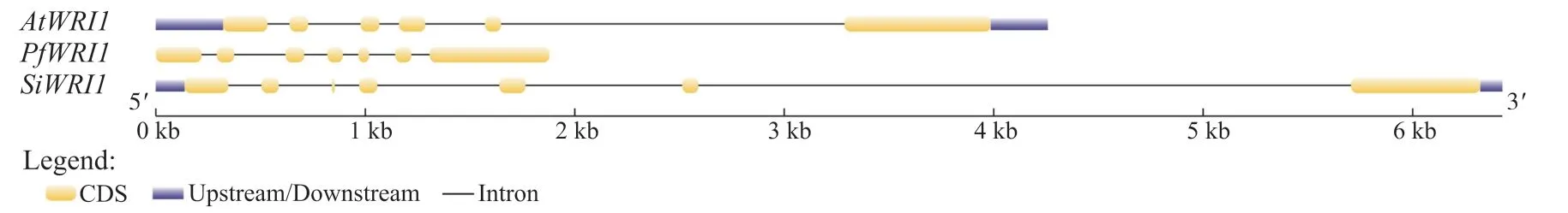
以拟南芥AtWRI1的蛋白质序列为检索序列, 在紫苏基因组数据库中进行本地BLAST检索, 运用SMART和CDD数据库进一步筛选鉴定含2个AP2保守结构域的蛋白序列, 去除冗余序列, 最终得到1个紫苏WRI1, 命名为PfWRI1。对PfWRI1蛋白序列进行分析(图1), 结果显示:PfWRI1属于AP2超家族中的成员, 其包含的2个AP2保守结构域分别位于第66~132和166~228位氨基酸。使用在线数据库GSDS对紫苏、拟南芥和芝麻(Sesamum indicum)的WRI1基因结构进行分析(图2)发现,PfWRI1基因含有6个内含子和7个外显子, 与拟南芥和芝麻的WRI1结构相比, 内含子和外显子的分布基本一致。

2.2 紫苏PfWRI1基因CDS克隆
以紫苏根、茎、叶、花和不同发育时期种子的cDNA混样为模板, 使用Pfu DNA Polymerase高保真酶扩增得到PfWRI1基因的CDS序列, 将目的片段连接到pMD18-T载体上, 得到重组质粒pMD18-TPfWRI1, 将其转入大肠杆菌DH5α感受态中。通过菌落PCR扩增得到长度为1 164 bp的条带(图3), 经测序验证该序列未发生突变, 说明通过克隆成功分离得到PfWRI1基因。
2.3 紫苏PfWRI1基因编码蛋白基本理化性质、 亚细胞定位及蛋白结构分析
通过在线网站ProParam对紫苏PfWRI1编码蛋白的基本理化性质进行分析(表2), 结果显示:Pf-WRI1转录因子相对分子质量为43.58 kD, 共编码氨基酸387个, 理论等电点为8.18, 预测其为碱性蛋白。平均亲水性指数(GRAVY)为-0.701, 属于亲水性蛋白, 不稳定指数为57.63, 属于不稳定蛋白。

表2 PfWRI1蛋白的理化性质Tab. 2 Physicochemical properties of PfWRI1 protein
使用在线网站SPOMA对PfWRI1蛋白的二级结构进行预测(表3), 结果显示, 紫苏PfWRI1蛋白的二级结构包含4种元件, 其中α-螺旋占30.23%, 延伸链占8.79%, β-转角占4.13%, 无规则卷曲占56.85%, 可推测α-螺旋和无规则卷曲为PfWRI1蛋白的主要结构元件。通过Plant-mPLoc数据库预测PfWRI1蛋白的亚细胞定位(表3), 结果表明PfWRI1蛋白质定位于细胞核中。

表3 PfWRI1蛋白的二级结构 Tab. 3 The secondary structure of PfWRI1 protein
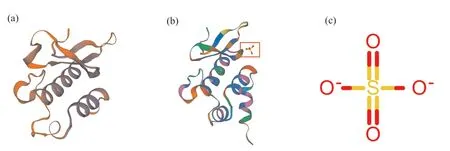
利用SWISS-MODEL预测PfWRI1蛋白的三级结构, 并进行同源建模(图4)。使用7et5.1.A蛋白为模板蛋白对紫苏PfWRI1进行同源建模分析, 结果表明:该模板蛋白与PfWRI1蛋白序列的相似度为35%, 覆盖度为23%, 保守序列范围在第65~158位氨基酸;X射线衍射显示紫苏PfWRI1蛋白和7et5.1.A蛋白都包含一条AP2/ERF and B3 domaincontaining transcription repressor TEM1多肽链, 且模板蛋白含有一个SO4配体, 而紫苏PfWRI1蛋白无SO4配体。

2.4 紫苏PfWRI1转录因子氨基酸序列比对与系统发育分析
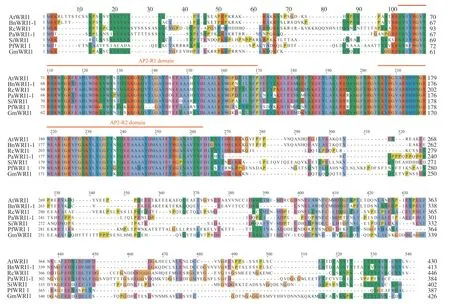
使用Jalview软件对紫苏、拟南芥、油菜、蓖麻、油梨(Persea americana)、芝麻、大豆的WRI1蛋白的氨基酸序列进行同源性比对(图5), 结果显示:7个物种的WRI1蛋白均包含2个AP2保守结构域, 即AP2-R1和AP2-R2;AP2-R2结构域高度保守, 而AP2-R1结构域保守性比AP2-R2 较低, 此外, AP2-R2结构域中包含一段由18个氨基酸(VSKYRGARHHHNGRWEAR)组成的高度保守的序列;除AP2结构域以外的两端序列的差异性极大, 推断AP2结构域在WRI1蛋白行使功能时发挥重要的保守作用。
利用MEGA11对紫苏PfWRI1蛋白序列与拟南芥、油梨和芝麻等14个物种的WRI1蛋白序列构建系统发育树(图6)。结果表明:PfWRI1转录因子与芝麻和油梨的亲缘关系最近, 与燕麦、二穗短柄草(Brachypodium distachyon)、山杏(Siberian apricot)和大豆的亲缘关系最远, 与油菜、拟南芥、油棕(Elaeis guineensis)、椰子(Cocos nucifera)的亲缘关系较近。
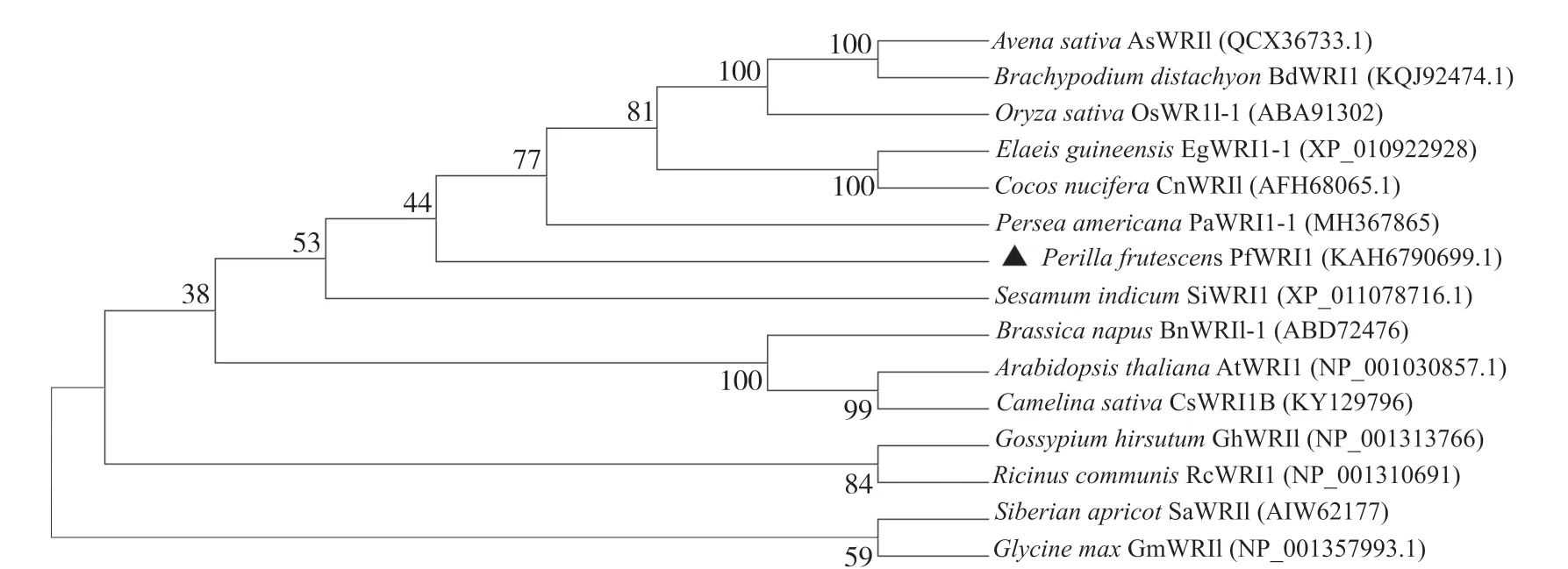
图6 各物种WRI1蛋白系统进化树Fig. 6 Phylogenetic tree of WRI1 proteins from different plant species
2.5 紫苏PfWRI1相互作用蛋白预测分析
植物油脂合成积累与逆境胁迫响应等生物学过程通常涉及许多转录因子, 同一类转录因子也可能协同作用, 共同参与油脂合成积累与逆境胁迫响应等的调控。将紫苏PfWRI1蛋白序列提交到STRING在线数据库中, 以模式植物拟南芥为基础, 检索可能与PfWRI1蛋白相互作用的蛋白质, 并构建互作网络图(图7)。结果显示, 在拟南芥中鉴定到一些和WRI1蛋白存在相互作用的其他蛋白, 如LEC1、FaTA、FATB、PDAT等, 这表明PfWRI1转录因子可能参与油脂合成积累的代谢调控。
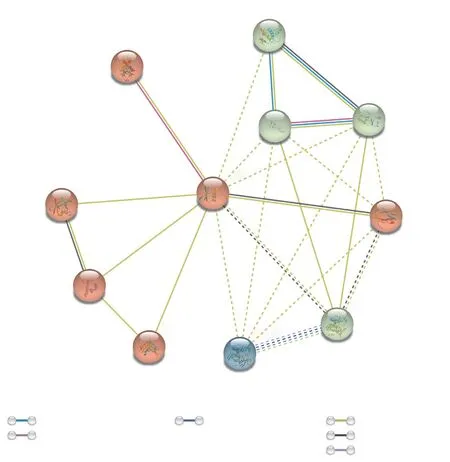
图7 紫苏PfWRI1蛋白与拟南芥中蛋白的相互作用Fig. 7 Interaction of PfWRI1 protein with other proteins of A. thaliana
2.6 PfWRI1基因在紫苏不同组织中的表达特性分析
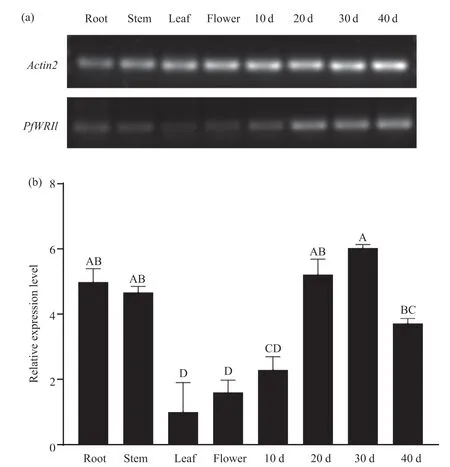
为探究PfWRI1基因在紫苏不同组织中的表达特性, 本研究通过sqRT-PCR和qRT-PCR检测分析PfWRI1在紫苏根、茎、叶、花和不同发育时期种子中的表达水平。sqRT-PCR结果显示(图8a),Pf-WRI1在紫苏叶和花中的表达最低, 在发育种子中的表达高于其他组织。qRT-PCR检测结果进一步表明(图8b),PfWRI1在紫苏的各个组织中均有表达, 在叶中的表达量最低, 随着种子的发育, 表达量呈现先上升后下降的表达模式, 且在种子发育中后期(开花后30 d)的表达达到最高, 与sqRT-PCR检测结果基本一致。以叶为对照,PfWRI1基因在根、茎、花中的表达量分别是叶中的4.99、4.66、1.60倍, 在种子发育不同时期的表达量分别是叶中的2.29、5.22、6.03、3.72倍。这些结果预示着PfWRI1可能在紫苏油脂合成积累过程中发挥重要作用。
2.7 PfWRI1基因在紫苏幼苗低温胁迫下的表达分析
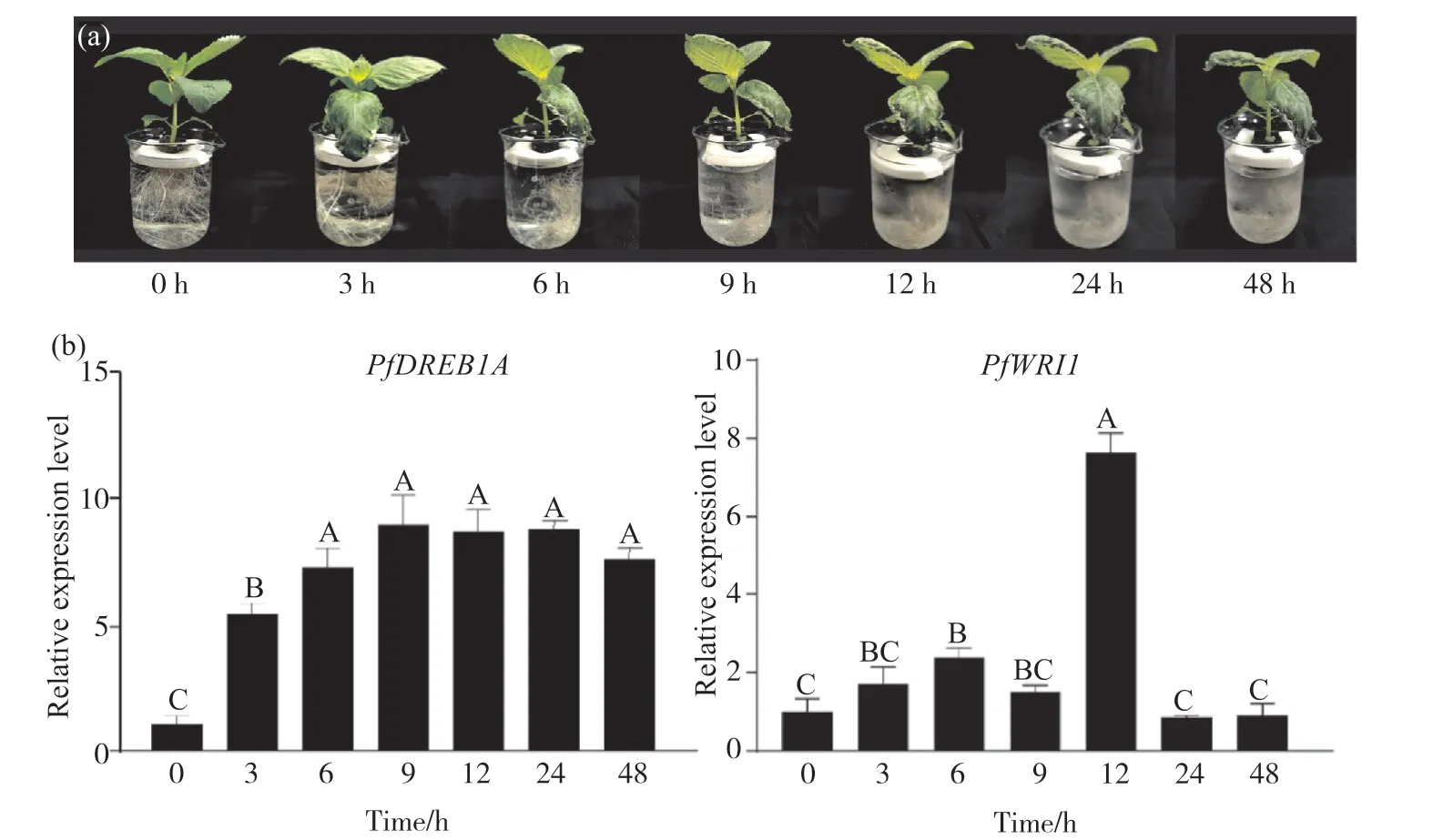
对紫苏幼苗进行4℃低温胁迫处理(图9a), 通过qRT-PCR分析PfWRI1基因和低温胁迫响应Marker基因PfDREB1A在低温胁迫不同时间的表达水平。qRT-PCR结果显示(图9b), 紫苏幼苗受到低温胁迫时,PfDREB1A基因的表达随胁迫时间的延长呈现先升高后下降的趋势, 胁迫早期阶段其表达急剧升高, 且在低温胁迫9 h后达到最高, 表明PfDREB1A基因受到低温胁迫的诱导。PfWRI1基因在低温胁迫不同时间紫苏幼苗中的表达呈现先上升后降低、随后又急剧升高再下降的趋势, 且在低温胁迫12 h后,PfWRI1的表达量达到最高, 是对照组(0 h)的7.64倍;低温胁迫处理3、6、9 h后Pf-WRI1的表达量较对照组表达量都有明显的提升, 分别是对照组的1.71、2.38、1.51倍;低温胁迫处理24、48 h后的表达量较对照组相比有所下降, 分别是对照组的0.86、0.92倍。据此推测,PfWRI1基因可能参与紫苏幼苗冷胁迫响应。
3 讨论
紫苏是一种新型的药食同源的油料经济作物, 开发应用价值非常广泛。紫苏籽油中不饱和脂肪酸含量较高, 尤其是α-亚麻酸, 是目前自然界中发现的α-亚麻酸含量最高的植物油。α-亚麻酸是一种健康有益型高值脂肪酸, 具有提高人体免疫力、改善睡眠、提高记忆力、增强智力、保护视力、降低血压血脂等重要的生理功能[7]。研究表明, WRI1转录因子参与调控植物(如拟南芥[15]、油棕[16]和蓖麻[18]等)油脂合成积累等生物学过程。大量试验研究表明, WRI1转录因子是植物油脂合成积累过程中的关键成员之一, 对植物种子油脂含量的提高具有重要的作用。如Yang等[21]在拟南芥中将AtWRI1基因进行超表达, 发现其种子含油量增加, 且引起幼苗中三酰甘油的积累。An等[22]在亚麻荠中超表达AtWRI1基因, 发现与野生型植株相比, 转基因植株油脂产量提高了14%。Shen等[23]在玉米中过表达ZmWRI1基因, 发现玉米种子中含油量增加了46%, 而且种子发芽和植株生长未受到影响。柴国华等[24]通过RNAi 技术干扰BnWRI1基因的表达, 发现油菜种子的含油量降低。但有关紫苏WRI1转录因子的研究鲜见报道, 特别是WRI1在紫苏生长发育、油脂合成积累及非生物胁迫应答等过程中的调控机制仍不清楚, 因此, 对紫苏WRI1转录因子进行研究具有重要意义。
以拟南芥AtWRI1转录因子为索引, 本研究通过BLAST检索在紫苏基因组中获得一个WRI1转录因子, 命名为PfWRI1, 通过分子克隆技术分离得到其完整CDS区, 并对其序列特征和表达特性进行了分析。结果表明:紫苏PfWRI1转录因子共编码氨基酸387个, 属于亲水性蛋白;无规则卷曲和α-螺旋是其二级结构中的主要结构元件, 这与大豆[25]、花生[26]和沙棘[27]WRI1蛋白的二级结构一致;亚细胞定位预测分析显示, PfWRI1蛋白定位于细胞核中, 与大豆、花生等物种中WRI1的亚细胞定位结果基本一致[25-28];紫苏和其他物种的WRI1蛋白序列同源性比对显示, 这些WRI1蛋白均包含2个AP2保守结构域, 即AP2-R1和AP2-R2, 推测AP2结构域在WRI1蛋白行使功能时发挥重要的保守作用;系统进化分析表明, PfWRI1与芝麻和油梨WRI1的亲缘关系最近;蛋白互作网络显示, WRI1蛋白与LEC1、FaTA、FATB和PDAT等油脂相关蛋白存在互作关系, 表明PfWRI1转录因子可能参与调控油脂合成积累等生物学过程。
通过sqRT-PCR和qRT-PCR分析发现,PfWRI1基因在紫苏根、茎、叶、花和不同发育时期的种子中均有表达, 随着种子的发育, 表达量呈现先升高后降低的表达模式, 且在种子发育中后期(开花后30 d)的表达最高, 与紫苏种子总脂肪酸和α-亚麻酸快速积累时期相吻合[29], 表明PfWRI1转录因子可能在紫苏种子油脂合成积累过程中发挥重要作用。这与大豆GmWRI1a的表达结果相似[30], 据此推测它们可能具有相似的生物学功能。研究表明, 低温胁迫能够提高植物质膜中脂肪酸的含量, 提高不饱和脂肪酸的指数, 且与植物的抗寒性关系密切[31-32]。白瑞英等[33]研究发现, 紫苏幼苗经低温诱导处理后,PfFAD3基因在叶片中的表达量显著上调。Domínguez等[34]研究表明, 番茄在低温诱导下, 其ω-3FAD基因的表达明显升高, 植株抗寒性增加。有研究表明,DREB1A等基因已经被证实是和植物冷胁迫相关的Marker基因, 且在水稻等耐冷功能研究中上调表达[20], 可作为低温胁迫相关的阳性对照来探究相关基因的耐冷分子机制。为探究PfWRI1对低温胁迫的响应, 本研究对紫苏幼苗进行了4℃低温胁迫处理, 分析了PfDREB1A和PfWRI1在低温胁迫下的表达。结果显示:PfDREB1A基因的表达随胁迫时间的延长呈现先升高后下降的趋势, 胁迫早期阶段其表达急剧升高, 且在低温胁迫9 h后达到最高, 表明其响应低温胁迫;而PfWRI1的表达呈现先上升后降低、随后又急剧升高再下降的模式, 且在低温胁迫12 h时其表达量达到峰值, 预示着PfWRI1可能参与紫苏幼苗冷胁迫响应。
本研究通过克隆成功分离获得紫苏PfWRI1转录因子的完整CDS, 并对其序列特征和表达特异性进行了分析, 为进一步研究PfWRI1在紫苏油脂合成积累和胁迫响应中的分子机制及功能奠定基础, 以期为利用分子生物学手段提高紫苏和其他油料作物的油脂含量、逆境抗性及改善其油脂品质提供有益的参考。
