免疫荧光技术在鱼类生殖细胞发育研究中的应用
2022-11-15杨聪慧杨福忠罗心玥赵如榕
杨聪慧, 杨福忠, 朱 辣, 罗心玥, 赵如榕, 张 纯*
(1. 省部共建淡水鱼类发育生物学国家重点实验室, 湖南师范大学生命科学学院, 长沙 410081; 2. 湖南湘云生物科技有限公司, 常德 415101)
生殖细胞发育相关的功能分子标记在研究试验对象的生殖和育性机理中发挥着重要作用, 已被广泛应用于人类及其他模式生物的生殖细胞发育研究中[1-2], 但在鱼类中应用较少。本研究使用的功能分子标记为RNA Pol II CTD(S5)蛋白, 即RNA聚合酶II中最大亚基RPB1的羧基末端结构域(carboxy terminal domain of RNA polymerase II, RNA Pol II CTD)的第5位丝氨酸磷酸化(phosphorylation of serine-5, S5)蛋白。RNA Pol II CTD是RNA聚合酶II具有活性的必需结构和进行转录调控活动的主要参与元件, 其作为主要的转录调控因子, 负责协调酶复合物的协同转录、调控染色质状态以及新生RNA的加工[3-4]。RNA Pol II CTD是一条高度保守的重复序列, 由7个氨基酸残基(酪氨酸1-丝氨酸2-脯氨酸3-苏氨酸4-丝氨酸5-脯氨酸6-丝氨酸7)作为重复单位元件, 重复次数为26~52次。该结构的七肽会发生磷酸化和去磷酸化的循环反应, 从而影响RNA聚合酶Ⅱ对mRNA的5'帽子和3'末端的加工及基因外显子的识别剪切过程[5]。其中, RNA Pol II CTD(S5)的磷酸化修饰主要发生在转录起始阶段[6], 这使其可作为转录活性标记因子来显示生物是否进行了基因转录及基因转录的活跃状态。所以, 采用RNA Pol II CTD(S5)蛋白作为鱼类生殖细胞发育的功能分子标记, 对不同发育状态鱼类生殖细胞的染色体进行免疫荧光分析, 可发展为定位和检测与生殖细胞分裂过程的调控及发育密切相关的基因转录活性区域及其细胞相特征的一个有效途径。
免疫荧光原位杂交技术(immunofluorescencein situhybridization technique, Immuno-FISH), 简称免疫FISH, 是利用抗原与抗体反应的原理, 将特异性抗原或抗体定位于试验细胞或细胞中的染色体上的一种常用标记技术, 用以对特异蛋白抗原或抗体在细胞或染色体上的分布、表达量等情况进行研究, 以达到定量、定位检测的效果。该技术已在人、小鼠、斑马鱼、果蝇等模式生物的染色体免疫荧光定位分析中有较多报道[7-11]。在鱼类中, 常使用荧光原位杂交技术(fluorescencein situhybridization, FISH)对特异性遗传序列进行染色体定位, 利用5S rDNA(染色体臂间标记因子)、着丝粒DNA(着丝粒标记因子)等串联重复序列作为探针进行多倍体鉴定、杂交检测或染色体结构畸变等研究[12-13]。目前, 利用基因转录表达调控相关的功能分子标记进行鱼类生殖细胞染色体免疫荧光分析的研究很少。因此, 本研究选用了常规淡水试验鱼鲤(Cyprinus carpio, 俗称common carp)作为研究对象, 对其生殖细胞的染色体进行RNA Pol II CTD(S5)蛋白定位分析, 以探讨鱼类生殖细胞染色体免疫荧光的方法。
1 材料与方法
1.1 试验材料
本试验所取用的试验鱼鲤来自于湖南师范大学省部共建淡水鱼类发育生物学国家重点实验室及湖南湘云生物科技有限公司, 性腺组织等需解剖后取材, 试验鱼在被解剖前都使用2-苯氧乙醇(美国西格玛)实施昏迷处理。
1.2 试验方法
1.2.1 染色体制片
试验鱼剪鳃放血5~10 min后进行解剖, 取性腺用以制备生殖细胞染色体, 取肾脏用以制备体细胞染色体。用肾脏进行染色体制片时, 需要在取材之前根据鱼的体重注射适量植物血球凝集素(phytohemagglutinin, PHA)溶液, 以刺激肾组织中的淋巴细胞分裂, 并根据鱼的体重注射适量秋水仙素溶液, 以阻止细胞完成细胞分裂。将取好的材料放在培养皿中, 添加适量生理盐水(质量分数为0.8%)以维持材料的细胞形态。用小剪刀剪碎相关材料, 移置15 mL离心管中吹打7~9 min。静置6~9 min后, 缓慢吸取上清液, 注意不要吸取沉淀, 离心(1 200 r/min, 5 min), 弃上清液, 留沉淀。在离心得到的细胞沉淀中加入0.050% KCl低渗液(肾脏细胞用0.075% KCl低渗液), 低渗60~120 min, 离心(1 200 r/min, 5 min), 弃上清液, 留沉淀。加入适量卡诺氏液(注意卡诺氏液需要现配现用, 甲醇和乙酸3∶1体积比的混合液), 反复固定细胞沉淀2~5次, 每次固定15 min, 离心(1 200 r/min, 5 min), 弃上清液, 留沉淀。固定好后, 加入少许卡诺氏液, 吹散细胞沉淀。滴片时, 将细胞悬液滴于载玻片正中央。细胞悬液于4℃或-20℃冰箱保存。
1.2.2 免疫荧光定位
在低温下, 加入适量5%多聚甲醛, 固定相关细胞及染色体制片10 min, 使用1×磷酸缓冲盐溶液(phosphate buffer saline, PBS)重复清洗3次, 每次2 min。然后将染色体制片置于2.0% Triton X-100溶液中5 min, 使用1×PBS重复清洗3次, 每次2 min。将染色体制片置于5%牛血清白蛋白溶液中, 封闭20 min。加入适量一抗RNA Pol II CTD(S5)(1∶100 dilution;Abcam5131)稀释液, 将染色体制片放在湿盒中, 4℃下孵育12 h, 然后使用1×PBS重复清洗。在避光条件下, 加入适量异硫氰酸荧光素(fluorescein Isothiocyanate, FITC)标记的二抗稀释液, 在37℃下孵育60 min, 使用1×PBS重复清洗几次。滴加少量4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI, 质量浓度为0.2 mg/mL)染液, 采用荧光数码显微摄像系统(DM4B, 徕卡Leica, 德国)观察和拍照。
2 结果与分析
2.1 染色体制片的影响
在免疫荧光试验过程中, 染色体标本的储存方式、储存条件、储存时间及滴片时的处理方式对试验效果有着非常重要的影响。在其他试验条件保持相对稳定的前提下, 本研究设置储存时间梯度并对不同储存方式(制备好的细胞悬液或染色体制片)进行了对比试验。结果表明(表1), 以细胞悬液的方式于-20℃储存的染色体标本做出的免疫荧光试验效果比较好, 即滴片需现滴现用, 不能以滴在玻片上的形式储存。当然, 若储存时间较久, 染色体形态也会发生改变, 从而影响试验结果。因此, 在储存过程中需勤换存储液, 以保护染色体的形态及其固有的蛋白活性。此外, 在试验过程中还发现, 由于蛋白质加热后易失活, 在冰冻玻片上滴片后, 不能用酒精灯烤片, 应静置于常温, 让其自然风干。

表1 片龄以及储存环境的不同对镜检效果统计Tab. 1 Microscopy results statistics of specimens preserved in different methods and duration
2.2 洗片方式的影响
由于用以免疫荧光试验的染色体制片没有经过烘烤, 导致染色体在玻片上的黏附程度以及形态的稳定性会有所下降。而且, 在后续的试验过程中, 完成每一步反应后都需要对染色体制片进行清洗, 清洗的程度对后续的反应以及最终试验结果中细胞的形态有着重要的影响。最终镜检结果中变形的细胞如图1所示。在其他试验条件保持相对稳定的前提下, 本研究对洗片过程中不同摇晃程度、摇晃时间及洗片溶液等因素进行了对比试验。
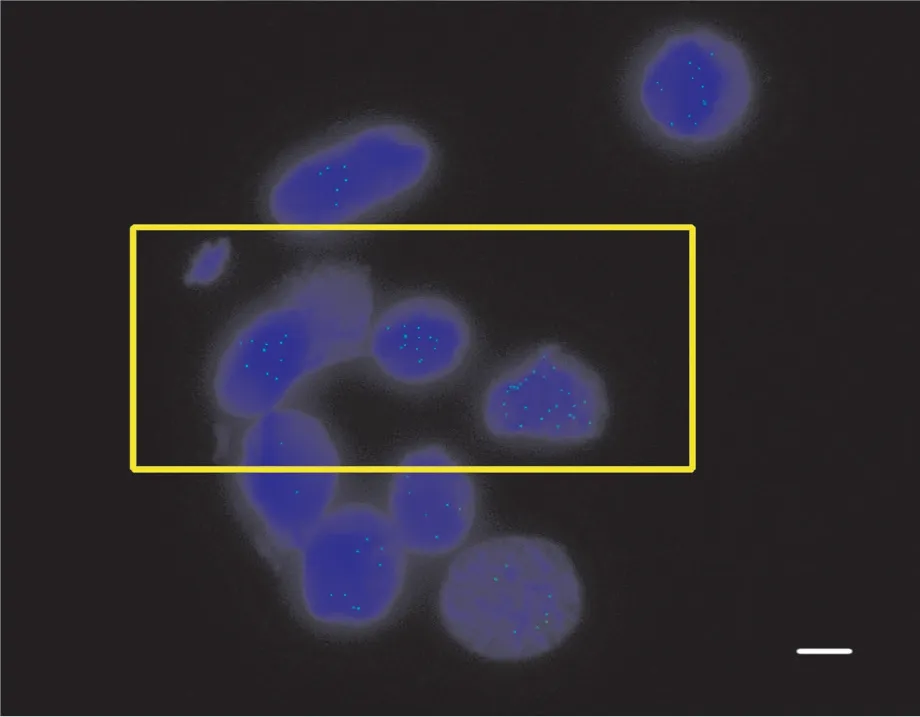
图1 免疫荧光定位检测中变形的细胞(比例尺为15 μm)Fig. 1 The distorted cells in immunofluorescence experiment (Scale bar is 15 μm)
为了更直接地观察洗片方式对细胞形态的影响, 在染色体制片完成后直接对玻片进行清洗, 再用吉姆萨染液进行染色观察, 最后选择几种具有代表性的洗片方式进行完整的免疫荧光试验。试验全程均使用黏附正电荷防脱玻片。
结果表明(表2), 在洗片过程中摇晃时间越长, 最终试验结果中的细胞变形越厉害, 但完全不摇晃又可能会导致荧光镜检时的背景有些许不干净。因此, 可以选择每间隔2 min轻轻摇晃, 以保证洗干净残留的试剂。染色体制片在预试验吉姆萨染液染色观察后, 需要用流水冲洗。考虑到流水冲洗的影响, 本研究做了一个不洗片直接染色后冲洗的染色体制片。结果表明, 在玻片背面用流水冲洗并不会影响细胞的形态。因此, 本试验发现也可以采用冲洗的方法来清洗免疫荧光试验过程中残留在玻片上的试剂。
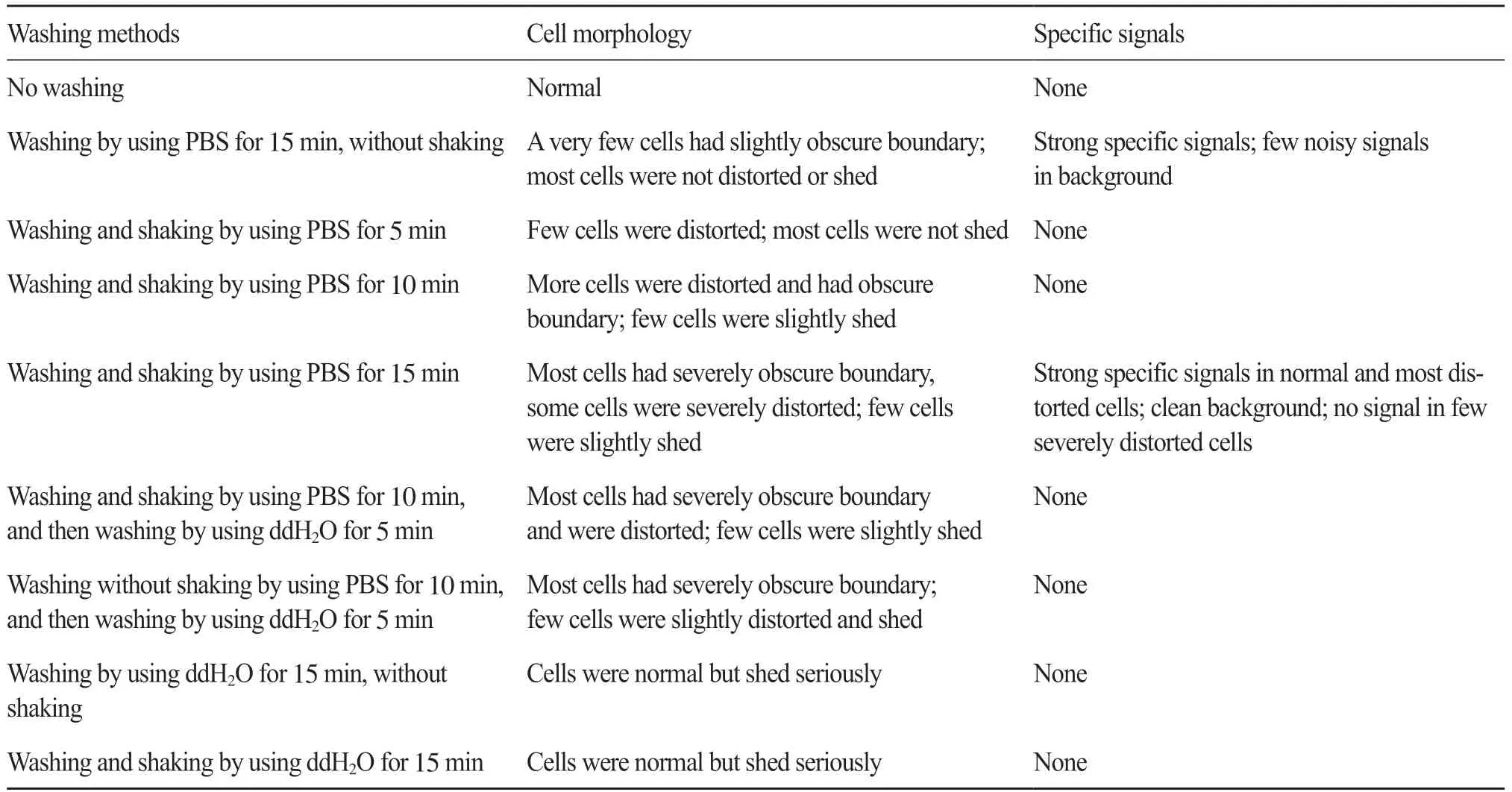
表2 洗片方式对镜检结果的影响Tab. 2 Microscopy results statistics of specimens treated in different washing methods
2.3 RNA Pol II CTD(S5)蛋白免疫FISH在鲤生殖细胞的定位特征
以鲤体细胞作为对照, 利用免疫荧光技术对RNA Pol II CTD(S5)蛋白在鲤生殖细胞染色体中进行定位分析, 结果发现(图2), 在鲤的生殖细胞分裂相中可检测到规律性的特异性定位信号。对免疫荧光试验结果进行统计后发现, 鲤体细胞染色体的RNA Pol II CTD(S5)定位信号数目明显比生殖细胞的多, 且在数目上呈现一定的规律性(表3):体细胞间期分裂相主要呈现21~24个信号, 也有一部分为8~12个信号;中期分裂相主要呈现10~12个信号, 也有一部分为1~5个信号。在鲤生殖细胞中(表4), 处于减数第一次分裂前期的生殖细胞主要呈现8~20个信号, 数目明显多于处于其他减数分裂阶段的生殖细胞的信号数。随着减数分裂的进行, 生殖细胞中的特异性信号逐渐减少, 在成熟精子中则检测不到相关信号。该结果表明, 鲤雄性生殖细胞发育过程中的基因转录活性具有一定的规律性。

表3 鲤体细胞中信号数目统计Tab. 3 Statistics of signals number in somatic cells of common carp

表4 鲤生殖细胞中信号数目统计Tab. 4 Statistics of signals number in germ cells of common carp

图2 RNA Pol II CTD(S5)蛋白在鲤体细胞和生殖细胞染色体中的免疫荧光检测Fig. 2 Immunofluorescence detection of RNA Pol II CTD (S5) protein in chromosomes of common carp somatic and germ cells
3 讨论
生殖生物学一直是生命科学领域的重要研究课题之一, 而鱼类的生殖发育研究在基础理论及育种实践方面都具有非常重要的意义。在生殖细胞发育的研究中, 有效的功能分子标记有助于研究试验对象的生殖发育及其调控网络的分子机理, 在哺乳动物和临床医学领域研究中已经得到了广泛应用[1-2]。例如, 我国学者已经从单细胞水平系统阐述了人类精子发生过程中的基因表达调控网络和细胞命运转变路径, 挖掘出多个只在特定细胞类型表达的关键功能分子标记[14]。在鱼类中, 得以鉴定的生殖细胞标记基因也日益增多, 包括vasa、nanos、dnd(dead-end)、dazl(deleted in azoospermialike)、sdf1(stromal cell-derived factor-1)和cxcr(chemokine receptor)等[15-19]。但这些基因的表达多集中在原生殖细胞(primordial germ cells, PGCs), 而鱼类生殖细胞的发育过程(以雄性生殖细胞为例)涉及PGCs、精原细胞、初级精母细胞、次级精母细胞、精子细胞和精子等多种细胞类型。因此, 仅使用上述几个分子标记来探索鱼类生殖细胞的发育机理还远远不够, 亟需挖掘新的功能分子标记并应用于鱼类生殖细胞的发育过程研究中。本研究利用RNA Pol II CTD(S5)蛋白作为分子标记对鲤雄性生殖细胞核进行免疫荧光试验, 成功获得了定位信号, 并对染色体标本保存条件、洗片方式等技术参数进行探讨和总结。该研究结果不仅为鱼类生殖发育过程中基因转录活性的相关研究奠定重要的候选标记, 还为该技术的广泛应用提供了重要经验。
关于利用RNA Pol II CTD蛋白作为分子标记来做免疫荧光的研究在许多生物中均已有所报道。例如, 在非洲爪蟾卵母细胞中, 通过免疫荧光显色将RNA聚合酶II大亚基RPB1定位于细胞核核浆, 发现少量RPB1与灯刷染色体的转录单位有关, 并在RNA Pol II CTD(S2)和RNA Pol II CTD(S5)上发生磷酸化[20]。在小鼠卵母细胞减数分裂过程中, 通过磷酸化的RPB1的免疫荧光染色体定位, 检测到p-RNA Pol II CTD(S2)准确定位于微管组织中心(microtubule-organizing center, MTOC)和着丝粒中;p-RNA Pol II CTD(S5)与减数分裂过程中纺锤体的微管保持共同定位, 并维持纺锤体结构的稳定性;p-RNA Pol II CTD(S7)与微管的聚合状态有关[21]。在哺乳动物(人和小鼠)细胞中, 通过免疫荧光试验检测到p-RNA Pol II CTD(T4)与RNA Pol II的超磷酸化形式(Pol IIO)密切相关, 推测其可能参与了基因转录延伸的调控[22]。在小鼠的精巢组织中, 通过免疫组化检测到p-RNA Pol II CTD(S5)抗体于小鼠每一类生殖细胞中均有阳性反应, 直至第8阶段精子细胞;而在人类精巢组织中, 于精母细胞粗线期到第3阶段精子细胞有阳性反应, 其余阶段无阳性反应[23]。目前为止, 很少有在鱼类中进行的RNA Pol II CTD蛋白定位研究。本研究在鲤细胞中对RNA Pol II CTD(S5)蛋白免疫荧光FISH进行开创性探索试验, 发现与RNA Pol II CTD(S5)蛋白关联的转录活性位点数在体细胞和生殖细胞不同阶段均呈现出规律性分布, 该结果可直接反映出鱼类生殖细胞发育过程中的基因转录活跃性, 并且荧光位点数目与染色体数目具有一定的关联性, 在鱼类多倍化研究方面也具有重要的意义。
