Aβ1-42对大鼠小胶质细胞酸敏感离子通道的表达 和电生理特性的影响
2022-11-15余晓巍詹丽超朱啸川叶生宝葛行义
余晓巍, 蔡 拓, 詹丽超, 朱啸川, 叶生宝, 葛行义*
(1. 医学病毒学湖南省重点实验室, 湖南大学生物学院, 长沙 410082;2. 湖南省职业病防治院, 长沙 410003)
阿尔茨海默病(Alzheimer’s disease, AD)是一种与年龄相关的神经退行性疾病, 表现为缓慢而渐进式的记忆障碍, 进而随时间的推移演变为不可逆的认知损伤和执行功能丧失, 对患者的生活质量造成了极大的影响。β淀粉样蛋白(amyloid β, Aβ)聚集形成的老年斑被认为是AD的典型病理特征之一[1]。小胶质细胞是中枢神经系统内的固有免疫细胞, 在AD的早期阶段Aβ激活小胶质细胞使得其发挥清除脑部Aβ, 阻止Aβ斑块形成的功能[2-6]。随着AD病理进程的发展, 脑部固有免疫系统的激活并不足以有效地清除Aβ[7]。在Aβ持续慢性刺激作用下, 小胶质细胞过度活化, 释放大量炎性细胞因子, 如TNF-α、IL-1β、活性氧(reactive oxygen species, ROS)等[8]。Aβ的不断聚集与炎性过程之间形成正反馈通路, 导致了慢性炎症反应, 最终导致神经细胞的坏死和凋亡[9]。
炎症时常伴有组织的酸化[10]。酸敏感离子通道(acid-sensing ion channel, ASIC)作为一种配体门控型离子通道, 其主要特性便是感受胞外pH值下降, 被激活后主要对Na+和Ca2+有通透性, 从而形成内向电流, 导致细胞膜去极化, 产生兴奋性效应[11]。
Aβ由β淀粉样前体蛋白(β-amyloid precursor protein, APP)经γ-分泌酶和β-分泌酶的蛋白水解而来, 主要有Aβ1-40、Aβ1-42、Aβ1-43三种类型[12]。大量研究表明, Aβ1-42寡聚体对神经细胞产生的毒性作用较强, 低浓度的Aβ1-42寡聚体就可以直接导致神经元的损伤[13], 且Aβ1-42具有较强的疏水性, 容易促使Aβ纤维的聚集形成老年斑, 更能模拟AD的发展过程[14]。本研究拟通过观察Aβ1-42暴露对原代培养大鼠小胶质细胞ASIC电生理特性的影响, 以期为Aβ1-42聚集导致的神经元损伤提供可能的应对策略。
1 材料与方法
1.1 试验动物
出生1~2 d内的SD大鼠(Sprague-Dawley rats)购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0014] 。本研究经实验动物使用与管理委员会(Institutional Animal Care and Use Committee, IACUC)批准[湘职防(2019)伦研批003号] , 在湖南省职业病防治院毒理学实验室[SYXK(湘)2017-0001] 进行试验。
1.2 主要试剂
Aβ1-42购自强耀生物技术有限公司;ASIC1、ASIC2a和ASIC3抗体、OX42、Hoechst 33258购自英国Abcam公司;阿米洛利(amiloride)和Psalmotoxin 1(PcTx1)购自美国Sigma公司;Fura-2/AM荧光探针购自美国Biotium公司;荧光标记二抗购自北京中山生物有限公司, 异硫氰酸荧光素(fluorescein isothiocyanate, FITC)和罗丹明购自美国Pierce公司;达尔伯克改良伊格尔培养基(Dulbecco’s modified Eagle medium, DMEM)、胰蛋白酶和青霉素/链霉素双抗购自美国Hylone公司;二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量试剂盒购自碧云天生物技术有限公司。
1.3 试验方法
1.3.1 大鼠皮层原代小胶质细胞的制备
取健康的新生SD大鼠乳鼠, 用75%酒精消毒皮肤, 在无菌环境下迅速开颅取脑, 放入装有预冷的磷酸盐缓冲液(phosphate buffered saline, PBS)的无菌培养皿中清洗并仔细剔除脑膜及血管, 分离大脑皮质并充分剪碎后, 置于0.125%胰蛋白酶消化液中于37℃消化20 min。待组织变成絮状半透明状后终止消化, 200目尼龙滤网过滤后1 000 r/min离心7 min, 弃上清, 加入含10%胎牛血清的DMEM培养基悬浮细胞沉淀成混悬液, 接种于预先涂布多聚赖氨酸的培养瓶中, 置于37℃、5% CO2培养箱中培养24 h后全量换液, 此后每3 d换液1次。原代培养至第14天, 更换含10%胎牛血清的DMEM培养基后将培养瓶旋紧密封, 固定于37℃恒温水平摇床内220 r/min振荡3 h, 收集细胞悬液接种于培养皿中, 1 h后更换含10%胎牛血清的DMEM培养基去除未贴壁细胞, 继续培养。
1.3.2 蛋白免疫印迹试验
将小胶质细胞接种于6孔培养板, 每个培养皿接种1×105个细胞, 将培养皿置于37℃、5% CO2培养箱中培养24 h, 待细胞贴壁后分别加入0、5、20 μmol/L的Aβ1-42处理24 h, 经胰酶消化后收集细胞, 提取总蛋白。按BCA蛋白测定说明书对蛋白含量进行测定后, 进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)。电泳结束后, 250 mA、100 min将蛋白转移至硝酸纤维素膜(nitrocellulose filter membrane, NC)上, 用质量分数为5%的脱脂奶粉封闭1 h后, 用磷酸盐吐温缓冲液(phosphate buffered saline Tween-20, PBST)洗膜3次, 每次10 min;将NC膜放入稀释好的ASIC1抗体(1∶500)中, 4℃过夜;次日用PBST漂洗NC膜3次, 每次10 min, 然后放入辣根过氧化物酶标记的二抗(1∶5 000稀释)中, 室温孵育1 h;再次用PBST漂洗NC膜3次, 每次10 min;加入增强型化学发光剂(enhanced chemiluminescence, ECL)孵育5 min后, 将NC膜置于化学发光仪上进行检测。试验重复3次(n=3)。
1.3.3 免疫荧光标记试验
将种有细胞的玻片放入24孔板, 20 μmol/L的Aβ1-42处理小胶质细胞24 h后, 用4%的多聚甲醛固定30 min, 0.01 mol/L PBS浸洗3次, 每次10 min, 0.3% Triton X-100室温孵育30 min进行透化处理, 再加3%牛血清白蛋白(bovine serum albumin, BSA)室温封闭30 min;加入ASIC1抗体(1∶50), 4℃过夜;次日, 用0.01 mol/L PBS浸洗3次, 每次10 min, 加入FITC或罗丹明标记的荧光二抗(1∶50), 室温孵育1 h, 0.01 mol/L PBS浸洗3次, 每次10 min;再加入Hochest 33258孵育30 min染核;15%甘油封片后, 置于奥林巴斯FV1000荧光显微镜下观察、拍照。采用奥林巴斯FV10-ASW显微摄影图像分析系统摄取免疫荧光图像, 随机测定5个视野细胞荧光强度, 试验重复5次(n=5)。
1.3.4 全细胞膜片钳记录
将种有细胞的玻片放入24孔板中, 20 μmol/L的Aβ1-42处理小胶质细胞24 h后, 弃去培养液, 加入适量的细胞外液, 在倒置相差显微镜下选择状态良好的细胞进行试验。将电极尖端移入细胞外液, 入水前将玻璃微电极内给予正压, 调节液接电位使其归到零线。当电极尖端接触到细胞膜表面时, 电极电阻会出现轻度增加, 此时释放正压, 轻微施加负压, 可见示波器上测试脉冲逐渐减小, 形成高阻抗封接, 并出现幅值相同方向相反的电容瞬流。调节电容补偿按钮抵消瞬时的电容电流, 然后给予负压抽吸打破细胞膜, 形成全细胞记录模式。此时示波器上出现较大的来自细胞膜的跨膜电容瞬流。再进行串联电阻补偿和全细胞电容补偿。将小胶质细胞钳制在膜电位附近, 通过多管灌流系统快速改变钳制细胞微环境的pH值至6.0, 持续5 s, 记录酸诱导的电流。电流信号通过模/数(A/D)转换采集数据, 试验重复5次(n=5)。
1.3.5 钙离子荧光成像测定
将种有细胞的玻片放入24孔板中, 20 μmol/L的Aβ1-42处理小胶质细胞24 h后, 弃去培养液, 钙外液漂洗3遍;取1 μL浓度为1 mmol/L的Fura-2/AM荧光探针储存液加入1 mL细胞外液, 混匀后加入试验皿中, 37℃避光孵育30 min;钙外液漂洗3遍后, 加入1 mL细胞外液, 在倒置相差显微镜下选择状态良好、分散均匀的细胞, 通过多管灌流系统快速改变细胞微环境的pH值至6.0, 持续5 s, 分别以340 nm和380 nm的荧光进行激发, 利用Fura-2/AM荧光探针将细胞内钙离子浓度变化转化为荧光信号。以F340/F380荧光强度比值表示细胞内游离钙离子浓度的变化。系统自动实时监测, 数据由TILLVISION软件进行记录和分析, 试验重复6次(n=6)。
1.4 统计学方法
2 结果与分析
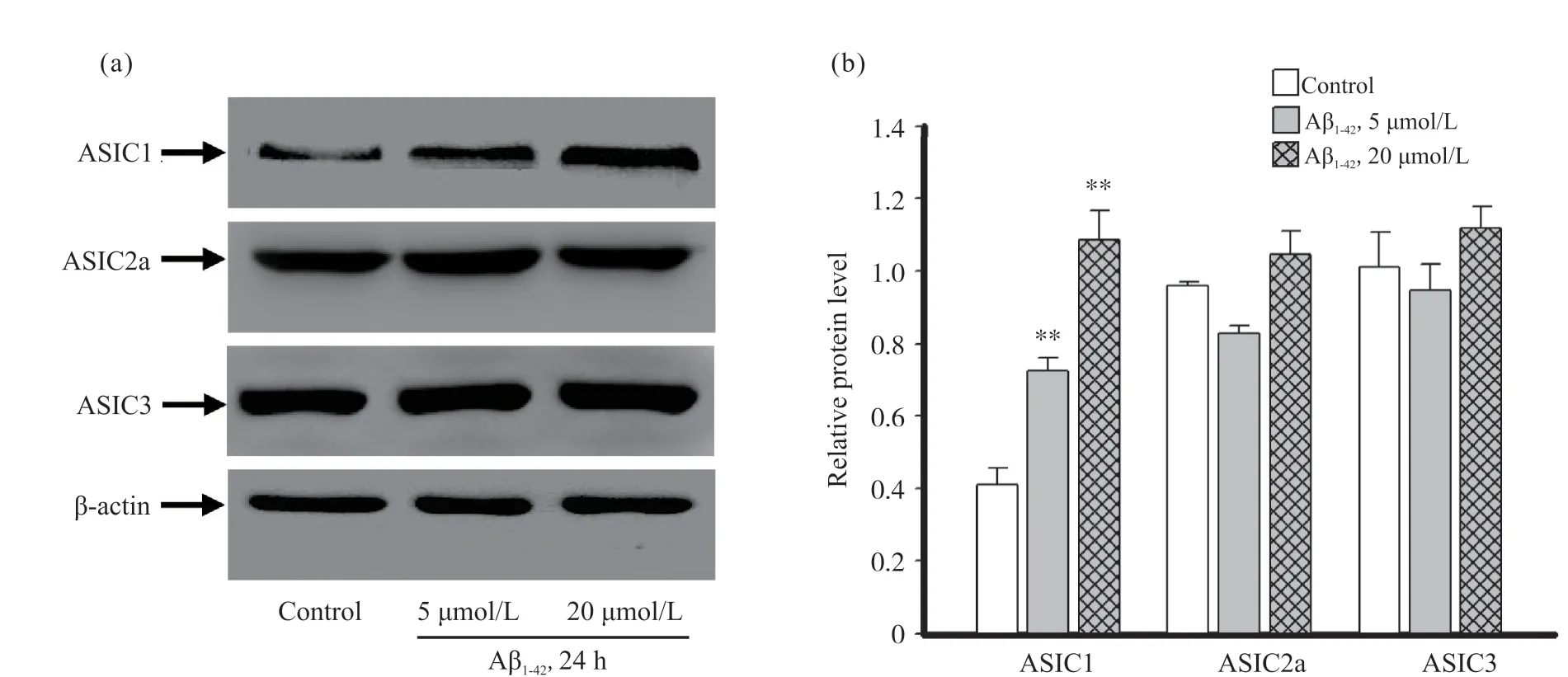
2.1 Aβ1-42暴露对小胶质细胞ASIC1、ASIC2a、ASIC3蛋白表达及细胞形态的影响
蛋白免疫印迹试验结果显示:小胶质细胞ASIC1的蛋白表达水平随Aβ1-42浓度的增加明显增加, 在5、20 μmol/L Aβ1-42浓度下, 其表达量分别增加约1倍、2倍, 与对照组比较差异有统计学意义(P<0.01);ASIC2a和ASIC3的蛋白表达水平, 在5、20 μmol/L Aβ1-42浓度下均无显著变化(图1)。
免疫荧光试验结果显示, 20 μmol/L的Aβ1-42处理小胶质细胞24 h后, 小胶质细胞形态由细长分枝状转变为阿米巴状, 表现为突起回缩和形态变圆。细胞质与细胞核中ASIC1的总相对荧光强度明显增强, 与对照组比较差异有统计学意义(P<0.01)(图2)。

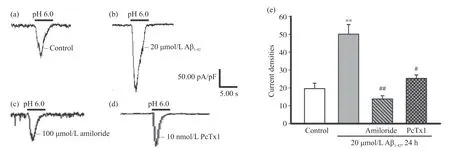
2.2 Aβ1-42暴露对小胶质细胞ASIC1电流特性的影响
通过多管灌流系统实现pH由7.4到6.0的快速转换, 将电压钳制在 80 mV, 记录到了典型的ASIC样电流, 对照组电流密度为(19.58±3.05)pA/pF;20 μmol/L的Aβ1-42处理小胶质细胞24 h后, 电流密度增强为(50.03±5.37)pA/pF, 与对照组比较差异有统计学意义(P<0.01);给予100 μmol/L的ASIC非特异性阻断剂阿米洛利或10 nmol/L的ASIC1特异性阻断剂PcTx1预处理小胶质细胞5 min, 电流可被明显抑制, 电流密度分别为(13.78±1.82)pA/pF和(25.25±1.99)pA/pF, 抑制率分别为(71.13±5.16)%和(45.44±1.46)%, 与对照组比较差异有统计学意义(P< 0.05或P< 0.01)(图3)。
2.3 Aβ1-42暴露对小胶质细胞ASIC钙离子通透性的影响
通过多管灌流系统实现pH由7.4到6.0的快速转换, 对照组胞内钙离子浓度变化(F340/F380)为(0.41±0.02);20 μmol/L的Aβ1-42处理小胶质细胞24 h后, 胞内钙离子浓度变化(F340/F380)增加为(1.20±0.09), 与对照组比较差异有统计学意义(P<0.01);给予100 μmol/L的ASIC非特异性阻断剂阿米洛利或10 nmol/L的ASIC1特异性阻断剂PcTx1预处理5 min, 可抑制胞外酸化引起的小胶质细胞胞内钙升高, 抑制率分别为(71.02±9.25)%和(50.68±10.25)%, 与对照组比较差异有统计学意义(P<0.05或P<0.01)(图4)。

图4 Aβ1-42暴露对小胶质细胞ASIC钙离子通透性的影响Fig. 4 The effect of Aβ1-42 on the calcium permeability of ASIC in microglia
3 讨论
AD的确切病因及发病机制尚未完全阐明, 但研究证实, 在正常大脑中Aβ的产生和清除处于一个平衡状态, 该过程失衡导致Aβ的聚集是推进AD病理进程的根本原因[15-16]。小胶质细胞作为中枢神经系统中驻留的免疫细胞, 大脑任何类型的损伤或疾病导致的炎症反应都会使静止的分枝状小胶质细胞转变为活化的圆形且有高度吞噬能力, 并能分泌炎性细胞因子, 在AD的发生及发展过程中扮演着重要角色[17-18]。
炎症是机体组织受损时的一种保护性应答, 属于固有免疫反应[19]。炎症发生时常常伴有组织的酸化, 即病变处pH值(5.5~7.0)低于正常(7.2~7.4), 这种低pH环境被认为是炎症反应的标志[20]。ASIC通过感受细胞外pH的下降被激活, 对Na+和Ca2+的通透形成内向电流, 导致细胞膜去极化, 产生兴奋性效应, 参与突触传递及可塑性调节、学习记忆过程[21-22]。
大量研究证实, ASIC1 在多种神经退行性疾病中发挥了重要的作用。在自身免疫性脑脊髓炎模型和多发性硬化患者脑部组织中, 少突胶质细胞和轴突 ASIC1表达上调, 遗传性的阻断ASIC1的表达可减缓轴索变性, 显著改善临床症状[23]。ASIC1介导了α-synuclein的自噬性降解, 对1-甲基-4-苯基吡啶(1-methyl-4-phenylpyridiniumion, MPP+)诱导的 PC12 细胞损伤具有保护作用, 提示 ASIC1 可能成为治疗帕金森病的重要靶标[24]。
已有研究证实, 小胶质细胞功能性表达ASIC1, 通过感知胞外酸化介导小胶质细胞的迁移和TNF-α、IL-1β等相关炎症因子的释放, 参与小胶质细胞的炎症应答和神经炎症免疫调节[25]。而小胶质细胞在清除Aβ的同时可诱发过度的神经炎症反应, 已被视为AD的重要病理指征[26-27]。关于Aβ对小胶质细胞ASIC1的相关作用目前尚未见任何报道。本研究发现, 给予Aβ1-42刺激后, 小胶质细胞形态由静息时的分枝状迅速改变为具有高度吞噬能力的阿米巴状, 表明其被活化, 且胞核和胞浆中的ASIC1蛋白表达水平明显增加。已有研究表明, ASIC主要分布在小胶质细胞的胞膜和胞浆中, 便于感知细胞内外环境的变化[25]。为了验证ASIC的功能是否变化, 分别采用全细胞膜片钳方法和钙离子成像技术观察和记录胞外酸化条件下小胶质细胞ASIC电流和对钙离子的通透性, 结果表明, 静息状态下的小胶质细胞仅有基础的电生理特性, 经过Aβ1-42刺激后能显著增强胞外酸化诱导的ASIC电流并使胞内钙增加。ASIC非特异性阻断剂阿米洛利和ASIC1特异性阻断剂PcTx1的阻断效应提示, 主要是ASIC1参与了胞外酸化引起的内向电流和胞内钙水平升高。其原因可能为Aβ刺激小胶质细胞后ASIC1的表达增加, 从而使得ASIC1易于被激活而产生内向电流, 并表现出对钙离子的通透性。
综上所述, Aβ暴露可活化体外培养的小胶质细胞, 显著增加ASIC1的蛋白表达, 并表现出明显增强的电生理特性, 为进一步深入研究ASIC1在小胶质细胞内化和吞噬Aβ中的作用以及Aβ的神经毒性机制奠定了理论基础。
