M-MOF-74吸附分离H2/He混合物的分子模拟研究
2022-11-13王玉杰李申辉赵之平
王玉杰,李申辉,赵之平
(1中国石化北京化工研究院,北京 100013; 2 北京理工大学化学与化工学院,北京 102488)
引 言
He 由于其化学惰性、分子量小、低沸点以及高导热性等特点,广泛用于航空航天、低温超导、医疗等 领 域[1]。从 液 化 天 然 气(liquefied natural gas,LNG)的不凝尾气中提取He,是He 资源化利用的新兴领域[2]。LNG 工厂的泡点气因富集了He、Ar 等稀有气体,是优良的稀有气体原料,通过对泡点气进行分离来生产He 具有较好的发展前景[3]。此外,泡点气中还含有大量H2、N2、CH4等杂质气体,对于N2、CH4等杂质气体可通过高压冷凝等办法来除去[4],但H2由于难以液化被浓缩在粗He 中, 其中H2的摩尔分数在7%~40%不等[2],并需要在粗He 精制前将H2除去。工业上一般采用催化氧化脱氢法来去除H2[5],但化学方法往往伴随着催化剂的失活、反应剂的消耗和H2的不可再生等问题。因此,采用物理的膜分离及吸附分离等方法来分离H2是一种更为绿色环保的手段。
对于膜分离而言,Antunes 等[6]在压力为7 bar(1 bar=105Pa)的条件下,研究了MFI-ZSM 沸石分子筛膜对H2∕He 混合物的分离能力,结果表明纯H2及纯He 的通量比仅为1.88 ± 0.03。Simplicio 等[7]通过MFI 型沸石分子筛中空纤维膜分离He 摩尔分数约为99.9%的H2∕He 混合物,依据环境温度的差异,纯H2与纯He 的通量比最高可达2.31。Favvas 等[8]研究了活性炭中空纤维膜对H2、He、CO2、O2和CH45种气体两两组合所形成混合物的分离能力,并指出随着气体分子分子动力学直径的上升,气体通量有下降趋势,且纯H2及纯He 的通量比接近于1,这表明H2及He由于其相近的分子动力学直径,较难依靠尺寸筛分的方法进行膜分离。
然而,依据H2及He 在极性上的差异,理论上能够通过两者与吸附材料相互作用强度的差异来进行吸附分离。鉴于金属有机框架材料(metal organic frameworks,MOFs)相较于无机分子筛与气体分子具有更高的亲和性[9],MOFs 可作为吸附分离材料的选择对象。MOFs 材料上的有机配体通常以π-电子的弱范德华相互作用来捕获H2[10],这使得MOFs 对H2的负载容量较低,达不到美国能源部(US Department of Energy,DOE)2020 年设置的目标(5.5%(质量)或者40 g·L-1)[11]。而Pham 等[12]的研究工作表明,含有金属空配位点(open metal site,OMS)的MOFs由于H2与金属的配位作用能够显著增加其对H2的吸附容量。因此,为了提高MOFs 对H2的亲和性,可通过对MOFs 的去溶剂化处理,来暴露MOFs 的OMS。在众多的包含OMS 的MOF 材料中,MOF-74 由于易于合成、孔径及孔隙率大以及金属中心离子易于调控等优点,成为研究吸附分离混合气体的热点材料[13-16]。但通过实验的方法研究H2∕He 混合物在MOF-74 上的吸附性能往往伴随着人力和资源的消耗。随着信息技术的发展,分子模拟技术已成为一种甄别MOFs 材料对特定体系是否具有分离性能,并能够在分子层面的空间尺度解释吸附机理的手段[17-19]。对于H2∕He 混合物的难分离问题,通过物理吸附法对H2∕He 进行分离的报道较少,这使得设计吸附H2∕He的MOFs材料缺乏先验知识。因此,采用分子模拟的方法能够通过极小的成本来获取较多的信息,从而初步判断某种MOFs 材料是否具有H2∕He分离的潜力。
本文通过分子模拟的方法,首先,在不同的环境压力下计算H2及He 在M-MOF-74(M= Mg、Co、Ni、Cu、Zn)的吸附量,来考察M-MOF-74 是否具有工业应用的潜力。随后,研究不同浓度的H2∕He 混合物在M-MOF-74 上H2和He 的竞争吸附行为。最后,通过探究H2和He 在M-MOF-74 上的吸附位点、吸附热,以及不同金属离子对H2的吸附强度,从而解析H2和He在M-MOF-74上的吸附机理。
1 模拟方法
M-MOF-74 的结构文件从剑桥大学晶体数据库(The Cambridge Crystallographic Data Centre,CCDC)下载获得[20],并通过Chung 等[21]提供的Python脚本去除掉M-MOF-74 中吸附的溶剂分子。MMOF-74的结构特点如表1所示,其结构性质由多孔材料分析软件Zeo++计算得到[22]。通过GCMC 的方法来模拟M-MOF-74 对H2、He 以及H2∕He 混合物的吸附性能,且所有的GCMC 计算皆由RASPA(2.0 版本)软件包来完成[23]。Monte Carlo 总的计算步数为5×107步,前2×107步用于平衡,后3×107步用于采样。在模拟过程中保持MOFs 框架为刚性,且在每一步MC的模拟过程中,客体分子进入∕离开MOFs的概率以及在MOFs 中平移∕旋转的概率皆为0.5。非键相互作用的截断半径为1.2 nm,且为了避免由周期性边界条件(periodic boundary conditions,PBC)引起的最近邻镜像相互作用,将M-MOF-74 的单胞扩展为1×1×4 的超胞。采用TraPPE 力场描述H2和He 的非键相互作用势[24],并采用五点模型来描述H2的分子结构,从而增加计算结果的精确性[25]。采用UFF 力场来描述M-MOF-74[26],原子电荷来自Pham 等[27]的工作。
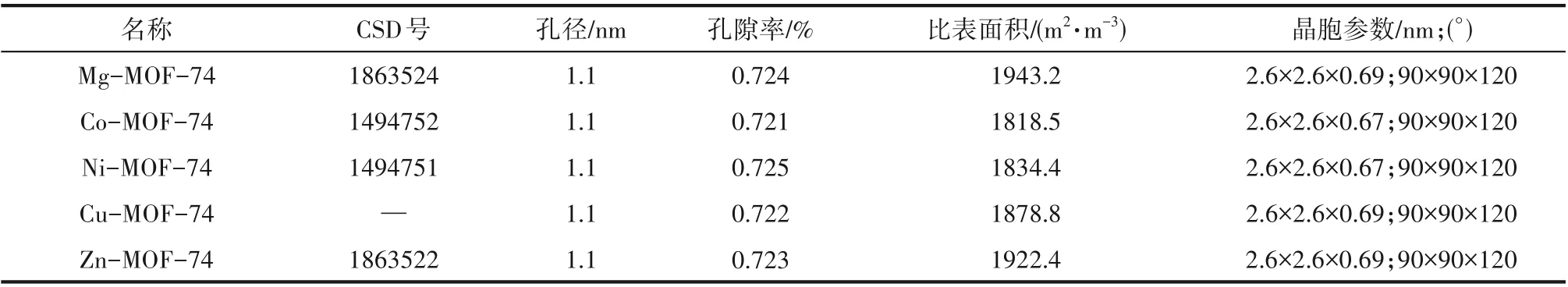
表1 M-MOF-74的结构特点Table 1 Structural features of M-MOF-74
M-MOF-74 的结构及孔尺寸如图1(a)所示,H2及He 的三维尺寸如图1(b)所示,H2的五点模型如图1(c)所示,H2与He 的物化性质如表2 所示。MMOF-74 的力场参数及原子电荷如表3 所示。计算过程中,环境温度维持为300 K。表4为本文计算得到的H2在M-MOF-74上吸附热与实验值的对比,结果表明本文使用的力场对Mg-MOF-74和Co-MOF-74具有较好的描述,分别高估和低估了Zn-MOF-74和Ni-MOF-74 与H2的吸附热,但总体来说与实验值具有相似的趋势。此外,图1(d)为M-MOF-74 在77 K 下对H2的吸附等温线,其中的实验数据来自文献[36-38]。结果表明,模拟与实验在不同压力下的数值较为吻合,也说明了力场参数的合理性。综合上述吸附热及吸附等温线的结果,能够通过本文的模型定性对比不同金属中心MOF-74 对H2∕He 混合物吸附分离能力。

表2 H2与He的物化性质Table 2 Physicochemical properties of H2 and He
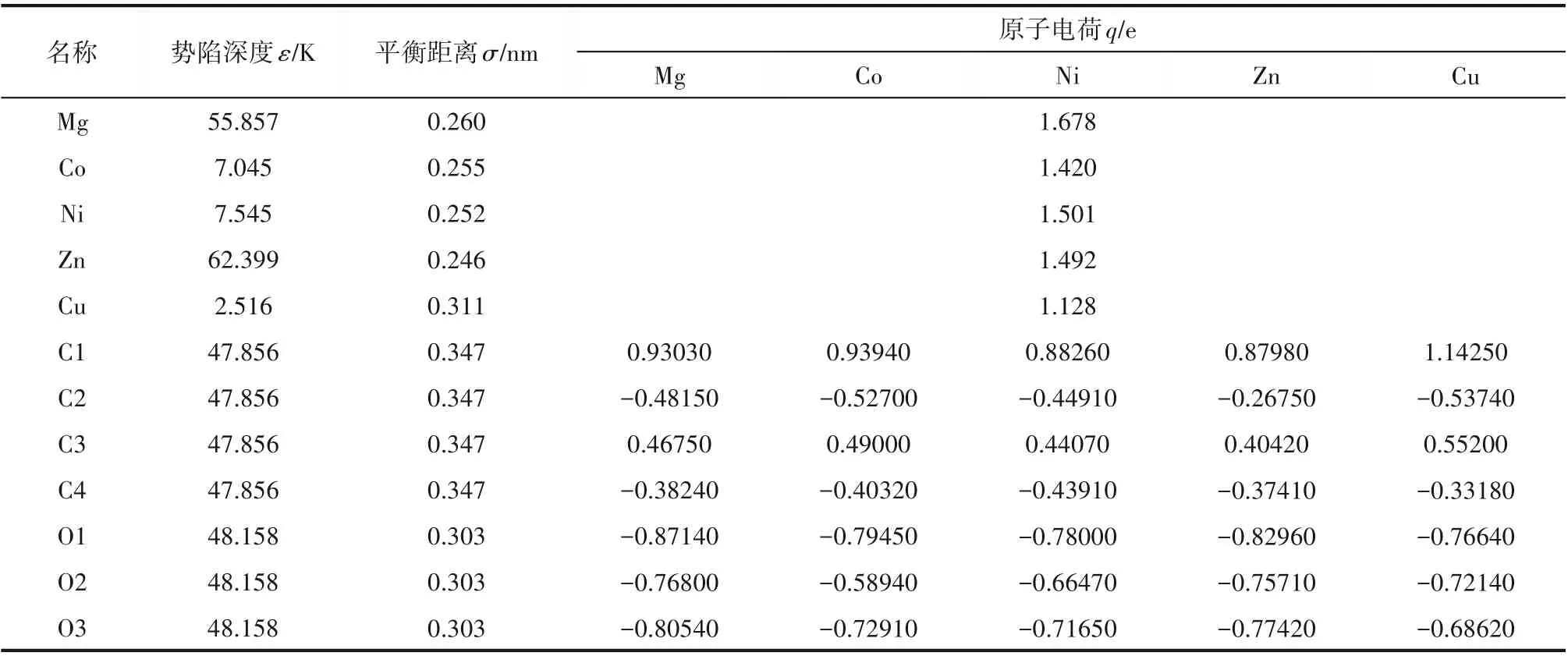
表3 M-MOF-74的力场参数及原子电荷Table 3 Force field parameters and atomic charges of M-MOF-74
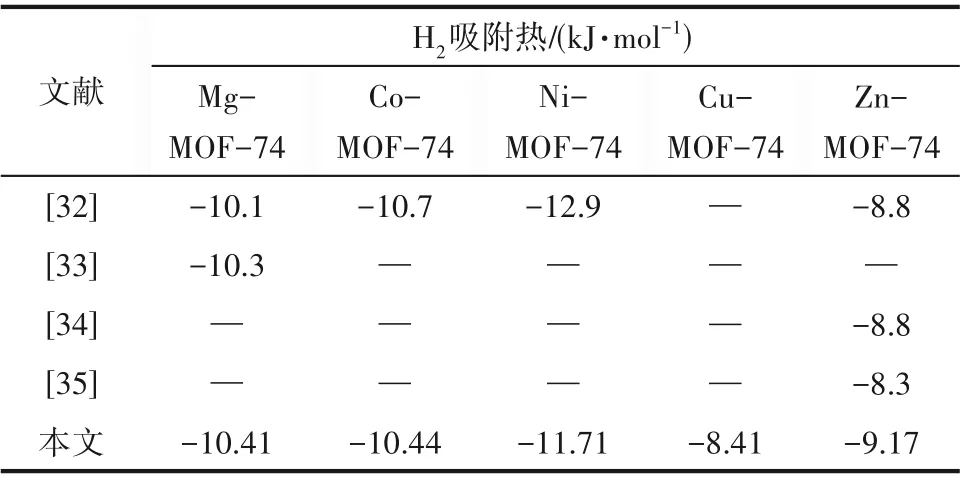
表4 本文计算得到的吸附热与实验值的对比Table 4 Comparison of heat of adsorption calculated in this work with experimental values
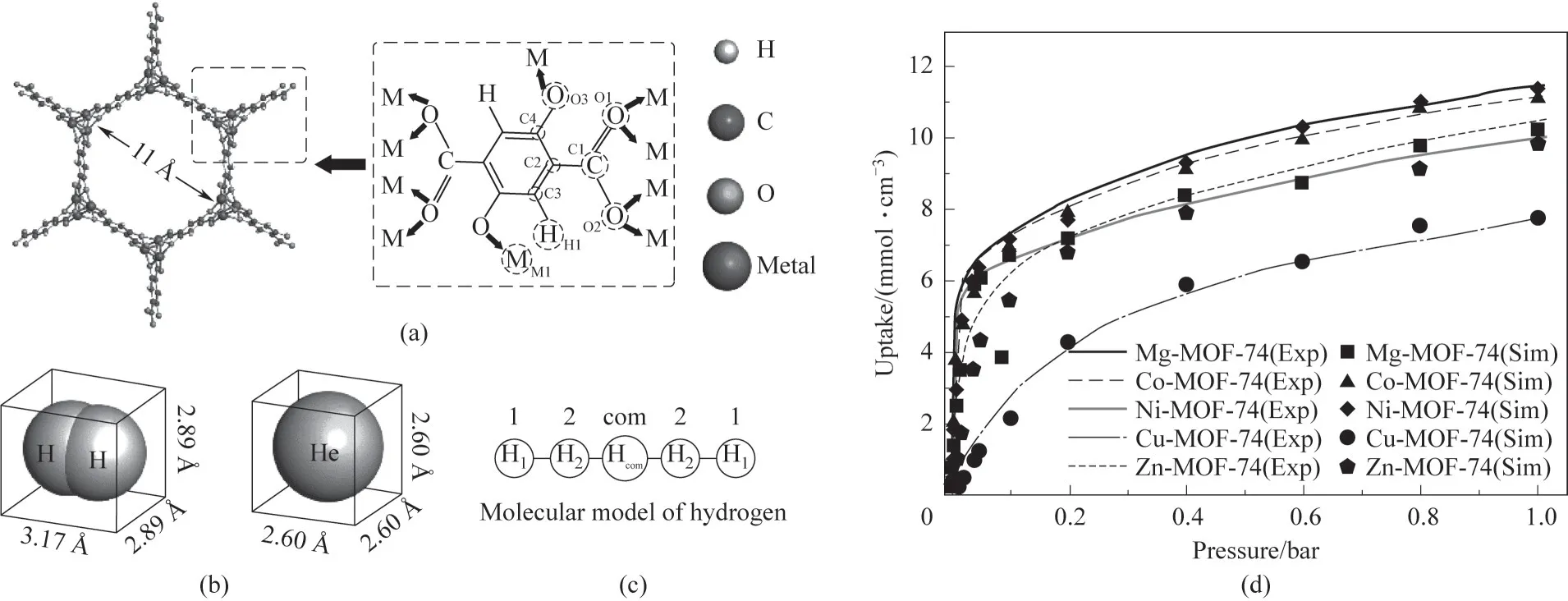
图1 (a)M-MOF-74的结构;(b)H2和He的分子尺寸;(c)H2的五点模型;(d)M-MOF-74对H2的吸附等温线(其中Exp代表实验测得的吸附等温线,数据来自文献[36-38];Sim代表本文模拟得到的数据;1 Å=0.1 nm)Fig.1 (a)Structure of M-MOF-74;(b)Molecular dimensions of hydrogen and helium;(c)Five-point model of hydrogen;(d)Adsorption isotherms of H2 in M-MOF-74(where Exp represents the experimentally measured adsorption isotherm,and the data are from Refs.[36-38];Sim represents the data get from the simulation of this work)
相较于分子力场方法,基于密度泛函理论(density functional theory, DFT)的相关方法在描述分子间相互作用时更为准确。故本文将H2和He 在M-MOF-74上由GCMC方法得到的能量最低的吸附构象作为DFT 的输入构象。为了研究OMS 位点对H2和He 的吸附作用,截取了包括H2和He 分子在内的M-MOF-74 的一个金属团簇作为研究对象。采用Gaussian(版本09)软件,在泛函为M062X,基组为6-31++G(d, p)的级别下对所选团簇进行结构优化,且在优化过程中,冻结M-MOF-74 的原子坐标,并依据式(1)计算H2和He与金属中心的结合能:

式中,EBindingEnergy为H2和He与M-MOF-74的结合能,kJ·mol-1;E(MOF-74+gas),EMOF-74及Egas分别为M-MOF-74 和H2或者He 同时存在时的能量,M-MOF-74 单独存在时的能量及H2或者He 单独存在时的能量,kJ·mol-1。随后采用约化密度梯度(reduced density gradient, RDG)的方法[39]可视化了H2与M-MOF-74的弱相互作用。波函数分析软件和可视化软件分别为Multifwn[40](3.8版本)及VMD[41](1.9.3版本)。
2 结果与讨论
2.1 环境压力对吸附量的影响
在给定体积与温度的条件下,环境压力越小气相流体物质的量越小,即压力越低,气相流体与吸附剂接触的概率越低,处于动态平衡的吸附量也越低。因此,本文研究了环境压力分别为1、5、10、15及20 bar 时纯H2和纯He 在M-MOF-74 上的吸附量,来考察M-MOF-74 是否在工业上具有应用前景。考虑到不同金属中心在摩尔质量上有较大差异,吸附量的计算公式如式(2)所示
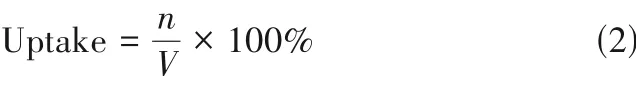
式中,n为吸附H2或者He 的吸附量,mmol;V为M-MOF-74的体积,cm-3。由于不同金属中心MOF-74 的体积接近,因此吸附量完全由金属中心的差异来控制。如图2(a)~(e)所示,随着环境压力的上升,H2和He 在M-MOF-74 上的吸附量皆上升,且H2的吸附量远高于He 的吸附量。其中,H2和He 在Mg-MOF-74 上的吸附量最大,在20 bar 的环境压力下Mg-MOF-74 对H2和He 的吸附量分别为3.33 和0.583 mmol·cm-3。而H2在Cu-MOF-74 上的吸附量最小,He 在Ni-MOF-74 上的吸附量最小。为了进一步对比H2和He 在不同金属离子MOF-74 上吸附选择性的差异,计算了不同环境压力下纯H2对纯He 在M-MOF-74 上的吸附选择性,计算式如式(3)所示
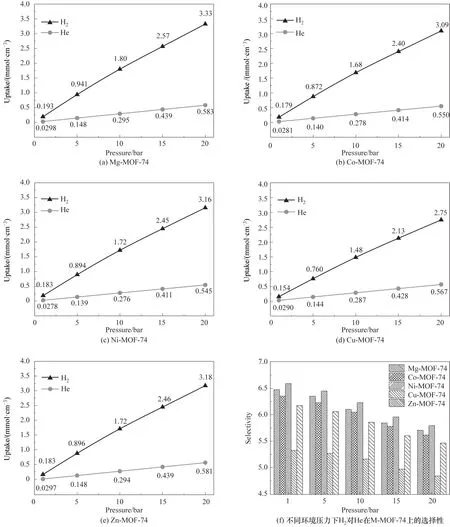
图2 环境压力对H2及He在M-MOF-74上吸附量和选择性的影响Fig.2 Effects of ambient pressure on the adsorption of H2 and He on M-MOF-74

式中,S为选择性;UH2、UHe分别为H2、He 在MMOF-74 上的吸附量。如图2(f)所示,随着环境压力上升,纯H2对纯He 在M-MOF-74 上的吸附选择性下降,即吸附量和选择性存在着此消彼长的相互制约(trade-off)现象。其中,H2对He 在Ni-MOF-74上的吸附选择性在环境压力为1 bar时最高,大小为6.58,其次是Mg-MOF-74 的6.47,最小为Cu-MOF-74 的5.32。此外,对于不同的金属中心离子的MOF-74,吸附选择性的波动范围皆在1.5 以内,说明MOF-74 金属中心离子的变化不能显著影响H2和He在M-MOF-74上的吸附性能。
2.2 H2/He混合浓度对吸附性能的影响
当环境温度、压力及体积恒定时,气相流体混合物某一组分的物质的量与其密度相关,且多组分在吸附剂表面存在竞争关系,而某组分浓度越大,其与吸附剂接触的概率越大,使得该组分能够在竞争吸附中取得优势。因此,通过计算H2摩尔分数分别为1%、5%、10%、20%以及40%的H2∕He混合物中H2对He 的分离因子,来修正He 由于较高的浓度所带来的吸附竞争优势。分离因子的定义式如下

式中,α为分离因子;UH2、UHe分别为H2、He 在M-MOF-74 上的吸附量;XH2为H2的摩尔分数。如图3(a)~(e)所示,随着H2浓度的上升,H2在MMOF-74 上的吸附量上升,而He 在M-MOF-74 上的吸附量下降,且H2吸附量上升的速度大于He 下降的速度。在H2摩尔分数为40%时,H2在Mg-MOF-74 上的吸附量最大,在Cu-MOF-74 上的吸附量最小。图3(f)为H2摩尔分数对分离因子的影响,当H2摩尔分数为40%时,H2∕He 混合物在Ni-MOF-74 上吸附时取得最高的分离因子,其值为6.78,而在Cu-MOF-74 上取得最低的分离因子,其值为5.48。此外,随着H2摩尔分数的上升,不同金属中心离子的MOF-74的分离因子皆无明显变化,这表明H2∕He混合物中H2浓度的下降并不会减少H2与吸附剂相互作用的能力。
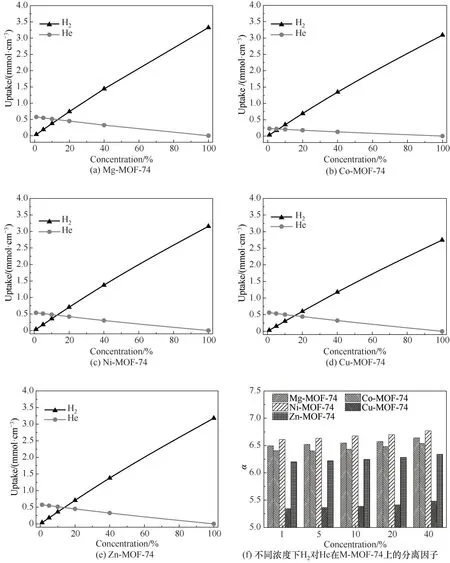
图3 H2∕He混合浓度对两者在M-MOF-74上吸附量和分离因子的影响Fig.3 The effect of H2∕He mixture concentration on the adsorption of H2 and He on M-MOF-74
2.3 M-MOF-74中溶剂分子对吸附量的影响
为了定性描述OMS 的存在对H2及He 在MMOF-74 上吸附量的贡献,计算了在环境压力分别为1 和20 bar 时,M-MOF-74 含有OMS 以及OMS 被溶剂分子占据的情况下,纯H2和纯He 在M-MOF-74上的吸附量。如图4(a)所示,OMS位点的存在对H2吸附量的影响远大于对He 吸附量的影响。这提示OMS 为H2的主要吸附位点,而不吸附He。其中,H2吸附量受到OMS 影响最大的是Co-MOF-74,去除溶剂前后的吸附量分别为0.037 和0.178 mmol·cm-3,Ni-MOF-74 与之相近。而H2吸附量受到OMS影响最小的是Cu-MOF-74,去除溶剂前后的吸附量分别为0.063 和0.154 mmol·cm-3。当环境压力为20 bar 时,OMS 存在也会显著影响H2在M-MOF-74 上的吸附量,但对比图4(a)和图4(b)可知,高压情况下OMS 的存在对H2吸附量的影响要小于低压情况下的影响。这主要是由于压力较低时,气体的物质的量也较低,因此气体分子会优先占据相互作用较强的吸附位点,即在较低压力时,H2分子主要占据OMS 位点,而随着压力的上升,其他位点也会逐渐被H2分子所占据,从而稀释了OMS位点对吸附量的贡献。
图4 M-MOF-74上OMS位点对H2和He在M-MOF-74上吸附量及H2∕He选择性的影响Fig.4 Effects of OMS sites on M-MOF-74 on the adsorption capacity of H2 and He and ideal selectivity of H2∕He on M-MOF-74
2.4 吸附机理的分析
2.4.1 吸附位点和能量分析 为了探究H2和He 在M-MOF-74 上吸附性能的差异,固定M-MOF-74 仅能吸附一个H2分子或He分子,随后在温度300 K 下进行4×107步的GCMC计算,前2×107步用于平衡,后2×107步用于采样。由于为单分子吸附,其相互作用能即为该温度下的吸附热[42]。通过自编程的方法每隔2000步记录H2分子或He分子的质心位置和吸附热,从而生成10000 个能够关联质心位置和吸附热的样本,通过VMD(1.9.3版本)软件对吸附热的分布进行可视化分析。图5 为H2和He 在M-MOF-74 上的吸附热分布,其中颜色越接近蓝色,代表吸附能力越弱,而颜色越接近红色,代表吸附能力越强。由图5(a)可知,H2的吸附主要发生在两个位置,其一为OMS 位点,其二为有机配体的苯环附近,且前者的吸附热为红色,而后者为绿色,这表明H2在OMS 位点处的吸附热高于苯环位点。而He 仅能够吸附在有机配体的苯环附近,且吸附热远小于H2。此外,从两个吸附位点附近的样本数量可知,OMS位点所能够容纳的H2分子数量要远小于有机配体苯环位点。然而,当OMS 位点被溶剂分子占据时,从图5(b)可看出,当H2聚集在溶剂水分子周围时,其吸附热与吸附在苯环上的吸附热接近,表明此时OMS不再是H2的吸附位点。

图5 H2、He在M-MOF-74上的吸附热分布Fig.5 Adsorption heat map of H2 and He in M-MOF-74
进一步将上述的10000个关联质心位置和吸附热的样本点进行统计分析,得到如图6 所示的H2和He 在M-MOF-74 上的吸附热频率直方图。从图6(a)~(e)可看出,OMS 是否存在对He 在M-MOF-74上的吸附热分布没有较大影响,但会使得H2在MMOF-74 上的分布更加向低能量方向迁移,这意味着OMS主要以高能量的方式对吸附热做贡献。
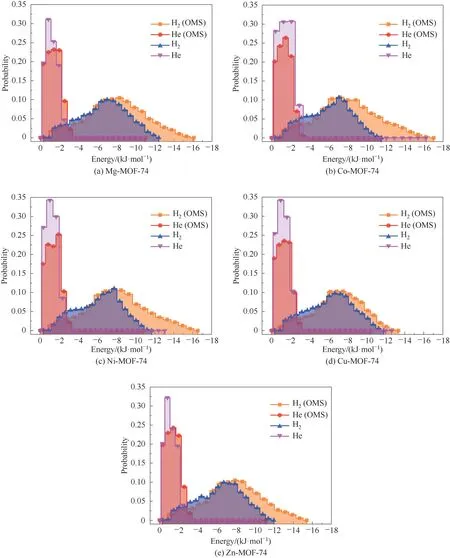
图6 H2、He在M-MOF-74上的吸附热频率直方图Fig.6 Histograms of adsorption heat frequencies of H2 and He on M-MOF-74
2.4.2 金属中心对吸附性能的影响 通过吸附热分布图和吸附热频率直方图可知,不同金属中心对H2和He 的吸附性能存在一定的差异。进一步通过DFT的方法,在电子大小的时空层面考察了H2和He与金属中心相互作用的差异。如图7(a)所示的RDG 分析,H2与M-MOF-74 皆存在着弱相互作用,表明M-MOF-74 的金属位点的确为H2的一个吸附位点,这与上述GCMC得到的结果是一致的,且依据RDG 的大小和颜色差异可知相互作用强度Ni2+>Co2+>Mg2+>Zn2+>Cu2+。如图7(c)所示,H2到MOF-74 金属中心离子的距离依次为Cu2+(0.277 nm)>Zn2+(0.262 nm)>Mg2+(0.243 nm)>Co2+(0.217 nm)>Ni2+(0.211 nm),而He到MOF-74金属中心离子的距离依次为Ni2+(0.342 nm)>Zn2+(0.335 nm)>Cu2+(0.333 nm)>Co2+(0.331 nm)>Mg2+(0.320 nm)。H2到金属中心的距离越近,越易通过色散产生的负电中心与金属离子进行相互作用,从而通过弱配位作用增强H2在M-MOF-74 金属中心上的吸附。而He到所有金属中心的距离皆大于0.3 nm,这使得He和金属中心很难产生弱相互作用,这是因为He具有明显的化学惰性,色散偶极矩极其微弱,无法与金属中心及图7(b)所示的芳香环位点产生明显的弱相互作用。此外,He 到五种金属中心的距离差异较小,这意味着五种金属中心对He的吸附能力无明显差异。图7(d)为结合能的计算结果,H2与Ni2+的结合能绝对值最大为14.23 kJ·mol-1,H2与Cu2+的结合能绝对值最小为10.46 kJ·mol-1;He与所有金属中心的结合能绝对值皆在3.70 kJ·mol-1左右,该结果进一步验证了上述观点。
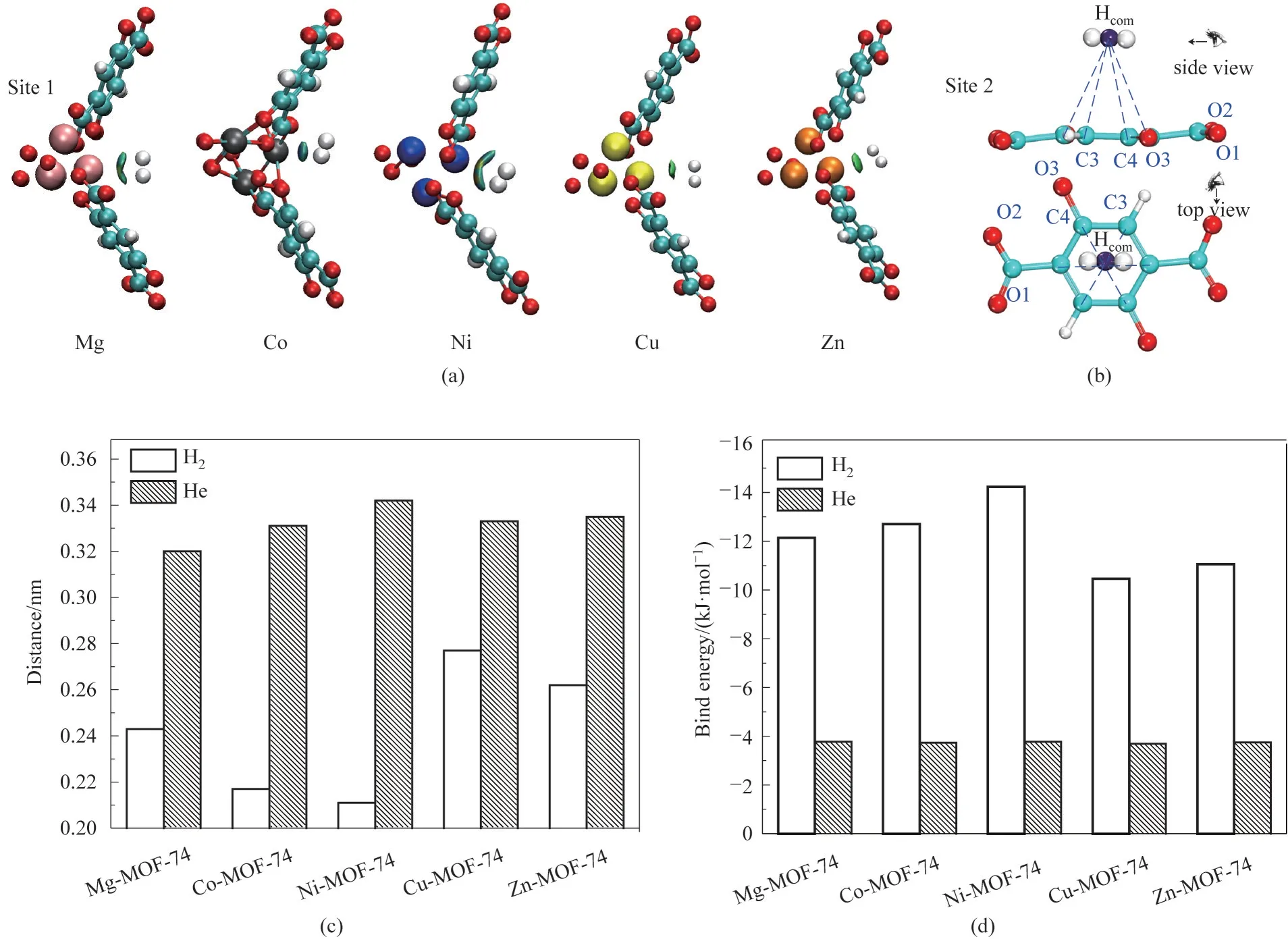
图7 (a)H2在M-MOF-74上的金属离子吸附位点及RDG分析(其中蓝色代表一定的配位作用,绿色代表弱的范德华相互作用),等值面为0.2;(b)H2在M-MOF-74上的苯环吸附位点;(c)H2和He到M-MOF-74的平衡距离;(d)H2和He与M-MOF-74的结合能Fig.7 (a)Metal ion adsorption sites and RDG analysis of H2 on M-MOF-74(Blue represents certain coordination and green represents weak van der Waals interactions),isosurface at 0.2;(b)H2 adsorption sites on the benzene ring on M-MOF-74;(c)Equilibrium distances of H2 and He to M-MOF-74;(d)Binding energy of H2 and He to M-MOF-74
3 结 论
通过分子模拟的方法,首先,在不同的环境压力下计算了H2及He 在M-MOF-74 上的吸附量。然后,研究了不同浓度的H2∕He 混合物在M-MOF-74上H2和He 的竞争吸附行为。最后,解析了H2和He在M-MOF-74上的吸附机理,得到以下主要结论。
(1)采用M-MOF-74 作为吸附剂分离H2∕He 混合物时,Ni-MOF-74 具有最高的选择性,而Mg-MOF-74 对H2具有最大的吸附量,其在压力为20 bar时值为3.33 mmol·cm-3,为同等条件下He吸附量的5.71 倍。这表明MOF-74 作为吸附材料分离H2∕He混合物时在选择性方面有一定的优势,具有应用于工业生产的潜力。
(2)M-MOF-74上OMS位点的H2吸附热分布在12~17 kJ·mol-1之间,而有机配体对H2的吸附热分布在0~12 kJ·mol-1。OMS 位点的存在几乎不影响He吸附热的分布,He 吸附热分布在0~2.7 kJ·mol-1之间。由于M-MOF-74 上OMS 吸附位点的存在,强化了M-MOF-74与H2的相互作用,最终提高了H2在M-MOF-74上的吸附量和选择性。
(3)对于不同金属离子的MOF-74 而言,H2与M-MOF-74 上不同金属中心结合顺序为Ni2+>Co2+>Mg2+>Zn2+>Cu2+,而He 与不同金属中心结合的能力皆弱于H2且相近,这得益于H2为双原子分子,存在较弱的色散偶极矩,而He 具备明显的化学惰性,使得H2能够通过与金属中心产生弱的配位作用,来增强H2在M-MOF-74上的吸附。
