猪伪狂犬病病毒gD和gE蛋白间接ELISA检测方法的建立及联合应用
2022-11-11林东文王宝琴王文秀
林东文, 王宝琴,张 艳,刘 博,王文秀,*
(1.福建省龙岩市新罗区农业农村局,福建 龙岩 364000; 2.滨州学院 生物与环境工程学院, 山东 滨州 256600;3.海南省热带动物繁育与疫病研究重点实验室, 海南 海口 571100; 4.山东省滨州畜牧兽医研究院,山东 滨州 256600)
猪伪狂犬病(pseudorabies,PR)是由猪伪狂犬病毒(pseudorabies virus,PRV)引起的一种急性、热性、败血性传染病[1-2],自2011年以来,PRV变异毒株的流行增加了该病的综合防控难度[3-5],PRV将成为未来一段时间内对我国养猪业健康发展危害最为严重的传染病之一。PRV属疱疹病毒科(Herpesvifidae)α-疱疹病毒亚科(Alpha-herpesvirinae),病毒基因组全长约150 kb,大约编码50余种结构蛋白[6-7]。其中gE基因是病毒复制非必需基因,由gE基因编码的gE蛋白是病毒的非必需糖蛋白,gE基因的缺失并不影响病毒的免疫原性,但可以大大降低病毒的毒力。因此,gE基因成为PRV基因缺失疫苗研究的首选基因[8-11]。gD基因是病毒复制必需基因,该基因编码的gD蛋白不仅在病毒吸附和侵入过程中发挥重要作用,而且也是诱导机体产生中和抗体的必需糖蛋白,gD蛋白成为亚单位疫苗和诊断抗原研究的首选蛋白[12-17]。目前,在PRV预防方面,由于gE基因缺失疫苗免疫的猪群产生gD抗体而不产生gE抗体,而PRV野毒株感染的猪群同时产生gD抗体和gE抗体,我国普遍推广使用PRV gE基因缺失疫苗。因此,同时检测gD抗体和gE抗体即可实现PRV免疫抗体和野毒抗体的鉴别。鉴于此,本研究利用原核表达技术对PRV的gD蛋白和gE蛋白进行了截短表达,分别以表达的重组蛋白作为检测抗原,建立了gD-间接ELISA检测和gE-间接ELISA检测方法,两种检测方法的联合应用将为PRV免疫抗体和野毒抗体的鉴别诊断和PRV净化提供一种技术保障。
1 材料与方法
1.1 病毒、血清、载体
PRV流行毒株由本实验室分离鉴定并保存;PRV阳性血清、PRV疫苗免疫血清、PRV阴性血清、猪繁殖与呼吸综合征病毒(PRRSV)阳性血清、猪瘟病毒(CSFV)阳性血清、猪细小病毒(PPV)阳性血清、猪圆环病毒2型(PCV-2)阳性血清、猪流行性腹泻病毒(PEDV)阳性血清、猪传染性胃肠炎病毒(TGEV)阳性血清、原核表达载体pET-30a(+)均由本实验室保存。
1.2 主要试剂
2×Premix Taq酶、BamH Ⅰ和HindⅢ内切酶、T4 DNA连接酶,均购自TaKaRa公司;DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒,均购自天根生化科技(北京)有限公司;HRP标记兔抗猪IgG,购自Abbkine公司;His标签蛋白纯化试剂盒,购自上海雅吉生物科技有限公司。
1.3 引物设计
根据GenBank中登录的PRV疫苗毒株gD和gE基因序列分别设计1对引物(详见表1);
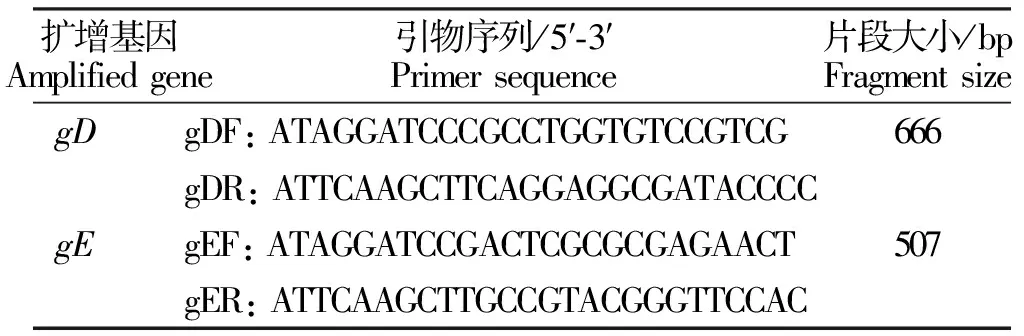
表1 引物序列
1.4gD、gE基因的PCR扩增
利用DNA提取试剂盒提取PRV流行毒株的基因组DNA,分别利用gD基因和gE基因扩增引物对DNA进行gD基因和gE基因的PCR扩增,gD基因和gE基因PCR扩增体系和扩增程序均一致,PCR扩增体系为:20.0 μL 2×Premix Taq、4 μL DNA、上游和下游引物各1.0 μL、14 μL ddH2O。PCR扩增程序为:95 ℃ 5 min;95 ℃ 45 s,58 ℃ 45 s,72 ℃ 60 s,30个循环;72 ℃ 10 min。
1.5 表达载体的构建
将上述PCR扩增产物经胶回收试剂盒回收纯化后,利用BamHⅠ和Hind Ⅲ内切酶分别对gD基因片段、gE基因片段、pET-30a载体进行双酶切。取酶切后的gD基因片段和pET-30a载体片段进行连接,gE基因片段和pET-30a载体片段进行连接,连接产物经过转化、增菌、质粒抽提、BamH Ⅰ和Hind Ⅲ双酶切鉴定后分别构建pET-gD、pET-gE重组质粒,并将构建的pET-gD、pET-gE重组质粒送生工生物工程(上海)股份有限公司进行测序。
1.6 重组蛋白的表达与纯化
将构建的pET-gD、pET-gE重组质粒分别转化BL21(DE3)感受态细胞,利用IPTG对转化产物进行诱导表达后收集pET-gD、pET-gE表达产物,利用His标签蛋白纯化试剂盒对pET-gD、pET-gE表达产物进行纯化。
1.7 重组蛋白的Western blot检测
在SDS-PAGE各泳道内依次加入预染蛋白分子质量标准、重组gD蛋白、重组gE蛋白、预染蛋白分子质量标准、重组gD蛋白、重组gE蛋白,SDS-PAGE结束后将其转印至硝酸纤维素膜,转印结束后将硝酸纤维素膜沿中间剪为大小一致的二部分,将2块硝酸纤维素膜置于同一个平皿中,加入5 %脱脂奶粉后于4 ℃封闭过夜,洗涤后,将2块硝酸纤维素膜分别置于二个不同平皿中,一个平皿加入PRV阳性血清(1∶100稀释),另一个平皿加入PRV疫苗免疫血清(1∶100稀释),将二个平皿同时置于37 ℃孵育1 h,分别洗涤后,将2块硝酸纤维素膜置于同一个平皿中,加入HRP标记兔抗猪IgG(1∶5 000稀释)于37 ℃孵育30 min,洗涤后,将2块硝酸纤维素膜置于二氨基联苯胺缓冲溶液(DAB)中显色。
1.8 间接ELISA反应条件的优化
参照何博等[18]优化间接ELISA反应条件的方法,分别将重组蛋白(gD蛋白和gE蛋白)的不同包被量和一抗不同稀释度、不同封闭液和不同作用时间、酶标二抗不同稀释度和不同作用时间、一抗不同作用时间和底物不同作用时间组成棋盘,采用方阵滴定法确定gD-间接ELISA和gE-间接ELISA的蛋白最佳包被量和一抗最佳稀释度、最佳封闭液和最佳作用时间、酶标二抗最佳稀释度和最佳作用时间、一抗最佳作用时间和底物最佳作用时间。
1.9 间接ELISA临界值的确定
1.10 敏感性试验
利用gD-间接ELISA方法和gE-间接ELISA方法分别对不同稀释倍数的PRV阳性血清进行检测,确定gD-间接ELISA方法和gE-间接ELISA方法的敏感性。
1.11 特异性试验
利用gD-间接ELISA方法和gE-间接ELISA方法分别对PRRSV、CSFV、PPV、PCV-2、PEDV、TGEV阳性血清进行检测,并设立PRV阳性血清、PRV疫苗免疫血清、PRV阴性血清对照,确定gD-间接ELISA方法和gE-间接ELISA方法的特异性。
1.12 重复性试验
1.12.1 批内重复性试验 用同一批抗原包被的ELISA板检测阳性血清和阴性血清各3份,每份血清平行做4孔重复,分别计算变异系数,确定gD-间接ELISA方法和gE-间接ELISA方法的批内重复性。
1.12.2 批间重复性试验 用4批抗原包被的ELISA板检测阳性血清和阴性血清各3份,分别计算变异系数,确定gD-间接ELISA方法和gE-间接ELISA方法的批间重复性。
1.13 临床应用 联合应用gD-间接ELISA方法和gE-间接ELISA方法对采集的2 156份临床猪血清样品进行检测,分析临床血清样品的PRV抗体阳性率、PRV野毒抗体阳性率、PRV免疫抗体阳性率。
2 结果与分析
2.1gD、gE基因PCR扩增
如图1所示,以gD基因、gE基因的扩增引物对PRV流行毒株DNA分别扩增出了大小约为666 bp和507 bp的特异性片段,gD基因和gE基因的扩增片段大小均与试验设计相符。
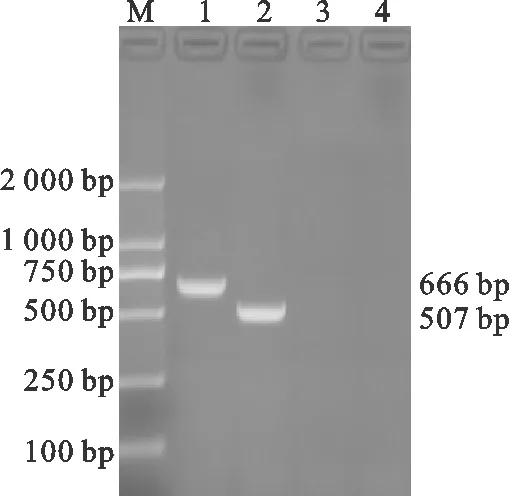
图1 PCR扩增产物鉴定结果
2.2 表达载体的构建
如图2所示,pET-gD、pET-gE重组质粒的BamH Ⅰ和Hind Ⅲ双酶切产物分别约为5 900 bp、666 bp和5 900 bp、507 bp的特异性条带,pET-gD、pET-gE重组质粒的双酶切产物片段大小均与试验设计相符。pET-gD重组质粒和pET-gE重组质粒的测序结果表明插入到表达载体中的gD基因和gE基因阅读框架完全正确。
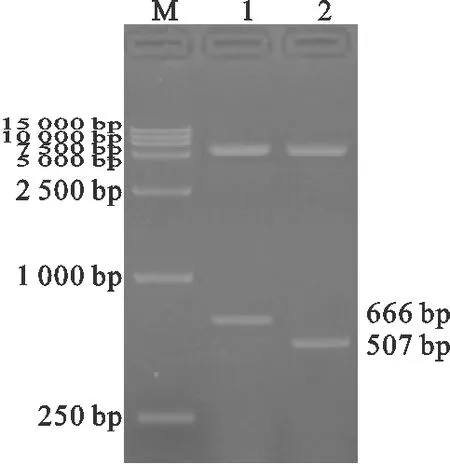
图2 重组质粒双酶切鉴定结果
2.3 重组蛋白的表达与纯化
如图3所示,pET-gD和pET-gE经IPTG诱导均获得了以包涵体形式表达的重组蛋白,重组gD蛋白和重组gE蛋白大小分别约为32 ku和27 ku,其分子质量与试验设计相符。重组gD蛋白和gE蛋白经His标签蛋白纯化试剂盒纯化后均获得了较高纯度的蛋白。
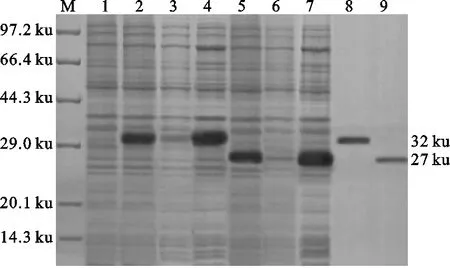
图3 重组蛋白的表达与纯化结果
2.4 重组蛋白的Western blot检测
如图4所示,重组gD蛋白、重组gE蛋白均可与PRV阳性血清发生免疫学反应,重组gD蛋白可与PRV疫苗免疫血清发生免疫学反应,而重组gE蛋白与PRV疫苗免疫血清未发生免疫学反应,重组gD蛋白和重组gE蛋白均表现出了良好的免疫学活性。
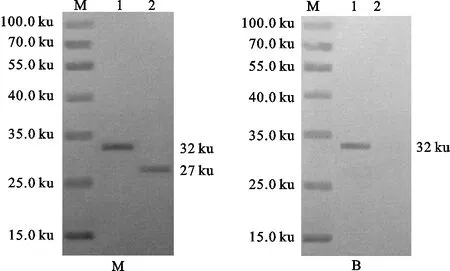
图4 重组蛋白的Western blot检测
2.5 间接ELISA反应条件的优化
经方阵滴定法确定重组gD蛋白和重组gE蛋白的最佳包被量分别为1.35 μg/孔和1.01 μg/孔,一抗最佳稀释度均为1:50,最佳封闭液均为1%BSA,封闭液最佳作用时间均为1 h,酶标二抗最佳稀释度均为1:2 000,酶标二抗最佳作用时间均为30 min,一抗最佳作用时间均为1 h,底物最佳作用时间均为10 min。
2.6 临界值的确定
2.7 敏感性试验
如图5所示,gD-间接ELISA检测1:25 600倍稀释的PRV阳性血清的OD450nm值为0.335,gE-间接ELISA检测1:12 800倍稀释的PRV阳性血清的OD450nm值为0.318,结果均为阳性,gD-间接ELISA和gE-间接ELISA方法检测PRV阳性血清的最低检出效价分别为1:25 600和1:12 800,gD-间接ELISA和gE-间接ELISA方法均具有良好的敏感性。
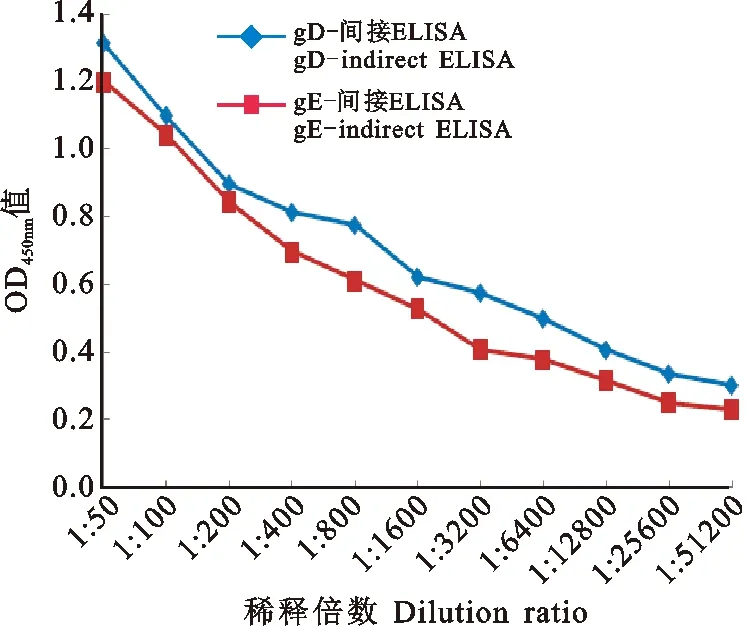
图5 敏感性试验结果
2.8 特异性试验
如表2所示,gD-间接ELISA方法检测PRV阳性血清和PRV疫苗免疫血清为阳性,而检测PRRSV、CSFV、PPV、PCV-2、PEDV、TGEV阳性血清均为阴性;gE-间接ELISA方法检测PRV阳性血清为阳性,而检测PRV疫苗免疫血清和PRRSV、CSFV、PPV、PCV-2、PEDV、TGEV阳性血清均为阴性。表明gD-间接ELISA和gE-间接ELISA方法均具有良好的特异性。
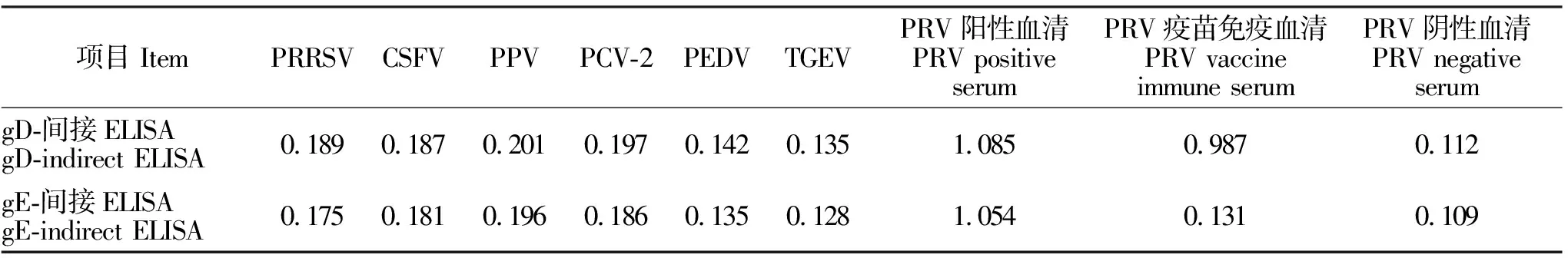
表2 特异性试验的OD450nm值
2.9 重复性试验
如表3所示,gD-间接ELISA方法和gE-间接ELISA方法的批内重复性试验变异系数均小于5%,批间重复性试验的变异系数均小于7%,gD-间接ELISA和gE-间接ELISA方法均具有良好的重复性。
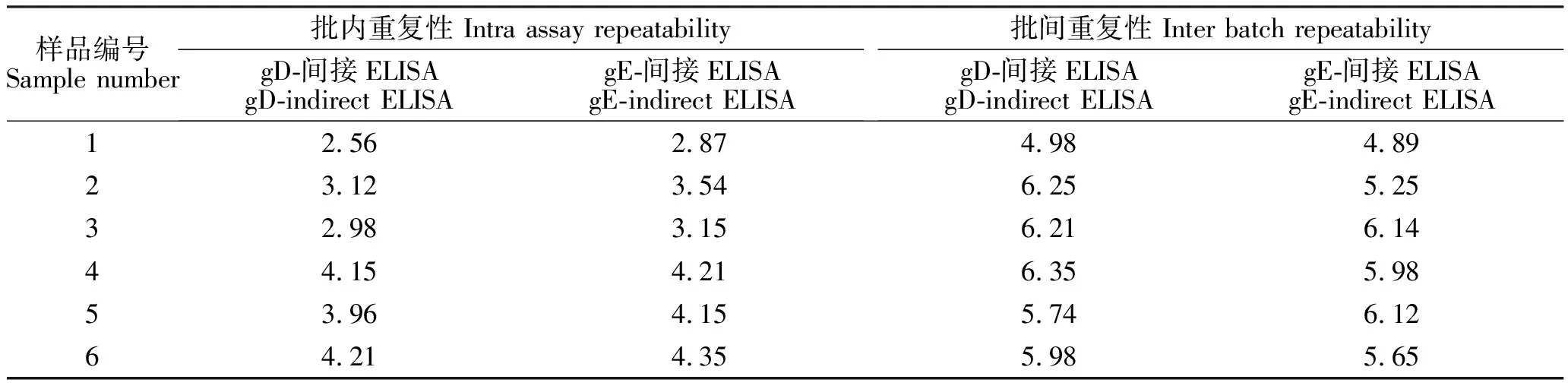
表3 重复性试验的变异系数
2.10 临床应用
如表4所示,联合应用gD-间接ELISA方法和gE-间接ELISA方法对采集的2 156份临床猪血清样品进行检测,gD-间接ELISA方法检测出阳性样品1 918份,gD抗体阳性率为88.96%;gE-间接ELISA方法检测出阳性样品87份,gE抗体阳性率为4.04%。在gD-间接ELISA方法检测为阳性的1 918份血清样品中,共计有87份样品经gE-间接ELISA检测为阳性,即这87份样品的gD抗体并不是PRV疫苗免疫后的免疫抗体,而是由于感染PRV野毒造成的野毒抗体,故2 156份临床猪血清样品的PRV免疫抗体阳性份数应为1 831份,PRV免疫抗体阳性率为84.93%。

表4 临床PRV免疫抗体和野毒抗体检测结果
3 讨 论
为逐步实现我国PRV的净化,在PRV gE基因缺失疫苗推广应用的同时还应加强PRV野毒感染的鉴别诊断并及时淘汰野毒感染猪。因此,建立和推广应用PRV野毒鉴别诊断技术是PRV gE基因缺失疫苗推广应用和实现PRV净化的关键。目前,我国研究学者已经陆续建立了针对PRV gE基因的PCR、荧光定量PCR、LAMP等分子生物学鉴别检测方法[19-21],但PCR、荧光定量PCR、LAMP等检测方法只能特异性的检测PRV病原,病原学检测方法对检测处于发病期的感染猪样品具有明显的优势,由于不同日龄的猪感染PRV后的临床症状存在较大差异[21-22],仔猪和母猪感染PRV后可表现出颤抖、搔痒、呕吐、脑脊髓炎和胎儿流产、弱仔、死仔等明显的临床症状,而育肥猪感染PRV后一般经一过性发热后而耐过,对于康复后的育肥猪不一定能够检测到PRV病原[23-24],同时,应用PCR、荧光定量PCR、LAMP等病原学方法检测育肥猪存在漏检的可能。血清学抗体检测方法通过检测猪群的PRV gE抗体即可实现野毒感染的鉴别诊断,该方法对于检测康复后的育肥猪方面存在明显的优势。在本研究中,利用原核表达技术分别对PRV的gD蛋白和gE蛋白进行了截短表达,获得了均以包涵体形式表达的重组gD蛋白和重组gE蛋白,重组蛋白纯化后经Western blot检测表明重组gD蛋白可与PRV阳性血清、PRV疫苗免疫血清均发生特异性免疫学反应,重组gE蛋白仅与PRV阳性血清发生特异性免疫学反应,而与PRV疫苗免疫血清未发生免疫学反应,重组gD蛋白和重组gE蛋白表现出的良好免疫学活性和特异性为试验后期建立高度敏感、特异的诊断试剂奠定了基础,以纯化的重组gD蛋白和重组gE蛋白作为检测抗原建立了gD-间接ELISA方法和gE-间接ELISA方法,经敏感性试验、特异性试验、重复性试验以及临床应用显示gD-间接ELISA方法和gE-间接ELISA方法均具有良好的敏感性、特异性、重复性以及临床适用性。通过gD-间接ELISA方法可以掌握猪群的整体抗体水平,gD-间接ELISA方法检测结果为阳性的样品数,即为猪群的PRV整体抗体阳性率。通过gE-间接ELISA方法可以掌握猪群的PRV野毒抗体水平,gE-间接ELISA方法检测结果为阳性的样品数,即为猪群的PRV野毒感染的抗体阳性率。通过gD-间接ELISA方法和gE-间接ELISA方法检测结果中的阳性样品数差值可以掌握猪群的PRV疫苗免疫抗体水平,gD-间接ELISA方法检测结果为阳性而gE-间接ELISA方法检测结果为阴性的样品数,即为猪群的PRV疫苗免疫的免疫抗体阳性率。gD-间接ELISA方法和gE-间接ELISA方法的联合应用不仅可以评价疫苗免疫后的抗体水平,而且可以实现PRV野毒感染的鉴别检测。总之,本研究中建立的gD-间接ELISA方法和gE-间接ELISA方法及两种方法的联合应用实现了PRV免疫抗体和野毒抗体的鉴别检测,对提高我国基层兽医实验室的PRV鉴别检测水平和推进我国PRV净化进程均具有十分重要的现实意义。
