柴胡属饮片中藏柴胡掺伪检测方法研究
2022-11-11赵丹彤高一军毕天琛王素香郑兆显林永强
赵丹彤,高一军,毕天琛,王素香,郑兆显*,林永强
(1.菏泽市食品药品检验检测研究院,山东 菏泽 274000;2.菏泽市立医院,山东 菏泽 274031;3.山东省食品药品检验研究院/山东省中药标准创新与质量评价工程实验室,山东 济南 250101)
柴胡始载于《神农本草经》,列为上品,至《本草图经》改名为柴胡,其性寒,味微苦,归肝、胆经,具有疏散退热、疏肝解郁之功效,主要用于感冒发热、寒热往来等疾病[1-3]。《中国药典》2020年版(一部)收载柴胡为伞形科植物柴胡(BupleurumchinenseDC.)或狭叶柴胡(BupleurumscorzonerifoliumWilld.)的干燥根,分别习称“北柴胡”和 “南柴胡”[1]。我国柴胡属植物种类较多,分布广泛,目前《中国植物志》记载有42种、17变种、7 变型[4-5]。市售柴胡药材品种繁多,各省炮制规范中收录有竹叶柴胡[6]、红柴胡[7]等多个品种。因需求量较大且野生柴胡资源匮乏,目前药用柴胡主要以栽培种植为主。由于柴胡属植物的性状较为接近,部分栽培品主要性状特征不明显,在采集和使用时难以鉴别,以致长期以来多种混伪品与正品柴胡混淆用药的现象较为普遍。
藏柴胡为伞形科植物窄竹叶柴胡[BupleurummarginatumWall.ex DC.var.stenophyllum(Wolff.)Shan et Y.Li]的干燥根,为贵州等地方标准收载品种,主产于我国西南、甘肃等地区[8-9]。因其柴胡皂苷含量和产量显著高于其他品种柴胡,且价格较低,目前市场上存在藏柴胡掺伪或混入其他柴胡属饮片销售、使用的情况[10]。由于藏柴胡与北柴胡等品种性状相似,化学成分基本一致,常规薄层色谱法、液相色谱法等无法进行有效区分[11-14],且目前藏柴胡掺伪量也无准确计算方法。因此,本研究以Nepasaikosaponin K差异标志物为指标,采用高效液相色谱-串联质谱技术(HPLC-MS/MS)技术,建立柴胡属饮片中藏柴胡掺伪检测方法,为柴胡属饮片质量评价与监管提供有力的技术保障,同时为中药掺伪检测技术研究提供新的思路与方法。
1 仪器与材料
1.1 仪器 1260-6460高效液相色谱-三重四极杆质谱联用仪,ESI离子源(美国Agilent 公司);XPR2型百万分之一分析天平、AB104-S型万分之一分析天平(瑞士Mettler Toledo公司);FRQ-1010T型超声波清洗器(杭州法兰特超声波科技有限公司);FSJ-A05N6型粉碎机(小熊电器股份有限公司)。
1.2 材料 Nepasaikosaponin K对照品(CAS:405229-61-0,批号:DSTAC019202,纯度≥98%)购自成都乐美天医药科技有限公司;甲醇、乙腈、甲酸均为色谱纯;氨水为分析纯;水为超纯水。
21批柴胡属饮片样品信息见表1,其中S1~S21均经菏泽市食品药品检验检测研究院沙启营主任中药师鉴定为正品,S22~S24鉴定为藏柴胡掺伪北柴胡样品。

表1 柴胡属饮片样品信息
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液的制备 精密称取Nepasaikosaponin K对照品5 mg,置10 mL量瓶中,以甲醇溶解并稀释至刻度,即得对照品储备液。取对照品储备液适量于量瓶中,加甲醇稀释至刻度,分别制成每1 mL含Nepasaikosaponin K 0.1、0.2、0.5、1.0、2.5、5.0、10.0、25.0、75.0 μg的系列工作对照品溶液。
2.1.2 供试品溶液制备 取柴胡属饮片粉末(过四号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入含5%浓氨试液的甲醇溶液25 mL,密塞,称定重量,30 ℃水温超声处理(功率500 W,频率40 kHz)30 min,取出,放冷,再称定重量,用含5%浓氨试液的甲醇溶液补足减失的重量,摇匀,用0.22 μm微孔滤膜滤过,即得。
2.2 检测条件
2.2.1 色谱条件 色谱柱:Waters ACQUITY UPLC HSS T3 色谱柱(2.1 mm ×100 mm,1.8 μm);柱温40 ℃;流速0.25 mL·min-1;进样量5 μL;以0.1%甲酸水溶液(A)-乙腈(含0.1%甲酸)(B)为流动相,梯度洗脱程序:0→2 min,70% A;2→5 min,70% A→55% A;5→8 min,55% A;8→9 min,55% A→70% A;9→10 min,70% A。
2.2.2 质谱条件 采用质谱检测器,电喷雾负离子(ESI-)进行多反应监测(MRM),选择m/z 943.6→635.5、m/z 943.6→781.5、m/z 943.6→797.4为检测离子对进行检测。干燥气温度:300 ℃;雾化器压力:20 Psi;干燥气流速:10 L·min-1;鞘流气温度:350 ℃;鞘流气流速:10 L·min-1;毛细管电压:3 500 V。检测离子对质谱参数见表2。Nepasaikosaponin K的 HPLC-MS/MS一级、二级质谱图见图1。Nepasaikosaponin K对照品、各柴胡属饮片及藏柴胡掺伪饮片的总离子流图和选择离子对色谱图见图2。

图1 Nepasaikosaponin K的一级质谱图(A)及二级质谱图(B)
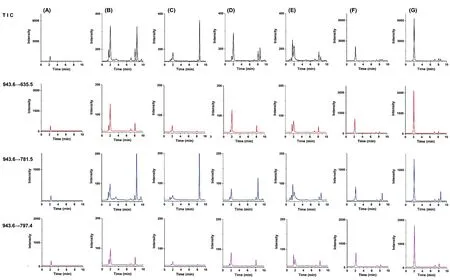
A.Nepasaikosaponin K对照品;B.北柴胡;C.南柴胡;D.竹叶柴胡;E.锥叶柴胡;F.掺伪50%藏柴胡的北柴胡;G.藏柴胡
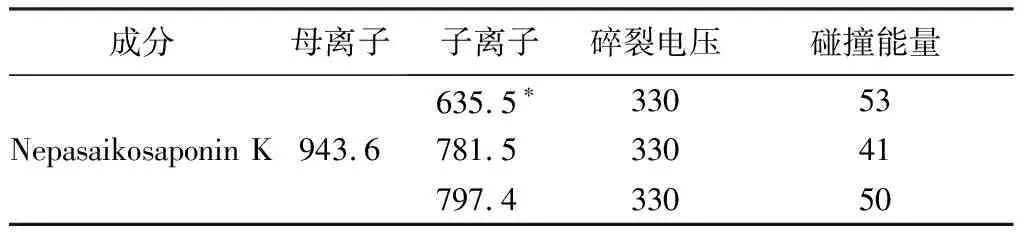
表2 检测离子对质谱参数
取“2.1.1”项下1.0 μg·mL-1工作对照品溶液,进样量为5 μL,Nepasaikosaponin K的色谱峰(m/z 943.6→635.5)信噪比应大于10∶1。
2.3 方法学考察
2.3.1 线性关系考察 分别取系列工作对照品溶液5 μL,按“2.2”项下检测条件进行测定。以对照品浓度(μg·mL-1)为横坐标(X),特征定量离子对943.6→635.5峰面积为纵坐标(Y),绘制标准曲线,计算回归方程为Y=3 113.2X+19.084,R2=0.998 6。表明Nepasaikosaponin K质量浓度在0.1 μg·mL-1~75.0 μg·mL-1的范围内线性关系良好。
2.3.2 精密度试验 取“2.1.1”项下1.0 μg·mL-1工作对照品溶液,按“2.2”项下检测条件连续进样6次,记录峰面积。结果表明Nepasaikosaponin K特征定量离子对943.6→635.5峰面积的RSD值为1.5%,表明本方法精密度良好。
2.3.3 重复性试验 精密称取同一批藏柴胡饮片6份(编号:S14),按“2.1.2”项下方法制备供试品溶液,按“2.2”项下检测条件进行测定,记录峰面积,计算得到Nepasaikosaponin K的平均含量为483.1 μg·g-1,RSD值为1.9%,表明本方法重复性良好。
2.3.4 稳定性试验 取同一藏柴胡饮片供试品溶液,按“2.2”项下检测条件分别于0、2、4、6、8、10、12、24 h进行测定,记录峰面积,结果表明Nepasaikosaponin K特征定量离子对943.6→635.5峰面积的RSD值为1.7%,表明供试品溶液在24 h内稳定性良好。
2.3.5 加样回收率试验 精密称取已知Nepasaikosaponin K含量的北柴胡饮片供试品9份,每份约0.5 g,分别加入工作对照品溶液,按“2.1.2”项下方法制备供试品溶液,按“2.2”项下检测条件进行测定,记录峰面积,计算加样回收率及RSD值,结果见表3,表明方法的准确度良好。

表3 北柴胡饮片中Nepasaikosaponin K加样回收率试验结果
2.3.6 检测限与定量限考察 取北柴胡饮片供试品溶液(编号:S3,Nepasaikosaponin K含量为16.56 μg·g-1),适当稀释后按“2.2”项下检测条件进行测定,结果表明含量水平为0.55 μg·g-1时Nepasaikosaponin K定量、定性离子信噪比均大于3,含量水平为1.66 μg·g-1时Nepasaikosaponin K定量离子信噪比均大于10。综合考虑样品基质效应,拟定柴胡属饮片中Nepasaikosaponin K的检测限为0.6 μg·g-1,定量限为1.7 μg·g-1。
2.4 Nepasaikosaponin K在柴胡属饮片中分布情况 分别取各柴胡属饮片,照“2.1.2”项下方法制备供试品溶液,按“2.2”项下检测条件进行测定,记录峰面积并按外标法计算样品中Nepasaikosaponin K的含量,每个样品平行测定3次,结果见表4。
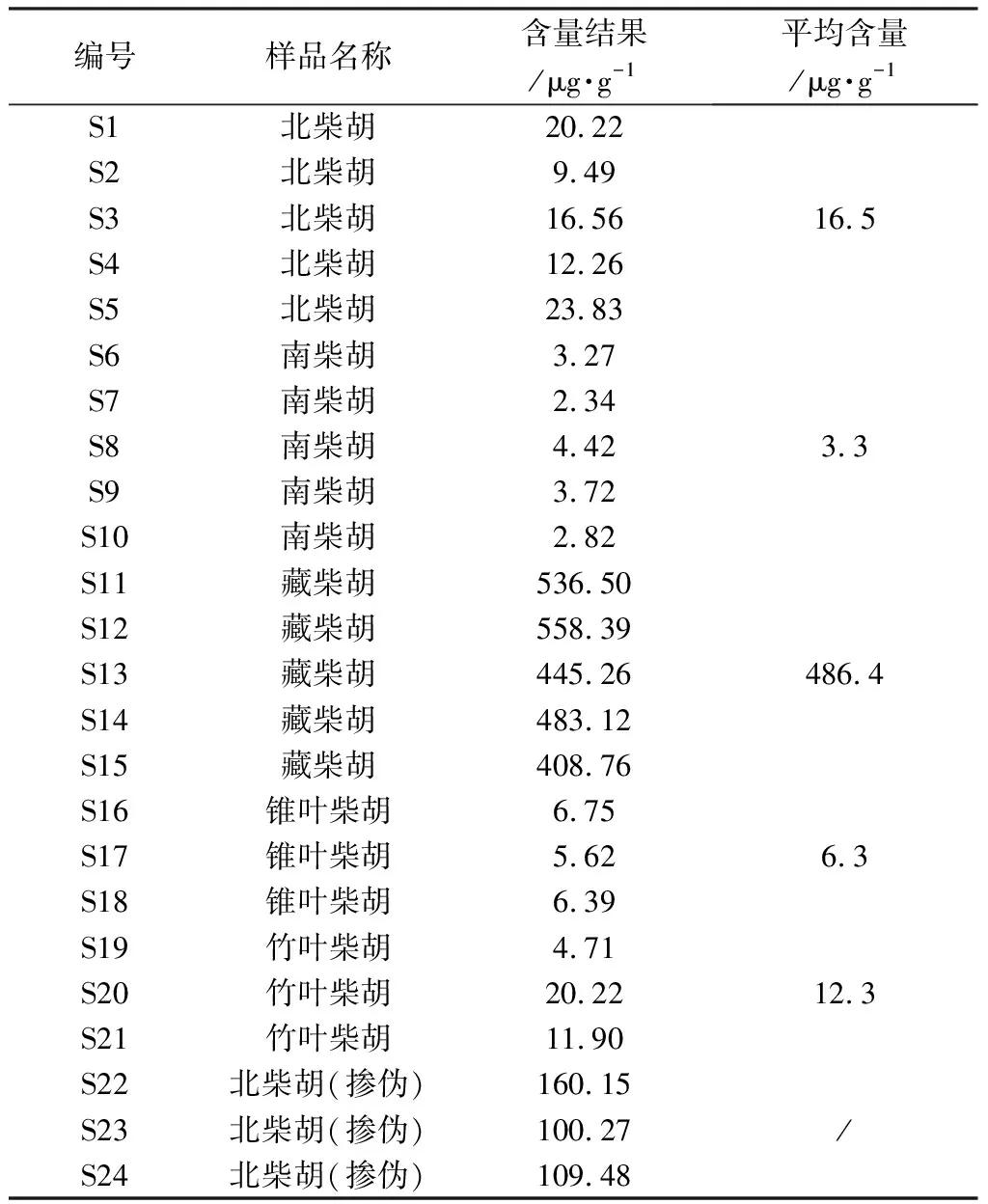
表4 柴胡属饮片样品Nepasaikosaponin K含量测定结果(n=3)
2.5 藏柴胡掺伪柴胡属饮片检测方法研究
2.5.1 藏柴胡掺伪柴胡属饮片检测方法线性关系考察 以北柴胡为例,将藏柴胡与同一份北柴胡样品按比例混合,制成藏柴胡掺伪比例为0%、5%、10%、20%、40%、50%、70%、90%、100%的混合样品9份,照“2.1.2”方法制备,照“2.2”项下检测条件进行测定,以供试品溶液 m/z 943.6→635.5的提取离子流中Nepasaikosaponin K的色谱峰峰面积为纵坐标,藏柴胡掺伪北柴胡饮片的比例为横坐标,绘制标准曲线。试验结果表明,两者呈良好的线性关系,线性回归方程为:Y=28 681X+2 246.7,r=0.992;说明该方法在藏柴胡掺伪北柴胡饮片比例0~100%范围内,可对北柴胡饮片中藏柴胡掺伪量进行定量检测。
2.5.2 柴胡属饮片藏柴胡掺伪比例测定方法研究 取各柴胡属饮片,分别加入一定量藏柴胡饮片,制成藏柴胡掺伪比例为5%、20%、50%的混合样品,照“2.1.2”项下方法制备供试品溶液,按“2.2”项下检测条件进行测定,记录峰面积并按外标法计算混合样品中Nepasaikosaponin K的含量,照公式(1)计算藏柴胡掺伪比例。由表5结果可知,各柴胡属饮片实际掺伪量与计算掺伪量平均偏差在0.6%~1.4%之间,说明该方法能准确测定柴胡属饮片中藏柴胡掺伪比例。

表5 柴胡属饮片实际掺伪量与计算掺伪量测定结果
公式(1)
其中P掺%为藏柴胡掺伪比例(%);CSSK混为藏柴胡掺伪柴胡属饮片混合样品中Nepasaikosaponin K的含量(μg·g-1);CSSK藏为藏柴胡样品中Nepasaikosaponin K的含量(μg·g-1);CSSK样为各柴胡属饮片样品中Nepasaikosaponin K的含量(μg·g-1)。
2.5.3 市售北柴胡饮片中藏柴胡掺伪比例测定 取市售疑似掺伪藏柴胡的北柴胡饮片,采用《中国药典》2020年版(四部)< 0211 药材和饮片取样法 >中四分法取样,并根据性状鉴别特征分别挑选出少许北柴胡、藏柴胡,照“2.1.2”项下方法分别制备供试品溶液、藏柴胡供试品溶液及北柴胡供试品溶液,按“2.2”项下检测条件进行测定,记录峰面积并按外标法计算混合样品中Nepasaikosaponin K的含量,照公式(1)计算藏柴胡掺伪比例,结果见表6。

表6 市售疑似掺伪藏柴胡的北柴胡饮片掺伪比例测定结果(n=3)
2.6 北柴胡饮片中藏柴胡掺伪拟定限度研究 根据市场调研及数据分析,参照《中国药典》2020年版(四部)<0212 药材和饮片检定通则>所述杂质通常不得过3%的限度,同时考虑柴胡存在交叉种植、种质多样及性状易混淆的可能,拟定北柴胡饮片中藏柴胡掺伪限度为5%。
取北柴胡饮片样品5批次,分别加入一定量藏柴胡饮片,制成藏柴胡掺伪比例为5%的混合样品,照“2.1.2”项下方法制备供试品溶液,按“2.2”项下检测条件进行测定,记录m/z 943.6→635.5峰面积。结果如表7所示,按外标法计算混合样品中Nepasaikosaponin K的平均含量为1.04 μg·mL-1。因此,本研究拟定Nepasaikosaponin K对照品溶液的限度为1 μg·mL-1。当北柴胡饮片供试品溶液的提取离子流色谱中,同时检出与对照品溶液一致的特征离子对m/z 943.6 →635.5、m/z 943.6→797.4、m/z 943.5→781.5对应的色谱峰,且供试品色谱中943.6→635.5的色谱峰面积值大于1 μg·mL-1对照品溶液中相应的峰面积值时,视为北柴胡饮片中人为掺伪藏柴胡。

表7 不同批次藏柴胡掺伪北柴胡饮片Nepasaikosaponin K含量检测结果(n=3)
3 讨论
3.1 检测条件优化
3.1.1 检测目标物与方法选择 柴胡皂苷为柴胡属药材主要活性成分之一,目前多采用液相色谱法对柴胡中环氧醚型(柴胡皂苷a、c、d)和异环双烯型(柴胡皂苷b1、b2)等成分进行检测[12,15];而其他柴胡皂苷成分研究较少,现有方法存在灵敏度低、各皂苷成分相互干扰的缺陷。Nepasaikosaponin K在北柴胡、南柴胡等品种中含量较低,而在藏柴胡中含量较高,有利于提高掺伪后目标成分检测的灵敏度;但该皂苷又与多种皂苷结构相似,液相分离难度较大,故采用液质联用法进行检测,以提高灵敏度,满足柴胡属饮片中藏柴胡掺伪检测方法准确度要求。
3.1.2 供试品溶液制备条件选择 以含浓氨试液的甲醇溶液为提取溶剂,考察超声时间(30、45、60 min)、溶剂体积(25、50、75 mL)及浓氨浓度(2%、5%、10%)对供试品溶液中定量特征离子对m/z 943.6→635.5色谱峰峰面积的影响。结果表明,兼顾时间及试剂成本,以含5%浓氨试液的甲醇溶液25 mL为提取溶剂、超声处理30 min为最优方案。
3.1.3 色谱检测条件筛选 分别考察水、甲醇、乙腈、甲(乙)酸等不同比例的流动相体系的分离效果。结果表明,以甲醇为有机相时,基线噪音较大,响应值偏低,且分离度不符合要求,采用乙腈为有机相可显著改善上述问题。为改善待测组分色谱峰的峰形,尝试在流动相中加入一定量的酸,当流动相为含0.1%甲酸的乙腈-0.1%甲酸水溶液时,目标组分定性、定量离子对峰型良好,与其他组分分离效率高。最终确定以含 0.1%甲酸的乙腈-0.1%甲酸溶液为流动相,并对其进行优化,建立梯度洗脱程序。
考察了不同柱温(30、35、40 ℃)对供试品溶液中特征离子对m/z 943.6→635.5峰面积及分离度的影响,结果表明随柱温升高,目标峰面积及分离度均结果满意,故采用40 ℃柱温进行测定。
3.1.4 质谱条件筛选 分别考察了电喷雾正、负离子模式下对照品溶液和供试品溶液中目标色谱峰检出情况,结果表明,采用负离子模式可检出Nepasaikosaponin K的分子离子峰[M-H]-943.6、氯离子加合峰[M + Cl]-979.7和羧基加合峰[M + HCOO]-989.6,其中分子离子峰[M-H]-943.6 丰度最高(见图1);正离子模式未检测出Nepasaikosaponin K色谱峰。
选取丰度最高的分子离子峰[M-H]-943.6为母离子,筛选目标子离子,结果表明,主要碎片离子为[M-H-Glu]-781.5、[M-H-Rha]-797.4、[M-H-Glu-Rha]-635.5,裂解途径见图3。分别检测对照品和供试品溶液中m/z 943.6→635.5、m/z 943.6→781.5、m/z 943.6→797.4特征离子对色谱峰,结果表明,三对特征离子均能检出,其中943.6→635.5峰面积最大,信噪比高,分离度好;故本研究选择m/z 943.6→635.5、943.6→781.5、943.6→797.4为Nepasaikosaponin K的定性检测离子对,m/z 943.6→635.5为定量检测离子对。

图3 Nepasaikosaponin K化学结构式及碎裂方式示意图
3.2 Nepasaikosaponin K在柴胡属饮片中分布情况分析 本研究对北柴胡、南柴胡、藏柴胡、锥叶柴胡、竹叶柴胡等5种市售常见柴胡属饮片中Nepasaikosaponin K含量测定。结果如表4所示,Nepasaikosaponin K虽然在上述5种柴胡中均存在,但藏柴胡与其他4种柴胡之间含量具有显著性差异;其中藏柴胡含量平均值为486.4 μg·g-1,而在北柴胡、南柴胡、锥叶柴胡、竹叶柴胡中的含量平均值均在20 μg·g-1以下;藏柴胡中Nepasaikosaponin K含量约为其他种柴胡的25~140倍。因此,Nepasaikosaponin K可作为区别藏柴胡和其他种柴胡的差异标志物。
3.3 柴胡属饮片藏柴胡掺伪比例测定方法探讨 结果表明,藏柴胡掺伪比例在0%~100%范围内的混合样品中,Nepasaikosaponin K定量离子对m/z 943.6→635.5色谱峰峰面积与掺伪比例之间的线性关系良好。同时,本研究建立了藏柴胡掺伪比例计算公式,结果表明,不同柴胡属模拟掺伪样品的计算掺伪量与实际掺伪量的平均偏差在0.6%~1.4%之间,说明本研究建立的方法可实现对藏柴胡掺伪量的定量检测,同时也为掺伪分析提供了新的思路。
3.4 市售柴胡属饮片中藏柴胡掺伪情况分析及拟定限度研究 因藏柴胡性状与北柴胡较为接近,且北柴胡市场需求量较大,目前藏柴胡多掺入或混充北柴胡使用。本次采集的疑似掺伪柴胡属样品均为北柴胡中掺杂部分藏柴胡,经测定,市售3批疑似掺伪样品掺伪比例为14%~27%。
结合市场调研情况,其他种柴胡饮片中混有低于5%的藏柴胡可认定为非故意掺伪;且多种柴胡属饮片中均含有微量的Nepasaikosaponin K,质谱可检出,故本次研究以掺入5%藏柴胡的北柴胡模拟样品的含量限度作为拟定限度。
综上所述,本研究建立了以Nepasaikosaponin K为指标的柴胡属饮片中藏柴胡掺伪检测方法,该方法采用HPLC-MS/MS技术,可对北柴胡、南柴胡、藏柴胡、锥叶柴胡、竹叶柴胡等5种市售常见柴胡属饮片中Nepasaikosaponin K进行定量检测,操作简便、专属性强、准确度高。同时,采用该检测方法,建立了柴胡属饮片中藏柴胡掺伪比例计算公式,并以Nepasaikosaponin K为指标,开展了藏柴胡掺伪限度研究。本研究可用于柴胡属饮片质量评价及真伪筛查,为柴胡质量监管提供了有力的技术支撑,同时也为中药掺伪检测技术研究提供新的思路与方法。
