催化臭氧氧化用于降解水中抗生素污染物研究进展
2022-11-10巩合松潘顺龙
巩合松,胡 昊,潘顺龙,*
(1.赣榆区综合检验检测中心,江苏连云港 222100;2.南京工业大学环境科学与工程学院,江苏南京 211816)
随着制药工业的发展,产生了大量药物污染物,特别是抗生素,已广泛用于治疗人类和动物疾病以及水产养殖和牲畜饲养[1]。2000年—2015年,全球抗生素消费量增长了65%,抗生素消费率增长了39%[2]。随着养殖业的迅速发展导致兽用抗生素的使用也逐年增加,兽用抗生素消耗量几乎是人类消耗量的3倍[3]。然而,抗生素无法被肠道完全吸收或代谢,常作为母体化合物或活性代谢产物的形式排泄出体外。
目前常规污水处理厂的废水处理工艺去除药物污染物效果不佳,吸附法在多次操作周期后,吸附容量逐渐减少,而且在废水处理后需要进一步处理废弃吸附剂[4]。膜法投资和运行成本高,对于高浓度污染物,为了避免结垢常需要投加阻垢剂,产生的膜浓缩液需要额外处理[5-6]。生物处理法去除抗生素时,抗生素的去除效率相对较低,甚至有助于选择性地增加微生物抗生素耐药性和抗生素耐药性细菌(ARBs)[7-8],使得在各种自然环境中频繁检测出抗生素[9],可能使得抗生素抗性基因(ARGs)和ARBs在自然环境中不断产生和积累。因此,生物法处理抗生素废水会增加传播抗生素耐药性的风险,直接危害人类的健康,并对生态系统造成威胁[10-11]。因此,找到一种有效的方法来去除废水中的抗生素是近年来研究的热点。
在近几年,高级氧化工艺(AOPs)已被广泛研究,可有效去除水和废水中的抗生素和其他有毒有机污染物,被认为是最有效的非选择性化学氧化技术之一[12-13]。在不同的AOPs中,芬顿氧化会产生大量含铁污泥[14];电化学氧化处理低浓度污染物具有处理效率较低、能量消耗较高等缺点[15];光催化剂易失活、光源利用率低[16]。由于近年来臭氧生产的成本大大降低且不产生危险废弃物(如芬顿工艺的含铁污泥),臭氧氧化受到越来越多的关注[17]。在臭氧氧化中,催化剂的加入可以改善臭氧的分解,以产生高活性的自由基,促进有机物的有效矿化[18]。各种金属、金属氧化物、活性炭和矿物被用作催化剂,以提高污染物的去除效率。此外,催化剂的加入进一步提高了臭氧利用的效率。本文阐述了催化臭氧氧化工艺氧化抗生素污染物的基本原理、催化剂类型和影响因素,总结了催化臭氧化去除抗生素的前景。
1 催化臭氧氧化
臭氧是一种强氧化剂,氧化还原电位为2.07 V,能氧化和分解废水处理中的有机污染物。臭氧对有机物的氧化途径主要是臭氧直接氧化污染物和臭氧催化产生的·OH间接氧化污染物[19]。然而,单靠臭氧化通常不足以完全矿化有机污染物,因为臭氧在攻击某些有机化合物方面具有选择性,有时还会产生有毒中间体[18]。与其他基于臭氧的处理方法相比,催化臭氧氧化不需要其他能源成本(如紫外线),适用的pH范围广,可以降低调节pH成本,进而降低运营成本。与单独臭氧化相比,催化臭氧氧化向反应体系投加催化剂,通过提高臭氧的分解速率,产生非选择性和更具氧化性的·OH。研究[20]表明,在催化臭氧氧化过程中使用过渡金属和金属氧化物能更有效地降解有机污染物。
1.1 均相催化臭氧氧化
均相催化臭氧氧化的催化剂常常采用可溶性过渡金属类化合物,如Co(Ⅱ)、Mn(Ⅱ)、Cu(Ⅱ)、Fe(Ⅱ)、Zn(Ⅱ)、Al(Ⅲ)和Ni(Ⅱ)等[21]。主要原因是过渡金属含有未充满的价层d轨道,容易进行电子转移,同时氧化还原能力较强[22]。均相臭氧催化氧化的机理可以分为·OH理论和络合物理论[23]。·OH理论是臭氧在金属离子催化分解产生·OH,络合物理论是有机污染物和金属离子与形成络合物,然而与臭氧直接反应。

然而,添加过渡金属离子会导致二次污染物的产生,而且金属离子浓度很低,常规方法不易分离回收。因此,使用均相催化臭氧氧化处理实际废水受到了限制。非均相催化剂在长时间保持化学稳定性的同时,易于分离且可以长时间保持催化活性,非均相催化臭氧氧化(heterogeneous catalytic ozonation process,HCOP)具有比均相臭氧氧化更多的优势。
1.2 HCOP
HCOP通过向臭氧氧化体系引入非均相催化剂,一方面提高臭氧溶解度,另一方面促进臭氧分解产生活性氧物质(reactive oxygen species,ROS)进而高效利用臭氧[23]。HCOP是固-液-气三相的多相反应,臭氧具有强Lewis碱的性质,主要通过物理吸附吸附在催化剂表面活性位点,也可通过臭氧与催化剂表面的Lewis酸位点结合进行化学吸附。非均相催化剂分为金属型催化剂、复合型催化剂和非金属型催化剂。高比表面积和多活性位点对于非均相催化剂至关重要,活性位点通常包括过渡金属(Fe、Al、Mn、Cu、Co等)位点、氧空位(晶格缺陷)、Lewis酸位点、含氧基团(表面羟基、羰基、酮基)等活性位点[24]。抗生素是弱极性分子,为了提高降解抗生素效果,一般为了强化催化剂吸附作用,还会具备疏水基团。HCOP的优点有:(1)固态催化剂可以回收利用,同时稳定性更高;(2)在催化剂表面进行持续反应,无需连续供应试剂;(3)适合大规模处理废水;(4)没有二次污染的产生;(5)能矿化大多数污染物。
2 催化剂类型
非均相催化剂的催化性能高度依赖于材料的理化性质。在本节中,根据催化剂材料对用于催化臭氧氧化的各种纳米催化剂进行了分类和介绍。同时,对污染物的去除及其基本机制进行了总结和讨论。
2.1 金属型催化剂
2.1.1 金属型催化剂
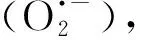
综上,与催化臭氧氧化相关的纳米金属催化剂研究相对较少。现有的研究,如NZVI的臭氧研究,尚未对催化机理进行深入研究。例如,与传统的具有非纳米尺寸的铁和铁氧化物的催化臭氧氧化相比,催化过程是否涉及·OH以外的其他ROS。因此,可能需要更详细和进一步的研究。
2.1.2 金属氧化物催化剂
金属氧化物催化剂中,最常用的金属氧化物是多金属/双金属氧化物、氧化镁、氧化铁、氧化铝和氢氧化物[27]。Wang等[28]提出使用金属氧化物催化臭氧氧化的机理,如式(1)~式(5)。例如,MgO、Mg(OH)2和Al2O3。
(1)
(2)
(3)
(4)
(5)
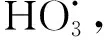
MgO因其结构稳定性、环境友好性、低毒性和催化性能而被广泛报道为催化臭氧氧化的催化剂。类似于Al2O3,在ZnO和MgO中通常只存在一种稳定的价态,在催化臭氧氧化作用下具有相对稳定的结构性质。MgO催化臭氧机理一般为表面羟基催化臭氧分解产生·OH。Kermani等[29]研究了在去离子水中以MgO为催化剂的HCOP去除甲硝唑(MNZ)的效率,并与单臭氧化工艺(single ozonation process,SOP)进行了比较。结果表明,与SOP相比,MgO加速了MNZ的去除。SOP和HCOP的最佳pH值为10时,HCOP的最佳MgO剂量确定为0.25 g/L。在最佳条件下,20 min和35 min后,HCOP和SOP分别完全去除40 mg/L MNZ溶液。HCOP显著提高了生物需氧量/化学需氧量(从0.09升至0.43),MNZ矿化率为93.5%,降低了MNZ的毒性。Zhu等[30]采用均质沉淀法制备了MgO,并用于喹啉的降解。结果表明,MgO的存在显著改善了喹啉的降解和矿化,MgO显著增强臭氧分解成·OH。表面羟基是MgO的主要活性位点,因此,pH被广泛报道为影响MgO催化能力的重要因素。Yin等[31]在常压下不使用任何催化剂,在温度为400 ℃下热分解草酸锌,成功合成了自组装ZnO纳米束,以2-乙氧基乙酸乙酯(2-EEA)为模型有机污染物。结果表明,臭氧化过程中ZnO纳米束的存在,进一步提高2-EEA 39.7%降解率和9.5%的TOC去除率。臭氧不是2-EEA直接氧化的主要氧化剂,催化臭氧氧化过程中产生的·OH加速对2-EEA的分解。Al2O3作为常见的催化剂载体也可以催化臭氧氧化,Sani等[32]研究了γ-Al2O3催化臭氧氧化环丙沙星在真实废水的应用。研究结果表明,在pH值为5.25时,催化臭氧氧化过程的降解率较低;在pH值为9.5的条件下催化剂表现最高的降解率,催化臭氧氧化体系环丙沙星的去除率可达93%。
尽管MgO、ZnO和γ-Al2O3对不同污染物表现出优异的催化能力,但这些催化剂仍存在一些问题。首先,颗粒团聚引起的催化效率下降严重。Zhu等[30]5次循环试验后发现喹啉的降解从100%下降到93.45%,MgO催化剂平均大小从17.1 nm变为36.9 nm。其次,金属氧化物催化剂常见的分离方法是离心,仅在实验室研究中采用,不能应用于实际的废水处理。
除锌和镁的氧化物外,其他金属氧化物,例如Fe3O4、Mn-Ce-O也广泛用于催化臭氧氧化。不同于MgO和ZnO。Ma+/Mb+(a 除了颗粒团聚、分离和回收外,过渡金属氧化物催化剂的另一个问题是金属离子氧化而导致的催化能力下降[33]。此外,除非还原金属离子,否则这种失活是不可逆的。同时,特别是对于纳米大小的金属氧化物的浸出,如氧化锰,也是不可避免的。 2.1.3 金属矿物催化剂 尖晶石催化剂和钙钛矿催化剂是常见的金属矿物催化剂。尖晶石具有优良的导电性能,结构通式为 AB2O4(A为二价阳离子,B为三价阳离子)。常见的尖晶石材料中,A通常为Zn(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)、Cu(Ⅱ)、Co(Ⅱ)等过渡金属离子,B以Fe(Ⅲ)、Mn(Ⅲ)、Ti(Ⅲ)、Cr(Ⅲ)等离子为主[34]。尖晶石铁氧体表面具有丰富的羟基基团,同时相比其他金属氧化物催化剂具有更多的晶格缺陷和活性位点,有利于臭氧的吸附和催化。在众多金属离子中,铁离子与A位二价金属离子能形成较强的金属价键,提高了其结构和性能的稳定性,能够有效减少二价金属元素的溶出。此外,铁元素本身还具有磁性,方便催化剂的回收[35]。因此,以过渡金属离子为A位的尖晶石铁氧体(AFe2O4)成为非均相催化领域内重点关注的一种催化剂材料。 虽然尖晶石催化剂和钙钛矿催化剂具有非常好的催化活性,但仍存在不容忽视的问题。例如,合成相对复杂、离子的溶出、阳离子组分在臭氧化过程中被氧化,导致催化效率降低,这都限制了尖晶石催化剂和钙钛矿催化剂在实际应用中的发展。 金属基纳米催化剂通常遭受金属浸出,这通常会导致二次金属离子污染和催化剂失活。因此,使用无金属纳米催化剂、碳纳米管(CNT)、氧化石墨烯(GO)和还原氧化石墨烯(RGO),近年来受到越来越多的关注。 虽然RGO和CNT都表现出优异的催化效率,但它们在实际应用中也面临着同样严重的问题,除了分离和回收之外,化学稳定性和耐臭氧性并不是很稳定。随着臭氧化过程中活性位点的氧化失活,催化能力的降低以及催化臭氧氧化的降低是不可避免的。然而,大多数研究对碳纳米催化剂的可回收性和稳定性研究不多,一般仅仅是研究5次循环后催化剂的稳定性,而且再生催化剂的相关研究报道不多。虽然近期对污染物降解机理和新型高效纳米碳催化剂进行了很好的研究,但除非成功解决臭氧化作用下碳纳米催化剂的稳定性和耐久性,否则碳纳米催化剂始终难以应用于实际的水处理。 不同的纳米材料通常具有不同的催化机理和优点。最近,研究人员通过复合不同的纳米材料来合成纳米复合材料,以探索更有效的催化剂。 RGO和CNT由于其导电性和碳原子sp2轨道π键供电子特性,经常被用作金属/金属氧化物的支撑材料[44]。例如,Jothinathan等[45]使用GO/Fe3O4催化臭氧氧化布洛芬。结果表明,表面修饰的GO/Fe3O4和GO/TiO2/ Fe3O4增强了臭氧的分解和·OH的产生,降解效果几乎等同于传统的臭氧/H2O2过程。由于与GO的紧密键合,电子传输的速度可以从更高的电导率中大大加快。 除此之外,引入多金属化合物也可以提高电子转移效率,整合不同金属氧化物的物理和化学性质。Chen等[46]研究制备了Fe3O4/Co3O4复合材料,并将其应用于SMX的催化臭氧氧化反应。结果表明,Fe3O4/Co3O4复合材料通过催化臭氧氧化体系显著改善了SMX的矿化作用,并观察到Fe3O4与Co3O4的协同效应。在20 mg/L SMX、6.0 mg/min 臭氧、pH值为5.1和室温条件下,臭氧氧化只能去除约16%的总有机碳(TOC),而在相同条件下,在0.10 g/L Fe3O4/Co3O4复合材料存在下,通过催化臭氧氧化工艺获得60%的TOC去除率。此外,随着Fe3O4/Co3O4的增加,也增强了臭氧的分解和·OH的产生。 为了合成高效且易于分离的磁性纳米催化剂,将磁性材料与其他非磁性材料相结合也受到研究人员的重视。例如,Kermani等[47]合成了Fe3O4/SiO2/TiO2磁性核壳纳米催化剂,并将其应用于邻二苯酚的催化臭氧氧化,发现催化过程参与了·OH的产生,并且由于磁芯Fe3O4催化剂在暴露于磁场下很容易分离。催化臭氧化非均相催化剂具体内容如表1所示。 表1 催化臭氧化非均相催化剂Tab.1 Heterogeneous Catalysts for Catalytic Ozonation 催化剂可以为水、臭氧和有机化合物之间的催化或吸附反应提供活性位点。随着催化剂投加量的增加,给臭氧氧化体系提供更多活性位和表面积,同时,获得更高的催化臭氧氧化表观反应速率常数,进而产生更多·OH。随着催化剂投加量的增加,自由基产生量也随之增加,但是自由基浓度过高会被相互淬灭,进而影响催化效果[23,58]。催化剂的表面性质通常包括物理和化学性质。对于物理性能,通常提到比表面积、孔隙体积、孔径分布和机械强度。化学性质在催化机理的研究中发挥着更为重要的作用,复合型催化剂的活性位数量种类、总表面积、电子转移能力影响臭氧催化效果,可通过负载、掺杂、改性等手段对催化剂进行改性。为了提高催化剂的催化效率,复合型催化剂越来越受到关注。 作为一种强氧化剂,臭氧的用量是一个关键因素。臭氧可以在几秒内自分解,最长可达几分钟[59]。臭氧浓度对抗生素的降解有重要影响,随着臭氧浓度的增加,臭氧的传质速率和体积传质系数也随之增加。更多的臭氧可以被吸附并与抗生素分子反应,最终改善抗生素的降解[59]。在讨论臭氧剂量时,首先,废水的催化臭氧氧化是一种多相反应,涉及气体、液体和固体表面。因此,应同时考虑臭氧的进料浓度和气体流量。其次,虽然臭氧被用作氧化剂,但过量的臭氧不利于污染物的降解,机理如式(6)~式(7)。臭氧利用率高可以降低催化臭氧氧化的成本,应提高臭氧利用率也是研究的热点之一。此外,臭氧的用量由流量和气体浓度决定。 2·OH+O3→2O2+H2O (6) (7) 污染物的初始浓度也会影响臭氧化过程。随着初始浓度的增加,更多催化剂的活性位点也会被污染物占据,不利于·OH的产生[60]。此外,随着反应的进行,污染物会被矿化为小分子有机酸,并且将在催化臭氧氧化过程中积聚,同样会抑制反应的进行[61]。 对于大多数化学反应,反应温度是一个重要因素。催化臭氧氧化也不例外。然而,在催化臭氧氧化过程中,提高反应温度有两种相反的效果。一方面,较高的反应温度会提高氧化剂和污染物之间的反应速率。另一方面,臭氧在水中的溶解度随温度而降低,液相中的臭氧将逸散到气相中降低降解效果。在大多数报道的参考文献中,25 ℃被认为是最佳反应温度。 为了进一步增加HCOP过程在工业废水中的实用性,需要研究出对环境更为友好,同时催化活性和稳定性优良的催化剂。因此,众多研究者正在努力设计合适和有效的催化剂,以降解抗生素废水。为了推进催化臭氧化的应用,需要考虑以下方面。 (1)臭氧的利用效率 在处理工业和生活废水中,如何提高臭氧的利用效率以降低运行成本一直是研究热点。催化臭氧化一定程度上改善了臭氧的利用效率。然而,HCOP在某种程度上仍然存在臭氧利用率低的问题[69]。因此,除了不断开发性能更优异的催化剂外,臭氧催化反应器也值得不断改进。 (2)催化剂的性能 为了提高催化剂的性能,往往通过多种合成方法增加活性位点。复杂的合成方法固然提高了催化剂性能,但是这些合成方法对反应条件要求严苛,大大提高了催化剂的制备成本,限制了在实际废水中的使用[28]。此外,一些高性能催化材料的可重复使用性和稳定性也存在问题。这促使未来需要研究更便宜、更稳定和可重复使用的催化材料,以取代目前可用的催化材料。此外,评估催化材料性能、可重用性和效率的评价方法也需要进一步研究和改进。 (3)pH 溶液pH是影响处理效果的重要因素,但在大多数报道的研究中,pH没有得到监测和控制。特别是在添加催化剂(主要是金属离子)后,溶液的pH会发生变化。在处理实际废水样品中,应尽量使反应后pH符合出水要求。因此,未来的研究应了解pH对臭氧化过程的影响,并探寻各种催化剂和污染物的最佳pH。 (4)ROS和催化剂活性中心 在催化臭氧化过程中,·OH一般认为是主要ROS。但是对其他活性物种研究不多,可能存在比·OH降解效果更好的ROS。因此,探究催化臭氧化体系中其他ROS也非常重要。一些研究表明,Lewis酸是形成游离臭氧和自由基的活性位点,而另一些研究表明,Lewis碱性位点在催化臭氧化过程中起着至关重要的作用[70-72]。当碳材料用作催化剂时,这些差异尤其明显[72]。因此,需要加强有关催化剂的活性中心的研究。 本综述探讨了催化臭氧氧化的分类、催化剂类型、影响因素。最近的研究方向是利用改性材料形式的催化剂,例如活性炭材料、金属和金属氧化物上的载体、前体以及上述任何一种的任意组合,以测试它们在降解和矿化药物污染物方面的效率。为了使用催化臭氧氧化去除多种污染物,必须分别研究每种污染物,考虑诸如药物污染物的类型、要使用催化剂的表面性能、表面活性位点性能、溶液的pH和水溶液中臭氧分解的反应等因素。 根据上述研究,尽管越来越多的研究人员关注新型纳米催化剂的探索,并开发出大量高效的纳米催化剂,但这些纳米催化剂大多仍处于实验室研究阶段,纳米催化剂的缺点仍不能忽视。今后的研究应注重颗粒团聚引起的催化活性损失和纳米材料泄漏的分离困难及潜在的环境风险。纳米催化剂的上述问题限制了它们在废水处理中的实际应用。通过对现有研究的分析认为纳米催化剂与膜、负载纳米催化剂和磁性纳米催化剂相结合,是解决上述问题并促进纳米催化剂应用的最有潜力的策略[18]。此外,随着不同催化剂的开发,还应关注经济成本。
2.2 非金属型催化剂


2.3 复合型催化剂

3 影响因素
3.1 催化剂性能
3.2 臭氧投加量
3.3 污染物的初始浓度和温度
3.4 pH
3.5 水中离子和天然有机物
4 结语与展望
