胃癌患者预后相关影响因素的列线图模型构建及验证
2022-11-10李吴寒张营潘晶晶王高生
李吴寒,张营,潘晶晶,王高生
(中国科学技术大学附属第一医院/安徽省立医院 腹部外科,安徽 合肥 230036)
胃癌是全球第六大常见恶性肿瘤,是癌症相关性死亡的第四大原因[1]。根据最新发布的癌症发病和死亡报告[2],中国胃癌新发病例数和病死例数分别为39.7 万和28.9 万,均位列第三。尽管辅助放化疗和外科切除术在十几年内得到了巨大发展,但是胃癌患者预后生存时间和质量提升不明显。因此,寻找围手术期的独立预后因素对个性化治疗实现和患者预后改善至关重要。炎症机制和癌症发生、发展、增殖、侵袭和转移息息相关[3],基于该机制确定的炎症标志物可以作为癌症预后的潜在预测因素,如中性粒细胞/淋巴细胞比率(neutrophil to lymphocyte ratio,NLR)和血小板/淋巴细胞比率(platelet to lymphocyte ratio,PLR)。既往研究显示,NLR 和PLR 能够为肺癌[4]、肝细胞癌[5]和食管癌[6]患者提供更加精准的评判信息,同时其也在胃癌中得到广泛应用,越来越多的证据[7-8]提示术前NLR、PLR 较高的患者其预后较差。但是该结果在不同人群间呈现不一致性,同时胃癌预后独立风险因素多以粗分组、单独的形式呈现,缺乏综合评判的研究证据[9-16]。列线图作为基于多因素模型建立可视化工具,兼具量化和综合评价的优势,能够为胃癌患者提供个性化的临床决策证据,具备良好的临床应用价值[9]。本研究旨在探讨NLR、PLR 对胃切除术后胃癌患者的预后影响,并建立列线图与传统TNM 分期相比较,判断其在预测胃癌患者生存率中的应用价值。
1 资料与方法
1.1 研究对象
回顾性纳入2013年6月—2018年6月在中国科学技术大学第一附属医院胃肠外科接受胃癌根治切除术的胃癌患者作为训练组(n=300),同时从胃肠外科另一病区招募接受相同手术处理的胃癌患者作为验证队列(n=100)。纳入标准:⑴ 病理组织学报告确诊为胃癌;⑵ 具有完整的医疗记录和常规血液学数据;⑶ 所有患者均接受了全胃或部分胃切除术和标准的淋巴结清扫术。排除标准:⑴ 患者患有其他恶性肿瘤;⑵ 术前接受过抗肿瘤治疗,例如化学疗法和放射疗法;⑶ 转移性癌;⑷ 患者患有自身免疫性或其他急慢性炎性疾病;⑸ 围手术期死亡;⑹ 有血液系统疾病病史;⑺ 3 个月内发生静脉或动脉栓塞;⑻ 短期内连续抗凝治疗或口服/静脉应用抗生素。研究设计遵循《赫尔辛基宣言》的原则开展,所有患者术前均签署知情同意书,且研究得到中国科学技术大学第一附属医院伦理委员会批准(2022-RE-053)。
1.2 数据收集与处理
通过医院电子病历系统采集患者的人口学信息、病理资料和实验室检测数据,具体包括:年龄、性别、吸烟史、饮酒史和肿瘤类型(腺癌,非腺癌)、肿瘤部位(胃上部,胃中部,胃下部)、分化程度、侵袭深度(Tis/T1,T2/T3,T4)、淋巴结转移(lymph node metastatic,LNM)(无,有)和癌胚抗原(carcinoembryonic antigen,CEA)(<5 μg/L,≥5 μg/L)[17]。手术前3 d 内收集外周静脉血,使用全自动外周血分析仪检测血样中的淋巴细胞、中性粒细胞和血小板计数水平,并计算NLR 和PLR。对NLR、PLR 和结局状态绘制ROC,选取约登指数(Youden index,Y)最大值对应的坐标值作为临界点, 取NLR>1.98 (Y=0.355) 及PLR>134.87 (Y=0.360)为高水平炎症状态。此外,依据国际抗癌联盟(Union for International Cancer Control,UICC)与美国肿瘤联合会(American Joint Committee on Cancer,AJCC) 联合发布的TNM 分期系统对癌症发展程度分级[18]。
1.3 随访
对纳入的患者定期进行术后随访,术后2年内每3 个月随访1 次,此后每6 个月随访1 次,直到研究对象出现胃癌死亡、非胃癌死亡或失访。总生存期(overall survival,OS)定义为手术日期到死亡或最后1 次随访失访的时间。
1.4 统计学处理
使用SPSS 25.0 和R-4.0.3 (http://www.r-project.org/) 进行统计分析,其中R 主要使用“rms”、“nomogramFormula”和“pec”扩展包。分类变量采用例数(n)和百分比(%)描述,并用卡方检验检测训练组和验证组的基线特征。基于训练组数据进行单因素及多因素Cox 分析,将多因素结果中的阳性变量纳入nomogram 分析并绘制列线图,使用C-指数和校准曲线验证模型的准确性,之后使用ROC 曲线比较列线图和TNM 分期系统的预测价值。最后,结合验证组数据和列线图模型计算风险得分,在验证组进行验证和比较。双侧统计检验以P<0.05 为差异有统计学意义。
2 结 果
2.1 训练组与验证组的基线特征比较
训练组平均年龄(62.52±10.61) 岁,73%为男性,胃癌病理分型以腺癌为主(95.0%),高NLR 和高PLR 患者分别占58.7% 和50.0%;中位OS 为28 个月,1、3、5年OS 率分别为63.5%、43.0% 和35.1%。 验证组平均年龄 (63.67±10.21) 岁,69.0%为男性,多处于高炎症状态;中位OS 为32 个月,1、3、5年OS 率分别为58.9%、41.6% 和31.7%。验证组的非腺癌和低分化显著高于训练组(12.0%vs.5.0%,P=0.016;71.0%vs.59.0%,P=0.032),两组在侵袭深度和pTNM 分期维度也有所差异,其他基线特征无差异(表1)。
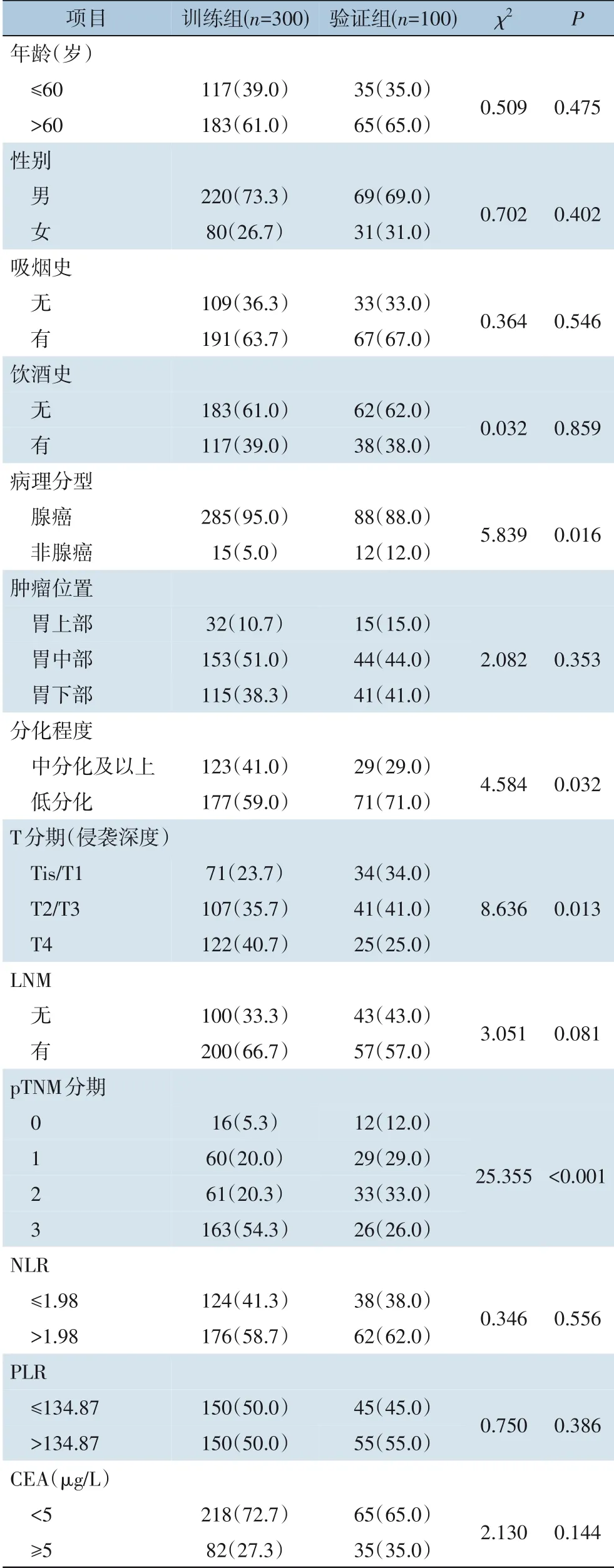
表1 训练组与验证组胃癌患者的临床特征比较[n(%)]Table 1 Comparison of clinical characteristics between training group and validation group [n (%)]
2.2 胃癌患者预后OS的危险因素分析
单因素Cox 回归分析显示,年龄、病理分型、肿瘤分化程度、侵袭深度、存在LNM、NLR、PLR和CEA 水平均与OS 有关(均P<0.05)。经过多因素调整后,存在LNM、术前NLR>1.98、PLR>134.87 和CEA≥5 μg/L 的患者OS 显著缩短(均P<0.01)(表2)。

表2 训练组单因素及多因素Cox回归分析Table 2 Univariate and multivariate Cox regression analysis in training group
2.3 列线图的构建与内部验证
为了评估NLR、PLR 的预测价值,本研究基于多因素Cox 模型构建列线图,该图纳入了肿瘤类型、侵袭深度(T 分期)、LNM、NLR、PLR 和CEA(图1)。每个因素对应等级都赋分,综合得分后得到相应的OS 率。在训练组中,校正曲线显示1、3、5年预测OS 率和实际OS 率一致(C-指数=0.81);在验证组中,列线图对3年OS 率的预测更为准确(C-指数=0.75),综上,列线图对OS 率的整体预测能力较好(图2)。

图1 基于训练组Cox分析的列线图预测模型Figure 1 Predicted nomogram based on multivariate Cox regression of training group
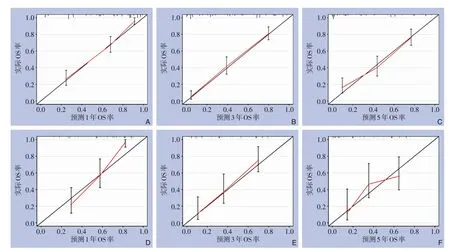
图2 训练组与验证组预测1、3、5年OS率的校准曲线 A-C: 训练组;D-F: 验证组Figure 2 Calibration curves of 1-, 3-, and 5-year OS rate in the training group and the validation group A-C: training group; D-F: validation group
2.4 列线图模型与TNM分期的预测效果比较
列线图和TNM 分期系统的ROC 分析结果显示,训练组列线图预测1、3、5年OS 率的AUC 值分别为0.865、0.855 和0.827,TNM 分期下的AUC值分别为0.677、0.690 和0.683;在验证组中,1、3、 5年OS 率的列线图AUC 为0.856、 0.788 和0.725,而TNM 系统对应的AUC 值为0.781、0.691和0.605(表3)。因此,列线图预测模型在胃癌预后方面具有较高的预测准确性。
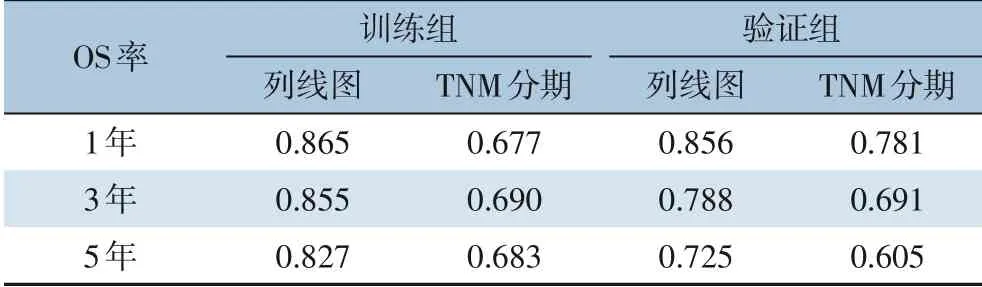
表3 列线图模型与TNM 分期的ROC 预测效果(AUC)比较Table 3 Comparison of AUC between nomogram model and TNM staging
3 讨 论
本研究证实了术前NLR 和PLR 水平是行胃切除术胃癌患者的独立预后因素。作为一项联合评价指标,NLR 和PLR 不仅排除了炎症指标共线性的影响,还在多因素调整后仍保留统计学意义。此外,预后不良结局与肿瘤类型、高侵袭深度等级、存在LNM 和高CEA 水平有关。本研究基于以上因素开发的列线图的预测能力高于TNM 分期系统,其预测生存率和实际结果的一致性为0.81,验证组一致性也高达0.75。因此,NLR 和PLR 作为常规实验室检查中的一种便捷易得、经济廉价的指标,可为胃癌患者提供较为准确的预后信息,进而帮助临床医生决策及预后评估。
3.1 NLR 及PLR 影响胃癌进展及预后的生物学机制
炎症与恶性肿瘤发生发展是多细胞介入、多因子参与、多通路激活的综合过程,进而实现癌细胞增殖、分化、转移和扩散。中性粒细胞占比超过白细胞总数的一半,且在氧化应激微环境会延存活时间(约5.4 d),占比超过白细胞总数,目前普遍中性粒细胞通过成趋化因子和血管内皮生长因子来促进癌细胞增殖、血管形成和转移[19]。同时,外周血淋巴细胞诱发细胞毒性并发挥肿瘤抑制作用,而血小板则在癌细胞的活化下分泌血管内皮生长因子和转化生长因子-β,促使癌细胞向血管和淋巴管内浸润,最后在趋化因子的协同下实现转移扩散[20-21]。接着,癌变组织自行诱发炎症聚集血液中的中性粒细胞和细胞因子,同时炎症标志物在趋化因子的作用下进入肿瘤内部,释放蛋白酶以促进癌细胞增值与分化[22]。此外,癌细胞通过细胞因子介导炎症反应,但癌组织和炎症反应形成微循环进而改变微环境,诱导肿瘤局部免疫耐受,抑制淋巴细胞灭杀功能,最终导致免疫逃避[23]。
3.2 高水平NLR及PLR显著增加预后生存风险
本研究得出NLR、PLR 提高死亡风险效果及恶化胃癌患者预后,该结果与既往研究[16,24-29]一致。研究[30]显示NLR>1.32 (HR=2.49, 95%CI=1.36~4.58) 和PLR>128 (HR=2.15, 95%CI=1.32~3.49)的患者的生存曲线下滑趋势显著加快。Wang 等[31]综合NLR 和PLR 计算全身性炎症指标得分,发现术后OS 随评分的增加而减少,炎症指标是胃癌患者的独立预后风险因素。此外,在一项包含924 例患者的前瞻性研究[8]中发现,炎症水平较高患者的中位OS 明显缩短,高PLR (HR=1.38,95%CI=1.08~1.75)、高NLR (HR=1.33, 95%CI=1.05~1.68)与5年OS 下降显著相关。因此,NLR 和PLR 作为基于炎性细胞的综合指数,能够有效评价胃癌患者的预后,纳入列线图后既提高了列线图的评估精确性,也提高了可视化水平。
3.3 创新及局限性
本研究另一项创新在于使用列线图整合各类临床因素,以量化、可视化的方式呈现不良结局发生的可能性,进而为个性化医疗提供依据[32]。临床疾病管理过程复杂且受多种因素影响,较为依赖检测仪器的先进性和医生的专业经验,治疗结局差异化明显。而列线图综合各项因素的影响,更为精确地展示了患者个体的预后风险,灵敏地反映出胃癌进展,能够在一定程度上为临床医生提供帮助。
但本研究仍然存在一些局限性。首先,本研究为单中心研究,没有外部队列的验证,纳入对象不是由同一团队完成手术,无法保证手术同质性,可能影响结果的外推性。其次,未多次采集血样检测炎症细胞数量,暴露受到随机误差的影响较大。而且,NLR、PLR 动态变化趋势和胃癌患者预后的关系尚不明确,仍需进一步研究和长期随访。最后,未知的或未测量的混杂因素可能对结局产生影响,如常住地区环境、家庭经济状况和饮食习惯等。
总之,NLR 和PLR 是胃癌患者OS 的有效预后指标,基于炎症-肿瘤理论开发的列线图可以较为准确地预测行胃切除术胃癌患者的1、3、5年OS 率。考虑到该炎症指标的便捷易得性和经济性,其在临床应用和研究中具有一定的潜在价值。
利益冲突:所有作者均声明不存在利益冲突。
