亚砷酸钠对PC12细胞增殖、凋亡及Hippo-YAP通路的影响
2022-11-09刘晓红王宏健王东艳潘艳伶潘际刚
朱 卫,李 成,刘 宇,吴 松,彭 博,刘晓红,王宏健,王东艳,杨 莉,潘艳伶,潘际刚
(贵州医科大学 1.基础医学院生理学教研室、2.临床医学院中医学教研室,贵州 贵阳 550025)
砷是一种广泛分布于地壳中的非金属元素,人群常通过饮用地下水、进食含有砷的食物、燃烧含有砷的燃煤等途径被暴露于高砷环境中,砷污染是一个严重且普遍的全球公共卫生问题[1-2]。流行病学调查发现,砷可造成皮肤、肝、肾、神经等多种脏器毒性损伤,我国是世界上砷污染最为严重的国家之一[3-4]。因此,开展有关砷的毒性损伤机理的研究具有重要的现实意义。砷可以诱导神经系统氧化应激、引起线粒体功能紊乱、影响神经递质的调节从而造成神经系统的损伤[4]。但其具体的分子机制未被阐明。Hippo-YAP信号通路的核心是由哺乳动物STE20样蛋白激酶1/2(mammalian STE20-like protein kinase 1/2,MST1/2),大肿瘤抑制因子1/2(large tumor suppressor 1/2,LATS1/2)和Yes相关蛋白(Yes-associated protein,YAP)所构成的激酶级联,该通路在调控细胞增殖、细胞凋亡、控制组织器官大小等方面具有重要作用,Hippo-YAP通路的异常则会引起细胞增殖和凋亡间的平衡失调,从而造成组织器官的过度生长及肿瘤的发生[5-6]。目前未见文献报道Hippo-YAP信号通路在砷诱导神经细胞凋亡方面的作用机制研究。因此,本研究以PC12细胞为研究对象,通过观察周期、凋亡相关指标的变化以及Hippo-YAP信号通路相关蛋白的表达水平,进一步探讨亚砷酸钠(NaAsO2)诱发神经细胞毒性损伤的机制。
1 材料与方法
1.1 材料
1.1.1细胞系 PC12细胞株(中科院昆明细胞库)。
1.1.2试剂 胎牛血清,购自以色列BioInd公司(批号:10099141C);青霉素-链霉素,购自美国Gibco公司(批号:15140163);胰蛋白酶,购自美国Gibco公司(批号:25200056);高糖DMEM培养基,购自美国Gibco公司(批号:8120293);NaAsO2,购自美国Sigma公司(批号:S7400);MST1多克隆抗体,购自ProteintechGroup(批号:22245-1-AP);LATS1多克隆抗体,购自ProteintechGroup(批号:17049-1-AP);YAP1多克隆抗体,购自ProteintechGroup(批号:13584-1-AP);Tubulin多克隆抗体,购自Bioworld(批号:BS1699);BAX多克隆抗体,购自ProteintechGroup(批号:50599-2-1g);BCL-2多克隆抗体,购自ProteintechGroup(批号:12789-1-AP);p53多克隆抗体,购自ProteintechGroup(批号:10442-1-AP);Phospho-MST1单克隆抗体,购自Cell Signaling Technology(批号:49332S);Phospho-LATS1单克隆抗体,购自Cell Signaling Technology(批号:9157S);Phospho-YAP1单克隆抗体,购自Abcam(批号:ab76252);抗兔IgG-HRP二抗,购自北京中衫金桥(批号:ZB-2305);细胞周期检测试剂盒,凯基生物(批号:KGA512);Annexin V-FITC/PI细胞凋亡检测试剂盒,凯基生物(批号:KGA1012)。
1.1.3仪器 Model 310细胞恒温CO2培养箱(美国Thermo 公司);细胞培养超净台(苏州净化);全波段多功能酶标仪(美国BioTek公司);FACSCalibur流式细胞仪(美国BD公司);全自动凝胶成像仪(美国SynGene)。
1.2 方法
1.2.1细胞培养 PC12细胞培养在高糖DMEM培养基(含10%FBS和1%青霉素-链霉素)中,置于37 ℃、5%CO2、饱和湿度的培养箱中培养,隔天换液,细胞生长至80%汇合度时进行传代或冻存。
1.1.2细胞周期检测 取对数期的细胞铺于6孔板中(5×108L-1),培养过夜,以含20、40、60 μmol·L-1NaAsO2的高糖DMEM培养基分别处理细胞,同时以无NaAsO2的高糖DMEM培养细胞作为空白对照,24 h后以不含EDTA的胰酶消化细胞,1 528g离心5 min,PBS洗2次,置于4 ℃冰箱用70%乙醇固定30 min,1 528g离心5 min,PBS洗2 次,1 528g离心5 min,弃PBS,加入300 μL PI/RNase染色工作液,室温避光60 min,加入样品管中,用流式细胞仪进行检测。
1.2.3流式细胞仪检测PC12细胞凋亡 本实验分组及部分收集处理细胞步骤同“1.2.2”,最后再加入500 μL PBS缓冲液得到细胞悬液,用移液枪轻轻的吹打混匀,再依次加入5 μL的Annexin V-FITC工作液,并轻轻振荡混匀后再加入10 μL的PI工作液,混匀后避光静置于冰上,反应20 min后,置于流式细胞仪中检测。
1.2.4蛋白印迹检测 药物处理细胞后,以RIPA细胞裂解液(含1 mmol·L-1PMSF)裂解细胞,冰上裂解10 min,2×104g离心15 min,取上清进行BCA蛋白定量,计算并配制上样缓冲液,100 ℃变性5 min,10% SDS-PAGE电泳分离蛋白,湿转至PVDF膜,5%的脱脂牛奶封闭2 h,一抗(1 ∶1 000)或内参抗体Tubulin(1 ∶50 000)于4 ℃摇床孵育过夜,TBST洗膜3次,抗兔IgG-HRP(1 ∶20 000)二抗室温孵育1 h,TBST洗膜3次,以化学发光试剂盒进行显色,凝胶成像仪成像,用ImageJ对蛋白印迹条带进行处理和分析。
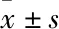
2 结果
2.1 NaAsO2对PC12细胞周期的影响通过流式细胞仪检测不同浓度NaAsO2(20、40、60 μmol·L-1)处理24 h对PC12细胞周期的影响。如Tab 1、Fig 1所示,与对照组相比,20 μmol·L-1NaAsO2处理24 h后,PC12细胞中各期比例无明显改变,差异无统计学意义,40 μmol·L-1NaAsO2处理24 h后,PC12细胞中G0/G1期比例明显降低(P<0.01),而S期比例明显增加(P<0.05),60 μmol·L-1NaAsO2明显降低G0/G1(P<0.01)和G2/M期比例(P<0.05),而升高S期比例(P<0.01),而且,与20 μmol·L-1NaAsO2处理组相比,NaAsO2在40、60 μmol·L-1呈剂量依赖性的诱导G0/G1比例降低(P<0.05)、S期比例增加(P<0.01)。

Tab 1 Effect of NaAsO2 on cell cycle of PC12 cells n=3)
2.2 NaAsO2促进PC12细胞凋亡通过流式细胞仪检测不同浓度NaAsO2(20、40、60 μmol·L-1)分别处理PC12细胞24 h后对细胞凋亡率的影响,结果如Fig 2所示。与对照组相比,20 μmol·L-1NaAsO2处理24 h后,PC12细胞凋亡率无明显改变,差异无统计学意义,40、60 μmol·L-1的NaAsO2诱导PC12细胞凋亡率由3.58%分别上升至11.06%、18.20%(P<0.05),与20 μmol·L-1NaAsO2处理组相比,40、60 μmol·L-1的NaAsO2以剂量依赖性诱导PC12细胞凋亡率增加(P<0.05)。
为了进一步证实NaAsO2的促PC12细胞凋亡作用,我们通过蛋白印迹法检测不同浓度NaAsO2(20、30、40、50、60 μmol·L-1)处理24 h后,对PC12细胞凋亡相关蛋白表达的影响。如Fig 3所示,与对照组相比,NaAsO2处理后,20、30 μmol·L-1NaAsO2处理后BCL-2蛋白的表达水平无明显变化,当浓度增加到40、50、60 μmol·L-1时BCL-2蛋白的表达水平明显下降(P<0.01),20、30、40 μmol·L-1NaAsO2处理后BAX的表达水平明显升高(P<0.05),不同浓度(20、30、40、50 μmol·L-1)的NaAsO2处理后均可使p53蛋白的表达水平明显上调(P<0.01)。
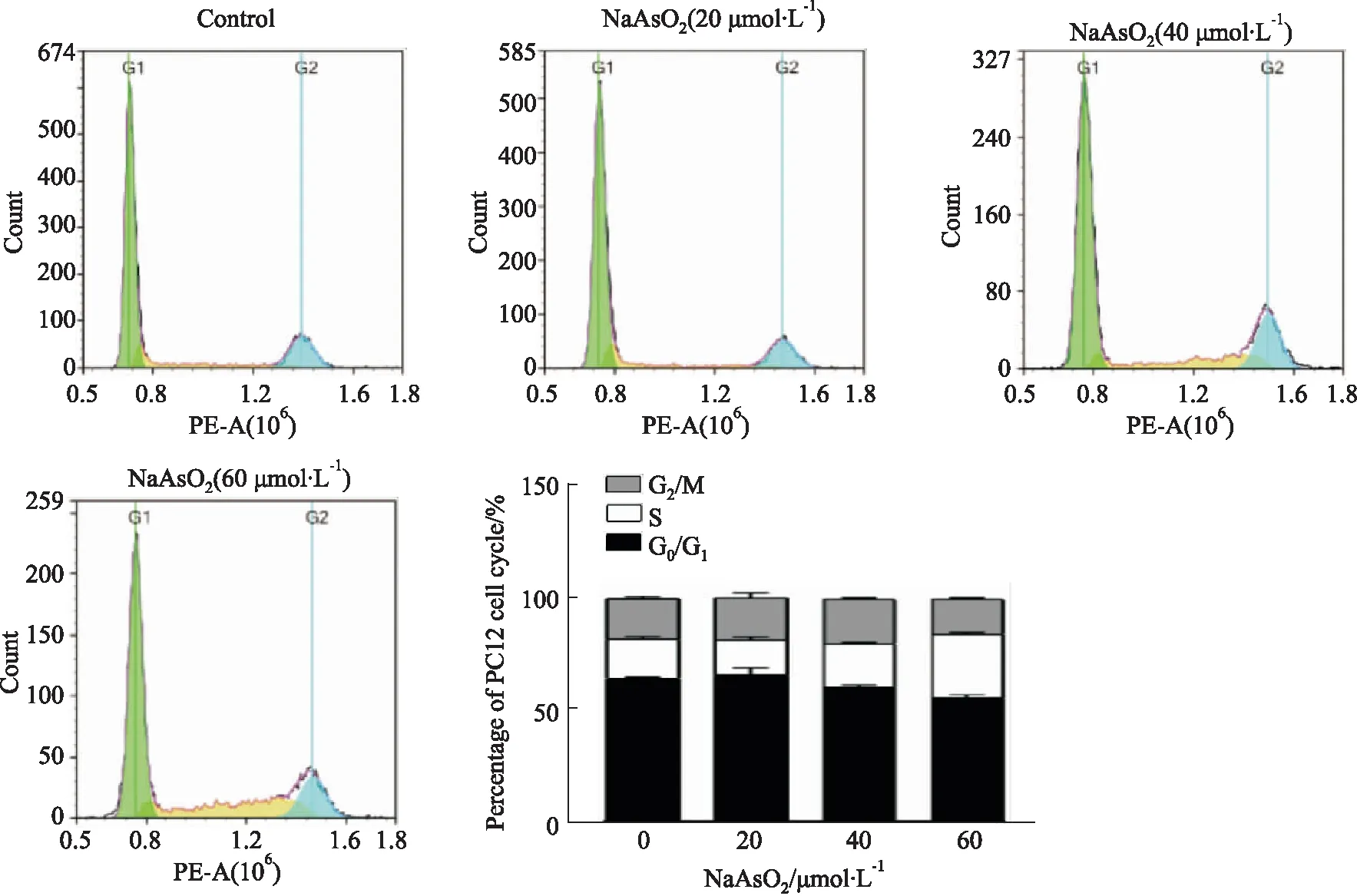
Fig 1 Effect of NaAsO2 on cell cycle of PC12 cells n=3)

Fig 2 Effect of NaAsO2 on apoptotic rates of PC12 cells n=3)

Fig 3 Effect of NaAsO2 on expression of apoptosis-related proteins in PC12 n=3)
2.3 NaAsO2对PC12细胞Hippo-YAP通路的影响为了探究NaAsO2对PC12细胞Hippo-YAP通路的影响,我们使用蛋白印迹检测经过不同浓度NaAsO2(20、30、40、50、60 μmol·L-1)处理24 h后Hippo-YAP通路相关蛋白表达水平的变化。如Fig 4所示,与对照组比较,60 μmol·L-1NaAsO2处理后,MST1蛋白表达水平明显下调(P<0.05),40、50、60 μmol·L-1NaAsO2处理后LATS1蛋白表达水平明显下调(P<0.01)、50、60 μmol·L-1NaAsO2处理后YAP蛋白表达水平明显下调(P<0.01),而p-MST1、p-LATS1、p-YAP蛋白表达水平在经不同浓度(20、30、40、50、60 μmol·L-1)的NaAsO2处理后均发生明显上调(P<0.05)。
3 讨论
越来越多的流行病学调查和临床病例报告显示,砷暴露会导致严重的神经系统功能障碍,包括神经系统的发育异常、学习记忆以及认知能力的损伤等[1-2]。本课题组的前期研究结果显示,NaAsO2暴露后PC12细胞生长受到明显抑制,可能与3MST蛋白表达下降有关[7]。在本研究中,以PC12细胞染砷,通过流式细胞仪检测细胞周期以及细胞凋亡,结果显示,NaAsO2可使PC12细胞发生S期阻滞,明显诱导PC12细胞凋亡。细胞周期是细胞的基本生命活动,细胞的生长和复制依赖于完整的细胞周期进程,当细胞受到不良刺激时,会引起周期检查点的异常进而使细胞周期滞留在周期检查点上称之为细胞周期阻滞。Zhao等[8]用二硫化二砷处理MDA-MB-231细胞发现S期细胞明显增加。柳香香等[9]用NaAsO2处理SH-SY5Y细胞后也发现S期细胞比例增加。本实验也发现NaAsO2处理后可使PC12细胞发生明显的S期阻滞。
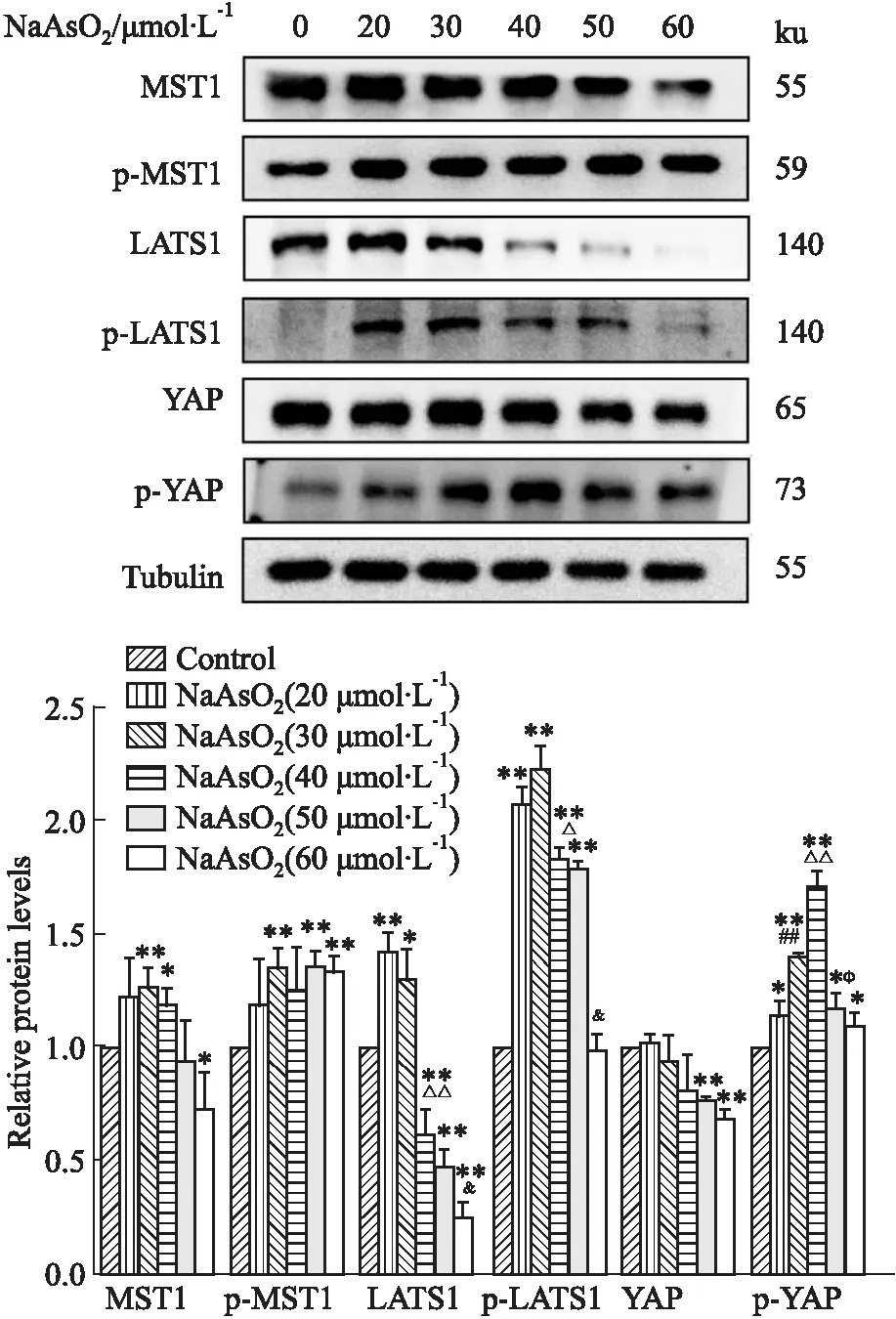
Fig 4 Effect of NaAsO2 on expression of proteins associated with Hippo-YAP signaling pathway in PC12 cells n=3)
BCL-2家族是凋亡通路中研究最为广泛的,其中BCL-2是目前已知抗凋亡作用最强的因子之一,而以BAX为代表的一类分子则促进细胞凋亡的发生,BAX/BCL-2比例增加时促进细胞凋亡的发生,当二者比列下降时则抑制细胞凋亡的发生[10]。p53基因是一种肿瘤抑制基因,其编码的蛋白称为p53蛋白,Kircelli等[11]发现,As2O3以p53依赖方式诱导骨髓瘤细胞发生凋亡。Yang[12]在NaAsO2暴露处理的大鼠模型中研究发现,大鼠肝组织内p53蛋白的表达、BAX/BCL-2比例均升高。Sun等[13]研究发现,As2O3可明显抑制神经胶质瘤细胞抗凋亡基因BCL-2的表达,并以时间依赖性方式上调凋亡基因BAX的表达,从而诱导细胞凋亡。本实验研究中对上述BCL-2家族以及p53蛋白的检测结果表明,经NaAsO2处理24 h后,出现了明显的BCL-2下调,BAX和p53的表达上调,与文献报道一致,提示NaAsO2诱导PC12凋亡可能是通过BCL-2家族蛋白实现的。
Hippo-YAP信号通路在各物种之间高度保守,其通过调控细胞增殖-凋亡平衡在维持组织稳态和器官形态上具有重要作用[5]。Wei等[14]的研究表明,维替泊芬通过抑制YAP蛋白的表达水平,引起BCL-2表达下调,从而诱导胰腺导管腺癌细胞PANC-1和SW1990凋亡。Song等[15]研究表明,子宫内膜异位症的子宫内膜基质细胞(endometrial stromal cell,ESC)中的YAP敲低降低了细胞增殖并增强了细胞凋亡,同时降低了BCL-2的表达;而YAP的过表达导致正常ESC的增殖增加和凋亡减少,诱导BCL-2的表达增加,并证实BCL-2为YAP的直接下游靶基因,用维替泊芬(YAP抑制剂)处理子宫内膜异位症的ESC显示增殖减少和凋亡增强,并且在维替泊芬处理的裸鼠子宫内膜异位症动物模型中,子宫内膜异位病变的大小明显减小,提示Hippo-YAP信号通路参与子宫内膜异位症的发病机制。Li等[16]研究表明,丙泊酚可以抑制YAP磷酸化和促进其核易位来激活YAP,激活的YAP增加了Bcl-2基因的转录并增加BCL-2蛋白表达,促进HT-22细胞存活。Li等[17]研究表明,阿霉素处理明显下调H9c2细胞YAP的表达,引起BCL-2下调,以及BAX的表达上调,并诱导细胞凋亡,褪黑激素可以使YAP水平在阿霉素的处理下保持不变,并逆转阿霉素诱导的H9c2细胞凋亡,而通过siRNA抑制YAP的表达时,褪黑激素失去了对阿霉素处理的心肌细胞的保护作用,提示YAP在其中起到至关重要的作用。Niu等[18]的研究指出,化合物9i通过激活p-LATS抑制YAP的活性下调BCL-2的表达,促进胃癌MGC-803和SGC-7901细胞凋亡,提示化合物9i可能通过激活Hippo-YAP信号通路诱导胃癌细胞凋亡。这些研究提示Hippo-YAP信号通路在调控细胞凋亡中扮演了至关重要的角色。在本实验中,我们发现NaAsO2能够上调PC12细胞内的p-MST1、p-LATS1、p-YAP蛋白表达水平从而激活Hippo-YAP信号通路,并且证实了NaAsO2可以诱导PC12细胞S期阻滞,通过上调p53、BAX的表达,抑制BCL-2的表达最终诱导PC12细胞凋亡。以上结果提示,NaAsO2诱导PC12细胞的凋亡作用可能是与Hippo-YAP信号的激活有关,Hippo-YAP通路激活从而抑制YAP的活性,导致抗凋亡蛋白BCL-2的表达下调,促凋亡蛋白BAX的表达上调,从而引起PC12细胞凋亡。然而,这些可能机制仍然有待进一步加以证实,从而有助于阐明砷中毒的分子机制,为临床防治砷中毒提供一定的实验依据。
