梨叶片黄化复绿过程中bHLH转录因子的表达分析
2022-11-09张舒琴张海燕胡小妹邢杨天
张舒琴,张海燕,于 淼,胡小妹,邢杨天,刘 伦
(安徽农业大学 园艺学院,合肥 230036)
中国是世界上梨栽培面积最大的国家,2020年,中国梨栽培总面积达87.0万公顷,总产量约1.61×107t,占世界总面积和总产量的67.3%和69.7%[1]。砀山境内黄河故道地区是中国梨主产区之一,其主栽品种‘砀山酥梨’具有适应性强、抗逆性强、产量高、耐粗放管理等优点,但近年来由于缺铁所导致的叶片黄化已俨然成为了制约当地梨产业发展的生理性病害之一。
铁是植物体内重要的微量元素,参与植物叶绿素的生物合成、氧化应激保护和各种代谢途径[2]。虽然土壤中铁含量高,但由于土壤pH的影响,其生物活性量很低[3],缺铁易导致叶绿体结构受损,叶绿素合成受阻,叶绿素降解加剧,植株表现为幼叶黄化[4]。为应对缺铁胁迫所带来的影响,植物形成了以双子叶植物和非禾本科植物为代表的铁还原策略Ⅰ和以禾本科植物为代表的铁螯合策略Ⅱ两种铁吸收机制[5],而梨的铁吸收方式属于铁还原策略Ⅰ。其首先通过根系向根际分泌H+,从而酸化土壤,紧接着在铁离子螯合还原酶FRO2(ferric-chelate reductase oxidase2)的作用下,Fe3+被还原成易被植物体吸收利用的Fe2+形式,继而通过铁转运蛋白IRT1(iron regulated transporter1)转运至细胞内[6],供植物体生理、生化过程所需。
铁代谢基因的表达受以bHLH(basic-helix-loop-helix)转录因子为主的转录调控[7]。bHLH是广泛分布于植物中的最大转录因子家族之一,由碱性氨基酸区(N-末端)和螺旋-环-螺旋区(C-末端)所组成[8],除参与调控逆境胁迫、花青素代谢和细胞生长外[9],bHLH在提升植物抗缺铁胁迫能力也具有重要意义[7],涉及FIT(FER-like iron deficiency-induced transcription factor)、PYE(POPEYE)、BTS(BRUTUS)、URI(upstream regulator of IRT1)等途径参与调控铁的吸收代谢[10]。在拟南芥中,缺铁胁迫可诱导bHLH Ⅲa类转录因子FIT的表达,并促使其结合于IRT1、FRO2启动子而提升其抗缺铁能力[11]。除此之外,FIT对下游基因的结合活性受其互作蛋白基因AtbHLH38/39/100/101(bHLH Ⅰb类)的影响,其功能缺失三突变体在缺铁条件下的拟南芥叶片严重萎黄,且外源铁处理无法促进其铁的吸收,叶片持续黄化[12-13]。另一方面,bHLH Ⅳa类转录因子AtbHLH34/104/105/115也可于缺铁条件下与bHLH Ⅰb类基因启动子结合而促进其表达,从而以FIT依赖性途径调控铁的吸收[14-16]。与此同时,bHLH Ⅳb类转录因子AtbHLH121/URI也参与了拟南芥缺铁胁迫响应,其可通过磷酸化作用与bHLH Ⅳc互作或直接作为bHLH Ⅰb类转录因子的上游而维持拟南芥铁稳态平衡[17-18]。与之相反,AtbHLH47/PYE可通过与AtbHLH105互作以及其他作用方式而抑制其活性,抑制铁的转运和贮藏[19-20],而AtbHLH11也可通过招募Fe代谢共抑制子TPR/TPL而起到抑制bHLH Ⅳc类转录因子对bHLH Ⅳb类转录因子的调控效应[21]。BTS则可与AtbHLH105和bHLH115相互作用,并促进其降解,从而负调控植株铁吸收[22]。除拟南芥bHLH转录因子之外,大豆[23]、番茄[24]、苹果[25]和杨树[26]等物种的bHLH也在不同程度上响应了缺铁胁迫。因此,bHLH转录因子在缺铁胁迫过程中发挥着极其重要的功能。
前期研究结果表明,缺铁黄化复绿叶内Fe2+显著降低,而施用浓度为0.2% FeSO4可诱导黄化叶的复绿,并造成其叶内Fe2+含量的显著增加[27],说明该黄化叶复绿与其铁代谢能力的增强相关。推测铁代谢中心调控因子bHLH在此过程中起着重要作用。但目前为止,关于以PbrbHLH铁代谢调控因子,在梨叶缺铁黄化复绿中的研究尚未见报道。
为揭示PbrbHLH在梨叶缺铁黄化复绿过程中的功能,本研究以‘砀山酥梨’正常植株与缺铁黄化植株为试材,以外源0.2% FeSO4喷施黄化叶面,通过转录组测序和实时荧光定量PCR技术,筛选并分析了梨叶内和根中响应缺铁黄化叶复绿的PbrbHLH基因及其相对表达量,探究了PbrbHLH在地上部叶内和地下部根系内的调控模式;通过与各时期叶内Fe2+含量[27]进行关联分析,筛选调控梨缺铁黄化复绿的关键PbrbHLH基因,旨在为研究‘砀山酥梨’缺铁黄化调控机制提供候选基因,并为培育抗缺铁梨品种提供理论基础。
1 材料和方法
1.1 试验材料及处理
试验以安徽省砀山县园艺场15年生‘砀山酥梨’缺铁黄化植株与正常植株为试验材料,在保证立地条件与栽培管理水平一致的情况下,于生长期对缺铁黄化植株全树叶面喷施0.2% FeSO4(2 g/L FeSO4)溶液,每株树施用量为10 L,对照组为喷施清水的正常植株和黄化植株,每3株树为1个处理,每个处理包含3个生物学重复,共计梨树27棵。取清水处理的正常、黄化植株叶片及其地下部砧木(杜梨)的幼嫩根毛,并于FeSO4分别处理3、6、9和12 d收集黄化植株叶片,所有样品经液氮固定后,于-80 ℃保存待用。
1.2 方 法
1.2.1bHLH基因的筛选各叶样RNA-seq分析数据由华大基因交互式报告平台提供(https://report.bgi.com/ps/login/login.html)。梨PbrbHLH全基因家族及相关命名均参考Dong等[28]的研究。以P-value (N/C)≤0.02为标准[29],初步筛选对照组正常植株叶片内差异表达的PbrbHLH,再根据FeSO4处理黄化植株3、6、9和12 d的基因整体表达趋势,进一步筛选出候选PbrbHLH基因。基于NCBI梨基因组数据库(https://www.ncbi.nlm.nih.gov/genome/12793),查询并获取‘砀山酥梨’的候选bHLH基因的全长序列;同时基于GDR(https://www.rosaceae.org/species/pyrus/all)在线网站,获取杜梨基因组数据,以Bioedit(Version 7.0.9)进行Blast序列分析,获取其内的与该候选基因同源的基因序列,并以DNAMAN(version 9.0)进行序列的两两比对,以此初步验证Blast比对结果,其基因命名据其相应‘砀山酥梨’基因ID而定。
1.2.2 候选bHLH基因的生物信息学分析使用ExPaSy(http://www.expasy.org/ tools/)在线网站具对筛选得到的梨候选PbrbHLH基因编码蛋白序列的氨基酸数、分子量、等电位点、脂肪族氨基酸数和蛋白质疏水性等理化性质进行分析。使用在线工具MEME(http://meme-suite.org/)对梨候选PbrbHLH基因进行motif基序分析,获取文件,并以TBtools的Gene Struture View(Advanced)功能进行可视化分析。于拟南芥数据库TAIR(https://www.arabidopsis.org/)获取该候选基因的同源序列,对筛选得到的两物种bHLH基因所编码的蛋白序列采用ClustalW 2.0进行多重比对,以MEGA 7.0软件进行系统进化树的构建(邻接法)与可视化,其中自展值的初始值设置为1 000次,最后以PowerPoint 2016进行系统进化树的美化。
1.2.3 RNA提取与实时荧光定量PCR按照天根植物多糖多酚RNA提取试剂盒操作方法提取‘砀山酥梨’叶片总RNA。采用PC54-TRUEscript RT kit(+gDNA Eraser)反转录试剂盒(试剂盒均购自北京艾德莱生物科技有限公司)合成cDNA。使用Premier 5.0软件对筛选出的梨候选bHLH基因设计实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)引物(表1)。试验于BIO-RAD T100 PCR扩增仪进行,反应总体系为:10 μL SYBR Green Master Mix,2 μL模板cDNA,上游引物和下游引物各加0.8 μL,6.4 μL DEPC,设置反应程序为:95 ℃预变性90 s,95 ℃变性30 s,60 ℃退火5 s,72 ℃延伸30 s,72 ℃再延伸10 min,共40个循环,每个样本含3次生物学重复。以梨GAPDH基因为内参,使用2-ΔΔCT法求得待测样品的相对表达量[30]。

表1 实时荧光定量PCR引物序列
1.3 数据分析
数据处理运用Excel以单因素方差分析(ANOVA)法,并以Duncan多重极差法进行各处理的平均值检验,并运用SPSS 23软件(SPSS Inc, Chicago, IL, USA)在0.05的水平(LSD),分析各处理间显著差异性。关联性分析运用双变量分析的方法,于0.05水平对均值和标准差进行双侧检验。
④待连接端面用专用电热板加热,加热板温度设定为210±10℃,待连接件的端面加热时间为5 min,加热压力为1.73MPa。
2 结果与分析
2.1 梨候选PbrbHLH基因的生物信息学分析
2.1.1 梨候选PbrbHLH基因的鉴定与其蛋白理化性质分析以P-value(N/C)≤0.02为标准,于正常植株叶片和黄化植株叶内共鉴定到64个差异表达PbrbHLH基因,进一步分析FeSO4处理后3、6、9和12 d叶内该基因的表达量,最终筛选得到21个呈现一定表达规律的PbrbHLH基因(图1)。

N. 正常植株;C. 清水处理;下同
该21个候选基因所编码的蛋白分子长度不等(表2),其氨基酸数在147(PbrbHLH155)~714(PbrbHLH78)之间,相对分子质量差异较大,介于16 676.43(PbrbHLH155)~79 095.60(PbrbHLH78)Da之间,理论等电点范围位于4.97(PbrbHLH7)~9.43(PbrbHLH119)内。该21个PbrbHLH蛋白中13个蛋白成员呈酸性,其内酸性氨基酸所占比重较大。而蛋白质疏水性的分析结果表明,所有蛋白的疏水性平均值均为负值,表明其均为亲水性蛋白。

表2 梨PbrbHLH转录因子的理化性质
2.1.2 梨候选PbrbHLH基因motif与系统进化分析以MEME在线软件对鉴定、筛选得到的21个PbrbHLH基因进行基序(motif)预测,发现其内存在多种motif结构,其中motif 1、motif 2(除PbrbHLH183外)广泛分布于各个基因,表明其可能是梨PbrbHLH基因的保守基序。多数PbrbHLH基因内含2~3个motif,而PbrbHLH104、PbrbHLH122两基因内motif数最为丰富,高达8个。除此之外,相邻分支上的PbrbHLH转录因子基序组成大致相同(图2)。
对以Bioedit分析所获得的拟南芥基因组内PbrbHLH同源序列进行分析发现(图3),21个梨PbrbHLH基因共对应了20个拟南芥AtbHLH基因,其中PbrbHLH104和PbrbHLH122的拟南芥同源序列均为AtbHLH137。参考Heim等[31]对拟南芥AtbHLH的分类研究,发现该同源AtbHLHs基因涉及Ⅲ、Ⅳa、Ⅴ、Ⅶ、Ⅺ、Ⅻ这6大亚族。而就梨PbrbHLH基因而言,其主要分布位于Ⅲ亚族和Ⅻ亚族,分别拥有8个和5个PbrbHLHs,其次为Ⅳa和Ⅶ亚族,均含3个PbrbHLHs,而Ⅺ亚族内,有且仅有PbrbHLH15。而拟南芥Ⅲ、Ⅳa亚族AtbHLH参与了缺铁胁迫在内的植物逆境胁迫的响应[32],说明该亚族内的PbrbHLHs在调控铁代谢方面可能具有重要功能,如PbrbHLH41、PbrbHLH78、PbrbHLH119等。目前关于其他4个亚族bHLH与逆境胁迫(缺铁等)的相关研究较少,但其在正常叶、黄化叶以及FeSO4所调控的缺铁黄化叶复绿过程中的表达差异特性,也说明了其在铁代谢和叶绿素代谢方面可能具有一定的调控作用,且相关基因的具体功能有待进一步研究。
2.2 梨候选PbrbHLH基因在梨叶缺铁黄化复绿中的表达分析
为探究bHLH转录因子在梨叶黄化复绿中的表达模式,采用qRT-PCR分析了该21个梨候选PbrbHLH基因在清水处理正常叶片(N)和黄化叶片(C),以及外源FeSO4处理后3、6、9和12 d时的表达。如图4所示,C叶内PbrbHLH7/29/41/104/119/122/128/135/155/183/191这11个基因表达量均显著高于N叶,其中PbrbHLH41/104/122/155/183/191这6个基因均在FeSO4溶液处理后3~9 d内较C叶显著下调,且除PbrbHLH41/183/191在处理后12 d的表达量与C叶无显著差异外,其他3个基因的该时期表达量仍显著低于C叶;与前者变化规律不同,PbrbHLH7/29/119/128这4个基因的表达量在处理后3和12 d与C叶均无显著差异,但其在处理后6和9 d的表达量也较C叶显著下降。而PbrbHLH135在FeSO4处理后的表达规律基本与PbrbHLH7/29/119/128这4个基因的表达规律相反。

不同小写字母表示同一基因不同处理间在P<0.05水平上的差异显著性,下同
C叶内PbrbHLH15/42/46/53/69/78/89/115/137/144这10个基因表达量则均显著低于N叶,FeSO4溶液处理后3 d,PbrbHLH15/78/89/144表达量均较C叶显著上调,而其他基因的该时期表达量与C叶无显著差异;在处理后6 d,除PbrbHLH42外,其他9个基因的表达量均较C叶显著增加,且达到峰值,并基本于该时期后,其表达量逐步降低,直至达到与C叶无显著差异或显著低于C叶的水平。
同时,为探究同一bHLH转录因子在梨地上部与地下部表达的协同/拮抗性,试验分析了杜梨(‘砀山酥梨’砧木)根系内相关基因的表达特性。如图5所示,黄化梨树的砧木根内PbbHLH29/41/53/89/119/128/135/155/183/191这10个基因相对表达量显著高于正常梨树砧木根系,与叶内相关基因的表达趋势一样;而黄化梨树的砧木根内PbbHLH53/89基因表达量则较正常梨树砧木根系显著降低,该基因变化趋势也与其在梨叶内的表达模式相一致。与上述结果不同,黄化梨树和正常梨树的砧木根中PbbHLH7/46/78/115/137/144基因表达量并无显著差异。由此说明缺铁胁迫条件下的叶内和根中bHLH的响应可能存在一定差异,但多数梨bHLH基因在叶片和根系的表达调控中具有协同性。

图5 正常与黄化梨树根中PbrbHLH基因相对表达量
为进一步探讨PbrbHLHs与叶片复绿的关系,试验分析了正常叶、黄化叶以及FeSO4处理后各时期相关基因表达量与各叶样内Fe2+含量[27]的相关性。结果表明,在所筛选的21个梨PbrbHLHs基因中,有且仅有PbrbHLH41和PbrbHLH78与各叶样内Fe2+含量显著相关,其中PbrbHLH78与各叶样内Fe2+含量呈显著正相关,PbrbHLH41与各叶样内Fe2+含量呈显著负相关(图6)。因此,相较于其他19个PbrbHLHs基因而言,PbrbHLH41和PbrbHLH78在调控缺铁黄化叶复绿过程中的作用可能更强。值得注意是,PbrbHLH41和PbrbHLH78同属Ⅲ 亚族,但其调控模式却截然相反,再次说明了同一系统分支内PbrbHLHs基因的功能多样性,也表明PbrbHLHs可能以协同或拮抗的作用方式而参与调控同一生理作用。
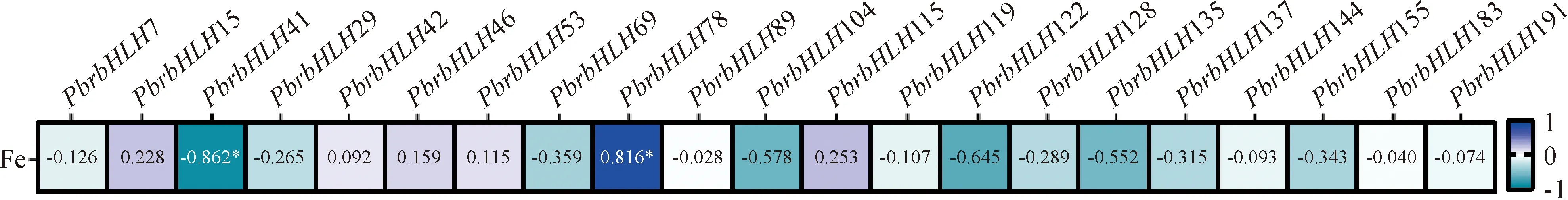
*表示显著相关
3 讨 论
植物体内铁含量虽然很低,但其对于维持叶绿体结构、促进叶绿素合成,维持植株生长发育具有重要意义[2]。研究表明,较强的铁吸收能力可保证番茄在缺铁胁迫条件下的铁吸收和叶绿素的合成,从而避免其叶片黄化[33],且可保证碱性土壤条件下小麦的叶绿素生物合成、光合作用和正常生长[34]。因此,铁吸收能力的增强可稳定或增强叶绿素合成而避免或改善叶片失绿。所以外源FeSO4所调控的的缺铁黄化叶复绿现象及其叶内Fe2+含量的增加均反映出了其铁吸收能力的增强。
梨树铁吸收依赖于HA、IRT1、FRO2等基因的表达[5],而其和相关调控网络均受bHLH类转录因子的转录调控[9]。近年来,随着基因组学研究的开展,更多植物内bHLHs基因被鉴定且被证实参与其缺铁胁迫应答[23-26]。虽然白梨基因组的测序早已完成[35],但直至近年,才见其PbrbHLH全转录因子家族的报道[28],并揭示了其与梨幼苗抗冷、抗旱、叶绿素降解及ROS积累相关,表明PbrbHLHs响应梨非生物胁迫。本试验中,共64个PbrbHLHs于清水处理正常叶和黄化叶显著差异表达,且21个PbrbHLHs与FeSO4所调控的黄化叶复绿相关,说明该基因可能与拟南芥[36]、苹果[25]、柚子[37]内部分bHLHs一样,参与调控铁的吸收、转运。除此之外,多数PbrbHLHs基因在根中的表达模式与叶内表达模式相一致,说明其在地上部和地下部的协同调控性。
另一方面,不同处理叶样中Fe2+含量[27]与该叶样内PbrbHLHs表达量的相关性分析结果表明,PbrbHLH41和PbrbHLH78可能在调控‘砀山酥梨’缺铁黄化叶内Fe2+积累及其复绿过程中发挥重要作用。外源FeSO4处理上调了叶内以PbrbHLH78为代表的铁代谢正调控因子的表达,从而可能以促进根系铁的吸收、转运以及优化叶内Fe的分配和还原等方式,促进叶内Fe2+的积累;而同时该处理也降低了叶内以PbrbHLH41为代表的铁代谢负调控因子的表达,继而可能以解除其对于铁代谢相关过程抑制作用的方式,参与调控叶内Fe2+的积累,促进叶片复绿。
而系统进化树分析结果表明,PbrbHLH41和PbrbHLH78与拟南芥AtbHLH1和AtbHLH42均处于第Ⅲ亚族,其表达模式却截然相反。迄今,关于AtbHLH1和AtbHLH42研究甚少,但不乏关于该亚族基因功能的研究。例如,AtbHLH6可激活ABA信号[38],而ABA可促进叶绿素降解而使叶片黄化[39],推测AtbHLH6可能间接引起叶片黄化;而AtbHLH29则可维持缺铁条件下的叶绿素稳定,改善叶片黄化[40]。因此,同一亚族内的基因可能存在拮抗性调控,与本文处于同一亚支的PbrbHLH41和PbrbHLH78相似。
综上所述,本研究以转录组测序结合qRT-PCR,分析了PbrbHLHs基因在梨缺铁黄化叶复绿过程中的表达,说明了PbrbHLHs可能参与梨树缺铁黄化叶复绿,且通过不同叶样内Fe2+含量和相关基因表达量的相关性分析,发现PbrbHLH41、PbrbHLH78在梨缺铁黄化叶复绿过程中起重要作用,且两者作用模式可能相反。但是,还需要进一步的研究来解析PbrbHLHs在叶片缺铁胁迫应答和黄化叶复绿过程中的作用和途径,并且对该胁迫条件下关键PbrbHLHs转录因子的特征分析,对于揭示PbrbHLHs在梨叶中的功能机制也至关重要。
