罗汉果皂苷Ⅵ对LPS诱发肝细胞损伤的保护作用及机制研究*
2022-11-08周海银陈艳瑛刘萍萍肖政辉方思思
周海银,罗 兰,陈艳瑛,刘萍萍,肖政辉,方思思
(湖南省儿童医院,湖南 长沙 410007)
脓毒症是一种危及生命的综合征,其病理过程涉及细胞炎症、氧化应激反应及线粒体功能改变等,最终导致机体多器官的功能障碍,包括肝损伤[1]。内毒素脂多糖(lipopolysaccharides,LPS)是革兰氏阴性细菌细胞壁中的一种特有成分,位于细胞壁的最外层,常用来刺激肝细胞建立体外肝损伤炎症模型[2-3]。研究表明,由细菌LPS引起的脓毒症会导致肝细胞损伤[4],同时此过程中细胞线粒体损伤是脓毒症介导急性肝损伤的主要机制之一。罗汉果是药食同源的植物,其主要成分罗汉果皂苷具有降血糖、降血脂、抗糖尿病、抗肿瘤、抗炎、抗氧化应激和清除自由基等功效[5-6]。有研究发现,罗汉果皂苷能够在LPS诱导的小鼠肺呼吸道损伤模型中发挥保护作用[7];另外也有研究报道,罗汉果皂苷能够促进小鼠肝脂肪代谢发挥抗氧化作用[8]。前期体内研究发现,罗汉果皂苷Ⅵ(mogroside Ⅵ,MⅥ)可以降低肝脏氧化应激水平,增强肝脏细胞线粒体生物合成,从而改善小鼠脓毒症所致的急性肝损伤[9],但并未在细胞水平对其作用机制做出更进一步探讨。因此,本研究进一步探讨MⅥ对体外肝细胞急性损伤的影响及分子机制,全面完善MⅥ改善脓毒症致急性肝损伤的分子机制,旨在为MⅥ的临床应用和开发提供理论依据。现报告如下。
1 材 料
1.1 细胞株 人肝细胞系L02购自中国科学院上海生命科学研究院细胞资源中心。
1.2 药物和试剂 高糖DMEM培养基(批号:11965092)、胎牛血清(批号:26010066)、青链霉素(批号:15140163)、0.25%胰酶(批号:25200072)均购自美国Thermo Fisher Science公司;LPS(批号:HY-D1056)、过氧化物酶增殖激活受体γ辅助激活物1α(PGC-1α)抑制剂SR-18292(批号:HY-101491)均购自美国Med Chem Express公司;罗汉果皂苷Ⅵ(纯度≥98%,批号:20200404)购自上海纯优生物科技有限公司;丙氨酸氨基转移酶(ALT)试剂盒(批号:C009-2-1)、天冬氨酸氨基转移酶(AST)试剂盒(批号:C010-1-1)、丙二醛(MDA)试剂盒(批号:A003-1-2)、超氧化物歧化酶(SOD)试剂盒(批号:A001-1-21)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号:A005-1-1)均购于南京建成生物工程研究所;RIPA裂解液(批号:P0013B)、BCA蛋白定量试剂盒(批号:P0010S1)、MTT试剂(批号:C0009S)、Mito-Tracker Green试剂盒(批号:C1048)均购自上海碧云天生物技术有限公司;FITC Annexin V/PI凋亡检测试剂盒(批号:KGA101)购于江苏凯基生物技术股份有限公司;RNA提取试剂盒(批号:9767)、实时荧光定量PCR试剂盒(批号:RR037Q)均购自日本TaKaRa公司;PGC-1α抗体(批号:ab191838)、核呼吸因子1(NRF-1)抗体(批号:ab55744)、线粒体转录因子A(TFAM)抗体(批号:ab176558)及GAPDH抗体(批号:ab181602)均购于美国Abcam公司;线粒体DNA(mtDNA)提取试剂盒(批号:151023)购自德国QIAGEN公司。
1.3 主要仪器 iMark酶标仪(美国Bio-Rad公司);FACSCantoⅡ流式细胞仪(美国BD公司);iBright凝胶成像仪(美国Thermo Fisher Science公司);Image-Pro Plus 6.0图像分析系统(美国Media Cybernetics公司);DM4B荧光显微镜(德国Leica公司)。
2 方法
2.1 细胞培养 L02细胞使用含有10%胎牛血清和青霉素(100 U/mL)、链霉素(100 U/mL)的DMEM培养基培养于37 ℃、5% CO2的细胞培养箱中。
2.2 MⅥ对L02细胞增殖活力的影响 取对数生长期的L02细胞,调整其浓度至6×104个/mL,每孔100 μL接种于96孔板,接种12 h后,待细胞完全贴壁,去掉原培养基,分别加入100 μL含有7.5、15、30、60、120 μmol/L MⅥ的培养基,同时设置空白对照孔,每个浓度设置3个复孔。在37 ℃、5%CO2培养箱中培养24 h。使用MTT试剂按照说明书操作,在490 nm波长处检测吸光度值(OD),并计算细胞增殖活性,确定MⅥ最佳干预浓度。
2.3 LPS诱导L02细胞氧化损伤模型的建立 取对数生长期的L02细胞,调整其浓度至6×104个/mL,每孔100 μL接种于96孔板,接种12 h后,待细胞完全贴壁,去掉原培养基,分别加入含有10、20、40、80、160 μg/mL LPS的培养基,同时设置空白对照孔,每个浓度设置3个复孔,置于培养箱中培养24 h。根据MTT试剂盒说明书操作检测各组细胞在490 nm波长处的吸光度值(OD),并计算细胞增殖活性,确定LPS的最佳浓度。
2.4 实验分组 确定MⅥ和LPS最佳干预浓度后,根据实验需要将细胞分为以下6组。(1)对照组:L02细胞不做任何处理;(2)LPS损伤组(LPS组):采用40 μg/mL LPS处理L02细胞24 h;(3)低剂量MⅥ干预组(MⅥ-L):采用40 μg/mL LPS+7.5 μmol/L MⅥ处理L02细胞24 h;(4)中剂量MⅥ干预组(MⅥ-M):采用40 μg/mL LPS+15 μmol/L MⅥ处理L02细胞24 h;(5)高剂量MⅥ干预组(MⅥ-H):采用40 μg/mL LPS+30 μmol/L MⅥ处理L02细胞24 h;(6)高剂量MⅥ+SR-18292干预组(MⅥ-H+SR-18292):采用40 μg/mL LPS+30 μmol/L MⅥ+4 mmol/L SR-18292处理L02细胞24 h。
2.5 MTT检测细胞增殖活性 取对数生长期的L02细胞,调整其浓度至6×104个/mL,每孔100 μL接种于96孔板,接种12 h后,待细胞完全贴壁,去掉原培养基,按照“2.4”分组处理。提前4 h向每孔中加入20 μL MTT溶液,避光孵育4 h,去掉培养液,每孔中加入150 μL DMSO,置于摇床上低速震荡10 min,采用酶标仪检测490 nm波长处的吸光度值(OD),计算细胞增殖活性。
2.6 比色法检测细胞培养上清中ALT和AST水平 取对数生长期的L02细胞接种于6孔板,按照“2.4”分组处理。收集各组细胞培养上清,按照试剂盒说明书进行操作,采用酶标仪测定505 nm波长处各组吸光度值(OD),根据标准曲线计算培养上清中ALT和AST水平。
2.7 比色法检测细胞中SOD、GSH-Px活性及MDA水平 取对数生长期的L02细胞接种于6孔板,按照“2.4”分组处理。收集各组细胞,冰上进行裂解并收集细胞裂解液,按照SOD、GSH-Px及MDA试剂盒操作说明书分别加入相应试剂,孵育后测各样品OD值,计算SOD和GSH-Px活性及MDA水平。
2.8 流式细胞仪检测细胞凋亡水平 取对数生长期的L02细胞接种于6孔板,按照“2.4”分组处理。胰酶消化收集各组细胞,根据FITC AnnexinV/PI双染试剂盒说明书加入相应试剂孵育后,用流式细胞仪检测各组细胞的凋亡水平。
2.9 Mito-Tracker Green染色法观察细胞线粒体分裂 取对数生长期的L02细胞接种于6孔板,按照“2.4”分组处理。根据Mito-Tracker Green试剂盒说明书,将试剂加入到处理细胞中孵育30 min后进行荧光显微镜拍照,观察各组细胞中线粒体的变化。
2.10 qRT-PCR检测线粒体生物合成相关基因的表达情况 取对数期L02细胞接种于6孔板,按照“2.4”分组处理。收集各组细胞,采用TRIzol法提取各样本的总RNA,紫外分光光度计测定总RNA浓度,采用逆转录试剂盒将总RNA反转录成cDNA,再以cDNA为模板进行PCR扩增反应。PCR扩增条件及引物序列信息参考前期研究[9]。以GAPDH为内参,采用2-△△Ct法计算PGC-1α mRNA、NRF-1 mRNA、TFAM mRNA相对表达量。
2.11 qRT-PCR检测mtDNA拷贝数 取对数生长期的L02细胞接种于6孔板,按照“2.4”分组处理,根据试剂盒说明书提取细胞mtDNA,mtDNA拷贝数以线粒体编码基因细胞色素b的拷贝数为代表。PCR扩增条件及引物序列信息参考前期研究[9]。以GAPDH为内参,采用2-△△Ct法计算mtDNA相对表达量。
2.12 Western blotting检测线粒体生物合成相关蛋白的表达情况 取对数期L02细胞接种于6孔板,按照“2.4”分组处理,收集各组细胞沉淀,严格按照RIPA试剂盒说明书进行操作,提取总蛋白,并通过BCA试剂盒测定各组蛋白浓度。取35 μg蛋白沸水浴变性后进行SDS-PAGE电泳分离蛋白,转膜,5%脱脂奶粉室温封闭1 h,TBST洗涤3次,分别加入PGC-1α、NRF-1、TFAM、GAPDH抗体,4 ℃孵育过夜。次日,加入HRP标记的二抗,室温孵育1 h,TBST洗涤3次,滴加ECL显色,凝胶成像仪显像。采用Image 6.0软件计算各泳道蛋白灰度值,以GAPDH为内参,计算各蛋白相对表达量。
2.13 统计学方法 采用SPSS 26.0统计软件对数据进行统计分析,计量资料以“均数±标准差”()表示,多组间数据比较采用单因素方差分析,组间两两比较采用SNK-q法。P<0.05为差异有统计学意义。
3 结果
3.1 不同浓度MⅥ对L02细胞增殖活性的影响 采用不同浓度(0、7.5、15、30、60、120 μmol/L)MⅥ处理L02细胞24 h。MTT检测结果显示,随着MⅥ浓度的升高,L02细胞增殖活性逐渐降低。当MⅥ浓度>30 μmol/L时,L02细胞增殖活性明显降低(P<0.05)。因此,选择7.5、15、30 μmol/L作为后续MⅥ干预浓度。(见图1)
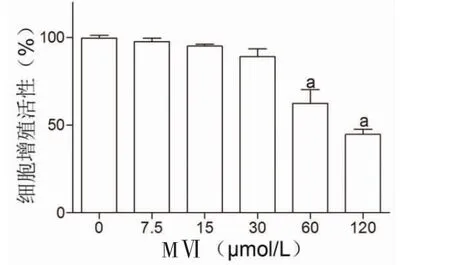
图1 不同浓度MⅥ对L02 细胞增殖活性的影响(,n=3)
3.2 LPS诱导L02细胞损伤模型的建立 为探索合适的LPS建模浓度,采用不同浓度(0、10、20、40、80、160 μg/mL)LPS处理L02细胞24 h。MTT检测结果显示,随着LPS处理浓度的增加,L02细胞增殖活性逐渐降低,并呈剂量依赖性。当LPS处理浓度>20 μg/mL时,L02细胞增殖活性明显降低(P<0.05)。因此,后续实验选择40 μg/mL作为LPS的建模浓度。(见图2)

图2 不同浓度LPS 对L02 细胞增殖活性的影响(,n=3)
3.3 MⅥ对LPS诱导损伤的L02细胞增殖活性的影响 与对照组比较,LPS组L02细胞增殖活性明显降低(P<0.05);与LPS组比较,不同剂量MⅥ干预后,L02细胞增殖活性逐渐增加(P<0.05),且呈剂量依赖性;与MⅥ-H组比较,MⅥ-H+SR-18292组L02细胞增殖活性明显降低(P<0.05)。(见图3)

图3 MⅥ对LPS 诱导损伤L02 细胞增殖活性的影响(,n=3)
3.4 MⅥ对LPS损伤L02细胞培养上清中AST和ALT水平的影响与对照组比较,LPS组L02细胞培养上清中ALT和AST水平均明显升高(P<0.05);与LPS组比较,随着MⅥ干预剂量的升高,L02细胞培养上清中ALT和AST水平逐渐降低(P<0.05),且呈剂量依赖性;与MⅥ-H组比较,MⅥ-H+SR-18292组L02细胞培养上清中ALT和AST水平明显升高(P<0.05)。(见图4)
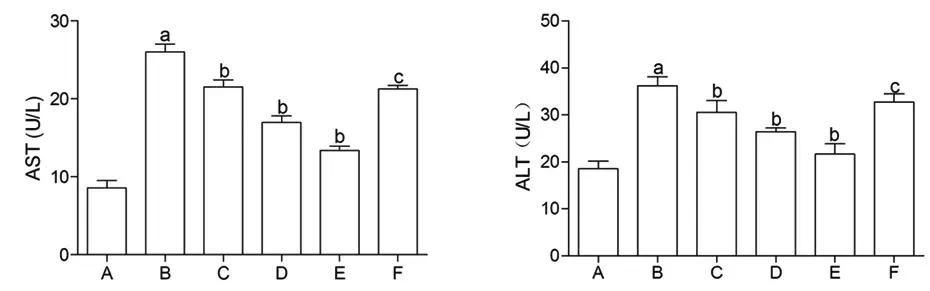
图4 各组L02 细胞培养上清中AST 和ALT 水平(,n=3)
3.5 MⅥ对LPS损伤L02细胞中SOD、GSH-Px活性及MDA含量的影响 与对照组比较,LPS组L02细胞中MDA含量明显升高(P<0.05),而GSH-Px和SOD活性均明显降低(P<0.05);与LPS组比较,不同剂量MⅥ干预后,MDA含量明显降低(P<0.05),而GSH-Px和SOD活性均明显升高(P<0.05);与MⅥ-H组比较,MⅥ-H+SR-18292组L02细胞中MDA含量明显升高(P<0.05),而GSH-Px和SOD活性均明显降低(P<0.05)。(见图5)

图5 各组L02 细胞中SOD、GSH-Px 活性及MDA含量比较(,n=3)
3.6 MⅥ对LPS损伤L02细胞凋亡水平的影响 与对照组比较,LPS组L02细胞凋亡率明显升高(P<0.05);与LPS组比较,不同剂量MⅥ干预后,L02细胞凋亡率均明显降低(P<0.05);与MⅥ-H组比较,MⅥ-H+SR-18292组L02细胞凋亡率明显升高(P<0.05)。(见图6~7)
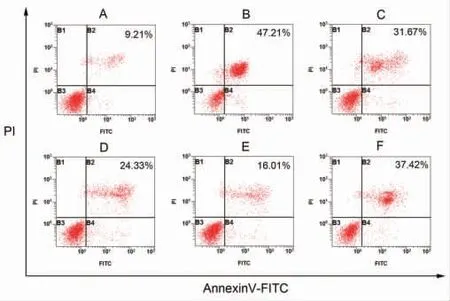
图6 各组L02 细胞凋亡散点图
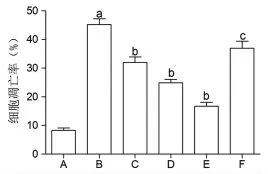
图7 各组细胞凋亡水平比较(,n=3)
3.7 MⅥ对LPS损伤L02细胞中线粒体分裂及mtDNA拷贝数的影响 对照组L02细胞线粒体分布于胞浆中,呈致密的网状,绿色荧光强度较强,线粒体分裂正常;LPS组L02细胞线粒体呈分散小颗粒状改变,绿色荧光强度较弱,线粒体分裂异常;不同剂量MⅥ干预后,L02细胞线粒体逐渐由分散小颗粒状变成致密的网状,绿色荧光逐渐变强,线粒体裂变增多;与MⅥ-H组比较,MⅥ-H+SR-18292组L02细胞线粒体呈现分散小颗粒状改变,绿色荧光强度减弱,线粒体分裂异常。(见图8)
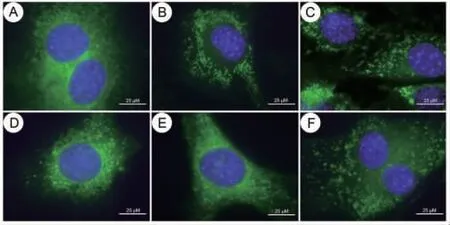
图8 Mito-Tracker Green 染色观察各组细胞线粒体分裂情况(×400)
与对照组比较,LPS组L02细胞mtDNA拷贝数明显降低(P<0.05);与LPS组比较,不同剂量MⅥ干预后,L02细胞mtDNA拷贝数均明显升高(P<0.05);与MⅥ-H组比较,MⅥ-H+SR-18292组L02细胞mtDNA拷贝数明显降低(P<0.05)。(见图9)
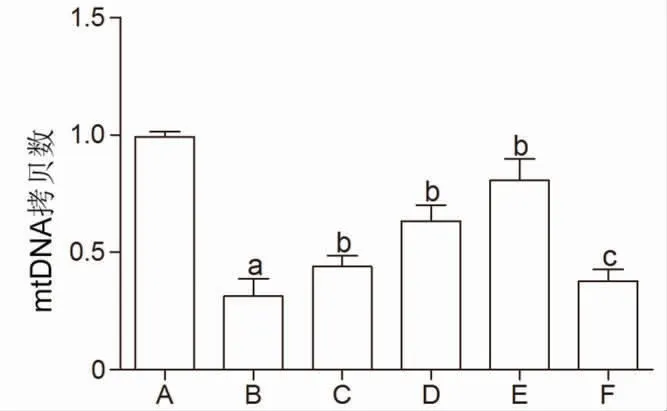
图9 各组细胞mtDNA 拷贝数比较(,n=3)
3.8 MⅥ对LPS损伤L02细胞中线粒体生物合成相关基因表达的影响 与对照组比较,LPS组L02细胞中PGC-1α、NRF-1和TFAM的mRNA和蛋白表达水平均明显降低(P<0.05);与LPS组比较,不同剂量MⅥ干预后,L02细胞中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平均逐渐升高(P<0.05);与MⅥ-H组比较,MⅥ-H+SR-18292组L02细胞中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平均明显降低(P<0.05)。(见图10~12)
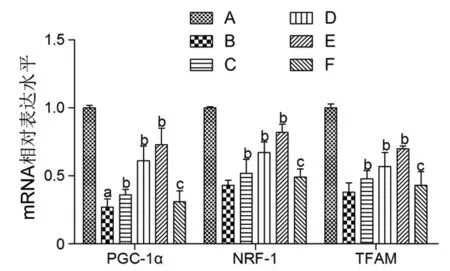
图10 各组L02 细胞中PGC-1α mRNA、NRF-1 mRNA 和TFAM mRNA 水平比较(,n=3)

图11 各组L02 细胞中PGC-1α、NRF-1 和TFAM 蛋白表达Western blotting 图
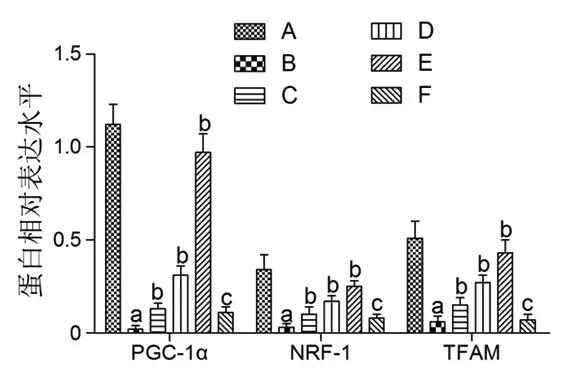
图12 各组L02 细胞中PGC-1α、NRF-1 和TFAM 蛋白表达水平比较(,n=3)
4 讨论
脓毒症是引起急性肝损伤的原因之一,尽管对于急性肝损伤的治疗取得了很大的进步,但是急性肝损伤的发病机制还未完全明确。近些年来,由脓毒症引起的肝细胞损伤正成为研究的热点和焦点,其中对线粒体功能损害的研究也日益增多[10]。
罗汉果皂苷具有许多药理活性,如抗氧化、抗肥胖、抗糖尿病、抗炎和抗癌等功效[11]。本研究采用LPS处理肝细胞建立体外脓毒症急性肝损伤模型,MⅥ干预能够明显降低肝细胞损伤标志性指标(AST和ALT)[12],同时流式细胞术结果也揭示肝细胞凋亡水平降低,说明MⅥ能够对肝细胞损伤起保护作用。研究[13]表明,GSH-Px、SOD和MDA是细胞氧化应激水平的经典标志物。进一步的研究发现,LPS刺激能够明显降低肝细胞GSH-Px、SOD活性,升高MDA含量,而高剂量的MⅥ处理则能够明显升高GSH-Px、SOD活性,降低MDA含量。MⅥ能够参与细胞氧化应激过程,并且通过降低细胞氧化应激水平,发挥保护肝细胞的作用,抑制LPS诱导的脓毒症引起肝细胞损伤,这些发现与之前研究报道一致[9]。
脓毒症的发生会引起线粒体过度的氧化应激和功能受损[14]。本研究发现,与对照组比较,LPS刺激能够明显降低mtDNA的拷贝数,并且线粒体荧光探针处理后,荧光强度也明显降低。然而,在MⅥ干预能够逆转mtDNA的拷贝数和线粒体荧光强度,这一现象提示MⅥ具有保护细胞线粒体的作用。线粒体的生物合成过程由多种蛋白调控,其中PGC-1α是最重要的蛋白之一,当PGC-1α被磷酸化或去乙酰化后,PGC-1α能够激活NRF1和NRF2,然后激活TFAM,合成线粒体DNA和蛋白产生新的线粒体。因此,激活信号通路PGC-1α/NRF/TFAM是合成线粒体不可或缺的途径[15]。LPS组线粒体拷贝数和线粒体荧光强度均明显低于对照组,线粒体合成相关分子PGC-1α、NRF和TFAM的mRNA及蛋白表达水平均明显降低,说明LPS诱导的脓毒症肝细胞损伤模型能破坏线粒体功能影响线粒体的合成。MⅥ干预后,PGC-1α、NRF和TFAM的mRNA和蛋白表达水平均明显升高,说明MⅥ能够通过分子水平发挥保护线粒体的功能。
为了进一步在分子水平上证实MⅥ对肝细胞线粒体的保护作用,本研究采用PGC-1α的特异性抑制剂SR-18292共处理细胞,结果显示,与单独高剂量MⅥ比较,抑制剂和高剂量MⅥ共处理能明显提高细胞培养上清中的AST和ALT含量;在细胞氧化应激水平方面,抑制剂的加入会降低GSH-Px、SOD活性,而升高MDA含量;在细胞线粒体拷贝数、线粒体荧光强度方面,加入抑制剂会明显降低线粒体拷贝数和荧光强度。同时,抑制剂SR-18292能降低PGC-1α、NRF和TFAM的表达,影响线粒体的生成并且能促进细胞凋亡。这些结果充分说明MⅥ能够降低细胞氧化应激水平,保护线粒体的功能使细胞免于凋亡。有报道显示,MⅥ能够在体外衰老的细胞模型中明显降低细胞中的ROS水平,减轻纺锤体的形成和染色体异常排列,提高线粒体数量、ATP水平和膜电位,同时也能降低细胞的凋亡水平[16]。该项研究也支持本实验的结果,同时也进一步验证了之前的体内实验结论:MⅥ能通过PGC-1α/NRF/TFAM信号通路促进线粒体的生物合成,降低细胞内氧化应激水平,保护细胞免于凋亡,改善脓毒症引起的肝细胞损伤。
