多肽PFHCG对胎盘滋养层细胞增殖及迁移的影响研究
2022-11-06夏卿李春艳张艳榕黄钰吕明明龙伟
夏卿,李春艳,张艳榕,黄钰,吕明明,龙伟*
子痫前期是妊娠期特发性疾病,表现为妊娠20周后新发高血压,伴有蛋白尿、水肿、多器官及系统功能障碍等,发病率2%~8%[1-2],是导致母儿发病及死亡的重要原因[3-4]。二阶段学说认为,子痫前期是由于胎盘滋养细胞侵袭不足,螺旋小动脉重塑障碍,导致胎盘缺血、缺氧,进而引发母体全身炎症反应及内皮功能障碍,出现子痫前期相关临床表现[5]。
多肽是一种独特的药物化合物,介于小分子和蛋白质之间,被证明是重要的生物活性分子,而非简单的蛋白质降解产物。随着科学技术的发展,多肽逐渐进入医疗领域,在疾病诊疗过程中发挥着重要作用[6-7]。其中,内源性多肽(例如激素、生长因子或神经递质等)是人体内天然存在的肽类物质,在一定程度上参与疾病的病理生理过程,从而影响疾病的发生与进展[8-13]。近年来,越来越多的研究表明,内源性多肽在子痫前期诊疗领域也有着广阔的发展前景,例如:脑钠肽可反映子痫前期患者的心脏功能,作为判断疾病严重程度的临床指标[14];Starodubtseva N等[15]的研究指出重度子痫前期组女性尿液中,多肽SERPINA-1排泄量显著升高等。
本课题组在前期工作中借助质谱分析技术,利用正常孕妇与子痫前期患者的血清样本,筛选出24条差异表达的多肽,其中一条来源于蛋白质HCG1982563的内源性多肽PFHCG引起了我们的注意[16]。随后,在人胎盘滋养层细胞系中研究了多肽PFHCG在滋养层细胞中的功能作用,同时通过RNA测序技术,检测多肽对滋养层细胞基因水平的影响,并对差异表达基因进行GO富集分析与KEGG通路分析,探讨其可能的作用机制,并通过RT-qPCR实验检测了富集通路中相关基因的基因表达量,现报道如下。
1 材料和方法
1.1 材料
滋养层细胞系HTR-8/SVneo细胞购自中国科学院生物化学与细胞生物学研究所(上海,中国)。HTR-8/SVneo细胞常规培养于含有10% FBS的1640培养基,置于37℃且含5% CO2的加湿培养箱中。多肽(序列为:MLIMIKM)由南京金斯瑞生物科技有限公司合成,并在多肽序列前添加穿膜序列(GRKKRRQRRRPPQQ),纯度>95%,多肽粉末溶解于高压灭菌蒸馏水中,以1 mM浓度保存于-40℃ 冰箱中,使用前稀释至相应浓度。本实验中,实验组加入0.5、1、5、10、20、40 μM浓度的多肽进行处理,对照组不加入多肽。
1.2 方法
1.2.1 CCK-8实验 将处于生长对数期的HTR-8/SVneo细胞消化后重悬,按照3 000个/孔的密度接种于96孔板中,待细胞贴壁后,换成含相应浓度多肽的培养基继续培养,以此为0 h,分别于0 h、24 h、48 h时更换成含10%CCK-8试剂的1640培养基。在加入CCK-8试剂2 h后,使用多功能酶标仪(BioTek Synergy H4)测定吸光度(波长450 nm)。
1.2.2 划痕实验 将处于生长对数期的HTR-8/SVneo细胞消化后重悬,按3×105个/孔的密度接种于6孔板中,待细胞贴壁生长至90%左右,用微量移液器管嘴于孔中央轻轻划出约1.5 mm宽度的划痕,同时加入含相应浓度多肽的培养基后继续培养,以加入多肽时间为0 h,分别在0 h、24 h和48 h时,使用倒置显微镜(ZEISS公司,德国)在100×的放大倍数下拍摄图像,并使用Image J软件测量划痕面积,计算细胞迁移面积(细胞迁移面积=0 h划痕面积-检测时划痕面积)。
1.2.3 基因测序
(1)收取样本 将处于生长对数期的HTR-8/SVneo细胞消化后重悬,培养于6孔板中。实验组多肽PFHCG终浓度为0.5 μM,对照组不加入多肽,两组样本各设置3个副孔。多肽处理24 h后,用PBS清洗三遍,每孔加入1 mL Trizol(TAKARA,日本),收集样本,保存至-80℃冰箱。
(2)基因测序 基因测序部分由武汉华大医学检验所有限公司完成。从6个样本中提取出RNA,将检测合格的Total RNA 样品进行DNaseI消化,利用真核生物具有3’端polyA尾巴的结构特点,通过oligo(dT)磁珠富集mRNA,进行片段化处理,构建文库,质控合格后,进行测序、分析。
1.2.4 RNA提取、逆转录反应和实时定量聚合酶链反应(RT-qPCR) 使用Trizol试剂(TAKARA,日本)从细胞中提取和纯化总RNA。使用逆转录试剂盒(TAKARA,日本),按说明书要求合成互补DNA(cDNA)。将1 μL cDNA样品、5 μL SYBR Green qRT-PCR Master Mix(Thermo Fisher Scientific,美国)、0.5 μL前引物和0.5 μL后引物放在冰上,制备反应体系。用RNase-free水调节体积至10 μL。所有反应均在ViiA7实时PCR系统上进行,反应条件为:95℃,10 min;40个循环(95℃,15 s;60℃,1 min)。以甘油醛-3-磷酸脱氢酶为内参,采用2-ΔCt法计算相对表达量,每个样本设置3个副孔以验证结果。
1.3 统计学方法
应用Graphpad Prism 8.0及Image J软件进行数据分析及图表制作。计量资料经正态性检验,符合正态分布者,两组间比较采用独立样本t检验;不符合正态分布者,两组间比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 PFHCG高浓度时可显著抑制滋养层细胞增殖能力,低浓度时无显著作用
将不同浓度PFHCG加入到处于对数生长期的HTR-8/SVneo细胞培养液中,待培养24 h、48 h后,使用CCK-8试剂盒检测细胞活性。其中高浓度组结果显示:当处理24 h后,与对照组相比,20 μM与40 μM组的吸光度值差异有统计学意义;当处理48 h后,10、20、40 μM组差异均有统计学意义(见图1A)。而低浓度组(0.5、1 、5 μM)吸光度值均无明显改变(见图1B)。提示多肽PFHCG在高于10 μM浓度时,对HTR-8/SVneo细胞的增殖能力有显著抑制作用,而在浓度低于5 μM时,对细胞增殖能力无显著影响。
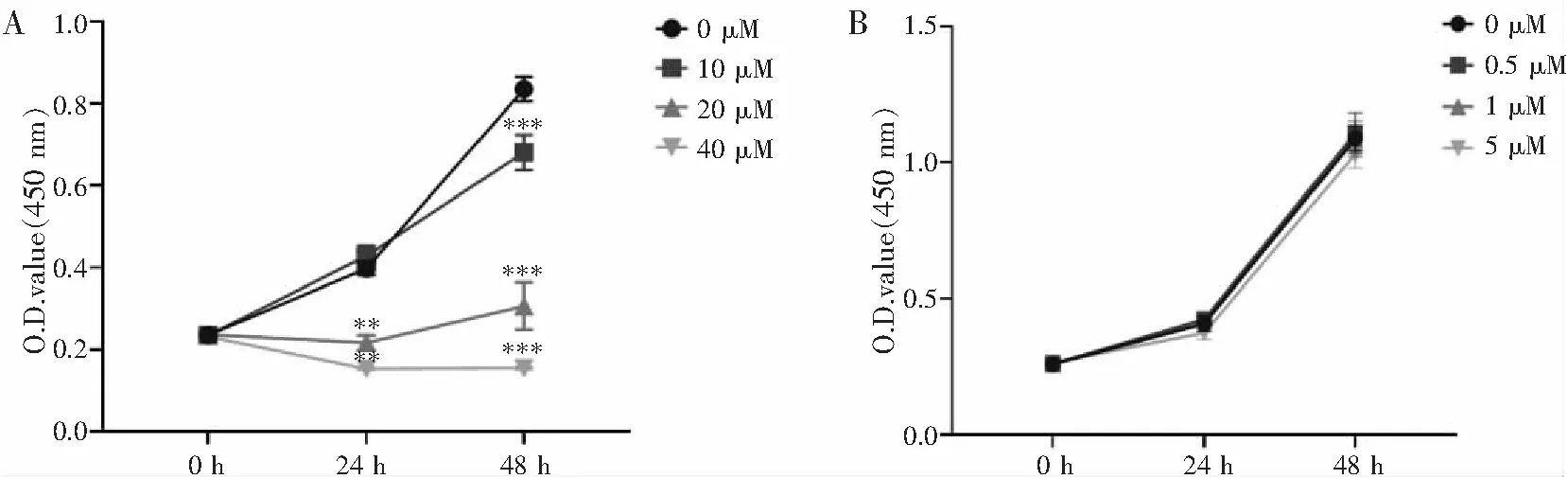
注:A.高浓度多肽PFHCG对细胞增殖能力的影响;B.低浓度多肽PFHCG对细胞增殖能力的影响。与对照组相比,***P<0.001。
2.2 PFHCG高浓度时可以显著抑制滋养层细胞的迁移,低浓度时可促进其迁移
通过划痕实验检测多肽PFHCG对HTR-8/SVneo细胞迁移能力的影响。高浓度组结果显示:10、20、40 μM组细胞迁移能力均明显低于对照组(见图2A)。低浓度组结果显示:多肽处理24 h后,0.5、1 μM组细胞迁移能力显著高于对照组,5 μM组与对照组间差异无统计学意义;多肽处理48 h后,0.5、1、5 μM组细胞迁移能力均明显高于对照组;其中,0.5 μM组细胞迁移能力与对照组间差异最明显(见图2B、图2C)。
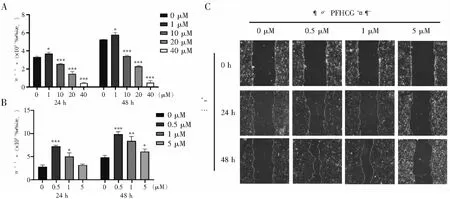
注:A.高浓度多肽PFHCG对细胞迁移能力的影响;B.低浓度多肽PFHCG对细胞迁移能力的影响;C.低浓度多肽PFHCG处理后的划痕实验图片(×100倍)。与对照组相比,*P<0.05,**P<0.01,***P<0.001。
2.3 基因测序结果
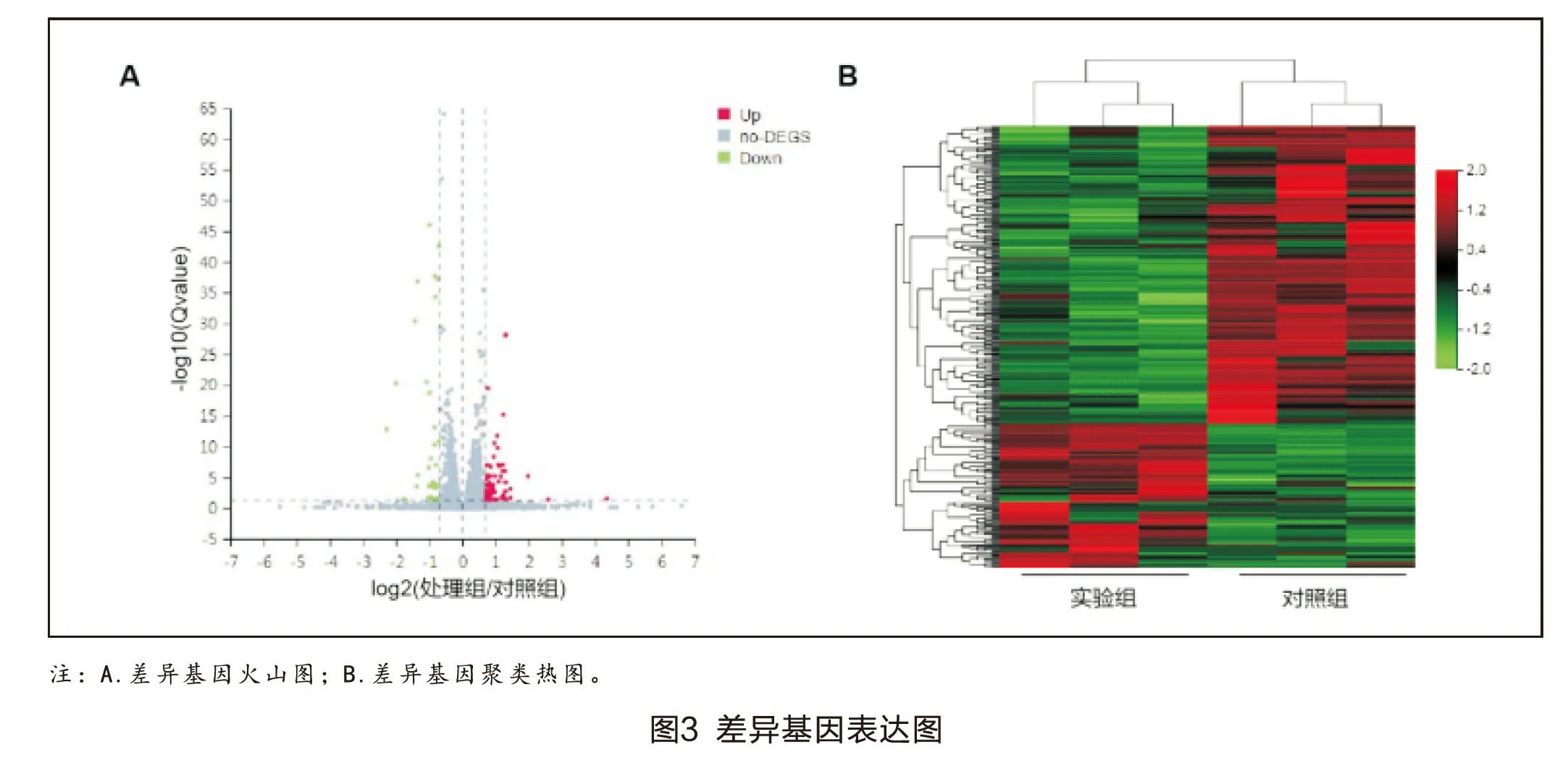
2.3.1 差异表达基因分析 使用DEGseq数据库对实验组和对照组进行差异表达基因分析,筛选条件为FoldChange≥1.5,Qvalue≤0.05,共检测到322个差异表达基因。使用火山图表示两组间差异基因情况(图3A,见彩插1):红色圆点表示在实验组中显著上调的基因,共217个;绿色圆点表示显著下调的基因,共105个;灰色圆点表示差异无统计学意义的基因。使用聚类热图表示两组间差异基因情况:红色代表在实验组中显著上调的基因,绿色代表在实验组中显著下调的基因(图3B,见彩插1)。
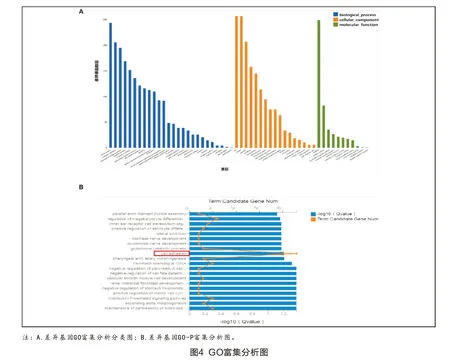
2.3.2 差异表达基因GO富集分析 从生物学过程、细胞组成及分子功能这3个方面对差异表达基因进行GO富集分析,并进行相应的分类(图4A,见彩插1),结果表明:这些差异表达基因主要富集于细胞内,其中在生物学过程方面,差异基因多与细胞粘附功能相关(图4B,见彩插1)。
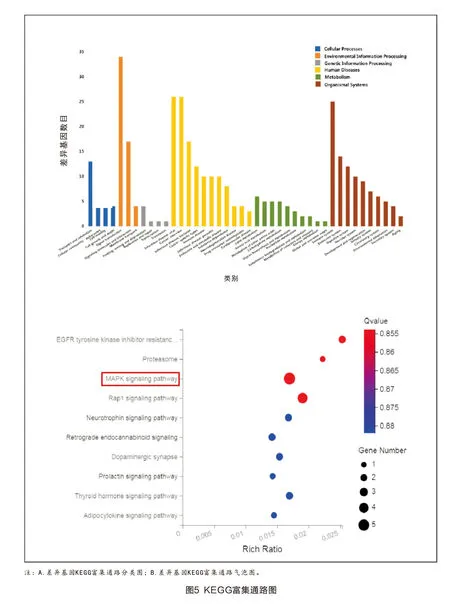
2.3.3 差异表达基因KEGG Pathway分析 通过KEGG富集通路分析,寻找差异表达基因相关通路。结果显示:差异基因相关通路多与信号转导有关(图5A,见彩插2);KEGG富集通路气泡图显示,差异表达基因多富集于MAPK信号通路,表明多肽PFHCG的作用机制可能与MAPK信号通路相关(图5B,见彩插2)。
2.4 差异表达基因验证
查阅文献后筛选出MAPK通路中与细胞增殖及迁移功能相关的基因,其中促进增殖的基因为MAPK1[17]及DUSP4[18],促进迁移的基因为PRKCB[19],抑制迁移的基因为HSPA6[20]。进一步通过RT-qPCR结果显示,与未加多肽的对照组相比,低浓度多肽PFHCG处理后的HTR-8/SVneo细胞中,MAPK1与DUSP4的mRNA水平无明显改变,(见图6A、6B),PRKCB的mRNA水平明显上调(见图6C),而HSPA6的mRNA水平则明显下调(见图6D)。这进一步证实了,低于5 μM浓度的多肽PFHCG对细胞增殖能力无显著影响,但可促进细胞迁移,且其作用机制可能与MAPK信号通路相关。
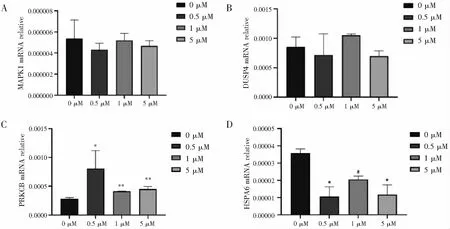
A:RT-qPCR法检测MAPK1的mRNA水平图;B:RT-qPCR法检测DUSP4的mRNA水平图;C:RT-qPCR法检测PRKCB的mRNA水平图;D:RT-qPCR法检测HSPA6的mRNA水平图。*P<0.05,**P<0.01。
3 讨论
多肽是由氨基酸构成的、普遍存在于生物体内的化合物,在人体生理及病理过程中都担任了重要角色[21]。1922年,胰岛素首次被提取并运用于医学领域[22],为糖尿病的治疗带来了新的希望,也为研究疾病发生机制及诊疗措施提供了新的方向。例如,ghrelin是一种来自胃泌酸腺的生长激素肽[23],在一项病例对照研究中,Murphy G等[24]发现,较低浓度的血清ghrelin与胃非贲门腺癌和食管胃交界腺癌的发生风险增加显著相关,这表明胃分泌的肽类激素在癌症发生过程中有着潜在作用;连接肽由胰岛β细胞分泌,其产生量与胰岛素相等,连接肽的测量可用于评估体内胰岛素分泌水平,帮助诊断糖尿病及评估药物疗效[25];肾上腺髓质素是一种受缺氧诱导转录因子-1 (HIF-1)控制的低氧诱导肽[26],在乳腺恶性肿瘤中广泛表达,并与淋巴结转移有关[27]。
多肽在子痫前期疾病诊疗方面同样有着巨大的潜力。研究表明,半胱氨酸肽可逆转滋养层细胞侵袭和迁移能力不足的病理过程,有效改善内皮功能障碍,从而减轻脂多糖诱导的高血压和蛋白尿症状[28];ELABELA是一种由发育中的胎儿和胎盘分泌的妊娠相关激素[29],可显著提高滋养层细胞的侵袭和增殖能力[30-31];而在子痫前期小鼠模型中,使用利拉鲁肽可显著降低血压,改善肾功能,减轻子痫前期相关临床症状[32]。
胎盘对子痫前期疾病的发生发展至关重要。在二阶段学说的亚临床阶段,胎盘滋养层细胞侵袭不足,导致螺旋小动脉重塑障碍,进而引起缺血缺氧、氧化应激等一系列病理改变,引发全身血管功能障碍及母体小血管痉挛[33-34]。本研究在前期工作的基础上,通过细胞功能实验验证了在子痫前期患者血清中差异表达的多肽PFHCG对胎盘滋养层细胞功能的影响,并从基因水平方面进一步研究了其作用机制。实验结果表明,给予滋养层细胞低浓度多肽PFHCG,可显著促进细胞迁移,这一改变或可促进螺旋小动脉重塑,减轻胎盘缺血缺氧症状,为子痫前期的诊疗带来新的思路。
然而,子痫前期是一种多通路、多机制的疾病,病理变化是多种因素共同作用的结果,本研究仅通过体外细胞功能实验及基因测序技术等探究了多肽PFHCG对于胎盘滋养细胞的功能及可能的作用机制。关于多肽PFHCG的其他生物学功能、以及未来在子痫前期诊疗方面的应用,均需要进一步研究。
