磁共振功能成像在鉴别脑胶质瘤术后复发与放射性损伤中的应用分析
2022-11-02孙晓琳沈阳医学院附属中心医院放射科辽宁沈阳110000
孙晓琳 沈阳医学院附属中心医院放射科 (辽宁 沈阳 110000)
内容提要:目的:分析鉴别脑胶质瘤术后复发和放射性损伤时应用功能磁共振成像效果。方法:选择2017年9月~2018年9月18例脑胶质瘤术后复发患者为复发组,20例脑胶质瘤放射性损伤患者为损伤组,均接受灌注加权成像、1H-磁共振波谱成像(1H-Magnetic Resonance Spectroscopy,1H-MRS)及弥散加权成像,析检查结果。结果:复发组平均标准化脑血容量为(4.01±0.62)优于损伤组的(1.36±0.36),t=16.3155,P=0.0000;复发组最大标准化CBV(3.35±0.55)高于损伤组的(1.19±0.33),t=14.8541,P=0.0000;复发组表观弥散系数、胆碱/肌酸、N-乙酰天门冬氨酸/胆碱与损伤组数据相近,无统计学意义,P>0.05。结论:选择功能磁共振成像鉴别脑胶质瘤的术后复发和放射性损伤有意义,1H-磁共振波谱成像和扩散加权成像只起辅助作用,不能直接作为诊断标准。
临床上,很多恶性肿瘤术后患者需接受长期放化疗,进而发生放射性损伤,且其临床表现与脑胶质瘤术后复发的临床症状相似,且在放射治疗中常出现异常强化病变,类似于肿瘤复发或放射性脑损伤,常规影像学表现、平均发生时间无明显差异,但治疗方法及预后效果完全不同,尤其是对于放射性脑损伤患者,不宜再次放射治疗,两者经常混淆,易误诊[1]。鉴别诊断多通过病理组织活检,但效果并不理想,功能磁共振成像(functional Magnetic Resonance Imaging,fMRI)是一种不会造成人体损伤的成像技术,可通过多角度定量,将活体组织内的微循环状态进行反映,可以为临床诊断提供较多有价值信息[2]。恶性原发性脑肿瘤半数以上被诊断为胶质母细胞瘤[3]。当发现肿块时,又能排除出血,就需要进行增强的核磁共振来进行检查,同时进行标准的加权。许多机构还将捕获T2W梯度回波和扩散加权序列。目前通常建议将最大安全的减瘤手术作为初始护理标准。神经外科医生通常会利用高分辨率MRI(0.5~1.2mm切片厚度)进行手术计划和术中指导,并根据附近雄辩区域的毒性风险来确定切除的积极程度。胶质母细胞瘤的空间异质性在标准MRI序列中肉眼可见;除了上述肿瘤体积外,病理学研究表明,整个肿瘤周围水肿的微观肿瘤浸润,在T2-FLAIR序列上表现为高信号[4]。超过90%的肿瘤复发将发生在这个T2-FLAIR包膜内,并且对该区域及其微环境评估的研究有限。水肿似乎是响应与浸润性肿瘤相关的血管生成和血管通透性因素而发生的。随着肿瘤的生长超出天然血液供应,由此产生的缺血会引发血管生成因子的进一步分泌,从而促进血管增殖。本文对脑胶质瘤患者的术后复发和放射性损伤通过fMRI诊断,比较灌注加权成像(Perfusion Weighted Imaging,PWI)、弥散加权成像(Diffusion Weighted Imaging,DWI)和1H-磁共振波谱成像(1H-Magnetic Resonance Spectroscopy,1H-MRS)在诊断过程中的作用。
1.资料与方法
1.1 临床资料
选择2017年6月~2018年6月18例脑胶质瘤术后复发患者为复发组,20例脑胶质瘤放射性损伤患者为损伤组,排除患其他重大疾病、精神障碍及不认可本实验的患者,本次研究已取得患者和家属同意。复发组男女各9例,年龄36~63岁,平均(49.56±5.09)岁;损伤组12例男性,8例女性,年龄35~64岁,平均(49.58±5.12)岁。分析两组基础资料,结果无统计学差异(P>0.05)。所有患者接受6~12个月术后随访,期间实施2次以上MRI成像。
1.2 方法
在取得增强矢状位、横断位、冠状位的T2W1和T1W1的影像以及常规平扫的影像时使用常规的TSE和SE序列,DWI:矩阵192×173,TE67ms,TR2764ms,FOV230×259。在桡动脉处注射20mL马根维显液,流速是3.0mL/s,做PWI扫描,参数:TE140ms,FOV224×224,矩阵88×87,TR1500ms,在每一个层面获取图像,共40张。根据PWI图像选取波普扫描的对侧镜像区和感兴趣区(ROI,大小:1.2cm×1.2cm×1.2cm),通过PRESS序列MRS扫描,参数:TE144ms,TR2000ms,采集512次,影像观察和处理。
1.3 观察指标与判定标准
MRS图像:导入原始图像,基线校正、相位循环、信号平均等,观察磷酸肌酸、N-乙酰天门冬氨酸(N-Acetyl-Aspartate,NAA)、代谢物胆碱(Choline,Cho),获取病变处代谢物Cho/磷酸肌酸(Creatine,Cr)、Cho/NAA等值。
DWI图像:经过处理使其变为磁共振的表现扩散系统图,选择对侧镜像区域和高灌注区,前者标准ROI(面积1cm2)和后者相同病变区,患病侧和对侧镜像区参数做相除,获取表观弥散系数(Apparent Diffusion Coeffecient,ADC)值。
PWI图像:导入原始图像,生成脑血流量、脑血容量、达峰时间的伪彩图,在患处内部和对侧镜像内部设置1cm2面积为标准ROI,测量次数≥3次,取得脑血容量(Cerebral Blood Volume,CBV)等平均和最大值,对患病区域和对侧镜像区域参数值做相除,取得脑血容量值。
1.4 统计学分析
在SPSS19.0中输入全部样本资料,计量资料(检查结果)用t检验,表示为±s。P<0.05代表数据存在统计学差异。
2.结果
复发组标准化CBV优于损伤组(P<0.05);复发组最大标准化CBV高于损伤组(P<0.05);复发组ADC、Cho/Cr、Cho/NAA值与损伤组数据相近,差异无意义(P>0.05),见表1。
表1.比较两组检查结果(±s)
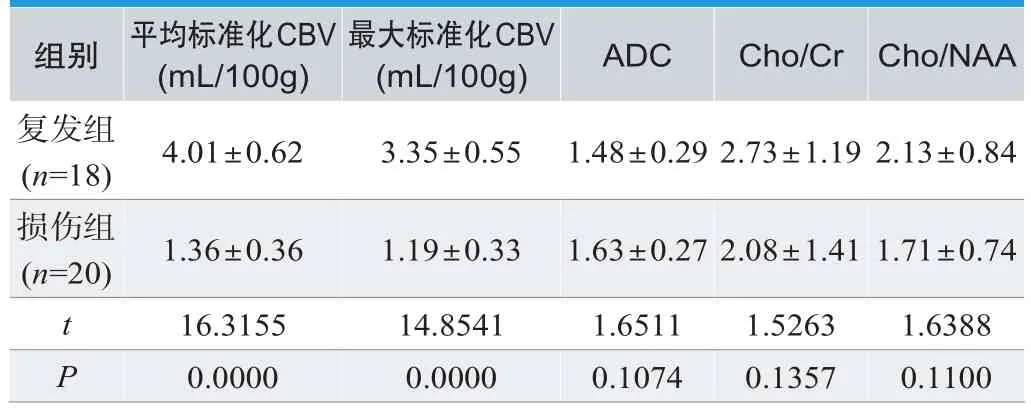
表1.比较两组检查结果(±s)
组别 平均标准化CBV(mL/100g)最大标准化CBV(mL/100g) ADC Cho/Cr Cho/NAA复发组(n=18) 4.01±0.62 3.35±0.55 1.48±0.29 2.73±1.19 2.13±0.84损伤组(n=20) 1.36±0.36 1.19±0.33 1.63±0.27 2.08±1.41 1.71±0.74 t 16.3155 14.8541 1.6511 1.5263 1.6388 P 0.0000 0.0000 0.1074 0.1357 0.1100
3.讨论
在患者手术之后的辅助放化疗以及放疗中实施恶性脑胶质瘤术的方式较为常见,能够有效提升患者治疗效果,但是由于此方式而造成的术后副作用较为严重,会形成放射性坏死的情况,坏死的程度和化疗、受照体积、照射剂量等因素均有所关联。临床中对坏死程度和肿瘤复发的鉴别一般都依照活组织进行病理检查,但在实际情况中实施手术的患者一般都不会对活组织实施病理检查,对于以上的情况,临床中常通过患者的影像学资料和定期随访以及临床症状变化检查其是否发生放射损伤和复发[3]。
传统的影像学检查中,放射性损伤的情况一般是出现在侧脑室的区域范围内,一般会出现的位置于脑白质、远离原发性肿瘤的区域位置以及胼胝体等,放射性脑损伤在 T1WI序列上多表现为稍低或低信号,若伴有出血,则以低信号为的主混杂信号,伴有不同程度占位效应,常见呈肥皂泡状或者干酪样,而肿瘤复发强化主要呈肿块样,若有胼胝体浸润,或伴有跨中线的新发强化病灶。而fMRI中包括PWI、DWI和MRS等,PWI是通过在脑组织内使用增强剂而出现首过效应,同时观察其组织内血流动力学的相关变化情况,CBV主要是反映局部组织内的微循环情况,与肿瘤血管的再生以及微血管的密度具有正相关的联系,由于放射性坏死一般缺乏新生血管,病理表现为血管内皮细胞、血管壁等坏死或血管壁玻璃样变,血管管腔狭窄,导致CBV 值下降,但胶质瘤复发时有大量新生血管,血流灌注增加,导致 CBV值升高,因此在为患者进行病情诊断时均具有一定的诊断价值。MRS是一种反映活体组织病理生理、代谢和生化变化的无创性技术。MRS检查肿瘤复发患者Cho峰值升高;肿瘤细胞浸润性生长,会破坏神经细胞,导致NAA峰值降低[6]。而对于放射性脑损伤患者,当脑组织出现放射性坏死,在MRS初期检查时,Cho峰值会升高,NAA峰值会降低,其升高及降低程度不及肿瘤复发患者。
最近对超过40000名胶质母细胞瘤患者的荟萃分析表明,与次全切除相比,全切除与提高生存率相关[7]。历史上,总切除量的确定是由神经外科医生在手术室中进行的。然而在现代,在一项研究发表后,在手术后24~48h获得术后T1CE MRI的做法已成为常规,该研究表明通过MRI对切除范围的放射学确定具有预后意义[8]。几个系列试图量化切除范围的阈值作为神经外科医生的指导,利用术前和术后T1CE图像中存在的数量或增强肿瘤。这些系列报告的阈值范围 70%~100%,但需要注意的是它们是追溯获得的。迄今为止,除了前面提到的“最大安全切除”之外,没有推荐正式的阈值。标准术前图像可以分析与提高生存率相关的宏观形状和位置特征,提供可用于临床试验中患者分层的潜在生物标志物。先进的MRI序列也可用于术前领域。fMRI在术前手术计划中尤其有用,尤其是在肿瘤或其切除可能破坏功能区的情况下[9]。许多患者曾经因为神经损伤的不确定风险而被认为是不可切除的,现在他们在功能标测后需要更积极的切除。弥散张量成像等弥散成像技术可以产生丰富的白质纤维束成像图像,可以指导神经外科手术计划,帮助区分术后血管损伤和残余增强肿瘤。最近,已经引入免疫疗法来治疗胶质母细胞瘤。免疫治疗后肿瘤的影像学表现证明了在先前标准背景下解释的新挑战。这可能是由于免疫治疗的时间动态的不确定性,以及对可能模拟肿瘤进展的放射学特征的炎症反应的需求。免疫治疗的这些问题导致了神经肿瘤学标准中免疫治疗反应评估的发展,该标准试图为确定免疫相关治疗中的肿瘤进展提供标准化指南。MRI放射组学特征有可能预测对特定治疗方式的治疗反应。在临床上,通过DSC-和DCE-MRI测量的相对脑血容量和动力学参数(Ktrans和Ve)可以预测治疗开始前对标准放化疗和血管内皮生长因子抑制剂的治疗反应。此外,超出这些图像中视觉观察范围的放射组学特征也已被证明具有预测价值。先进的核磁共振序列也可以用于术前检查。
临床研究表明胶质瘤的病理分级与反映肿瘤血管增殖程度的灌注指标CBV有显著相关性[10]。与原发性胶质瘤一样,复发性胶质瘤也存在肿瘤新生血管,这些肿瘤新生血管发育成熟,缺乏平滑肌层,基底膜不完整,渗透性更高[11]。CBV可捕获这种高增殖和高渗透状态的血管,在图像上显示高灌注。而放射性脑损伤表现为脑组织坏死、血管内皮细胞坏死及血管壁纤维素样坏死、神经纤维脱髓鞘等,病灶内缺乏新生血管,CBV明显降低,灌注图像上显示为低灌注。据本研究结果可知,复发组标准化CBV与损伤组数据差异大,具有统计学意义(P<0.05);复发组最大标准化CBV高于损伤组(P<0.05);复发组ADC、Cho/Cr、Cho/NAA值与损伤组数据相近,差异无意义(P>0.05)。该结果与张秀明等[4]研究结果接近,在其报告中,脑胶质瘤复发患者最大标准化CBV(4.00±0.61)高于放射性损伤患者(1.35±0.35),说明使用MRI检查可以为临床提供诊断依据。充分证明了 PWI对胶质瘤复发与放射性损伤的鉴别诊断有重要价值,标准化CBV 能准确反映脑血流灌注状态,为临床鉴别诊断提供有力依据。值得注意的是,胶质瘤复发病灶的标准化CBV可存在与放射性脑损伤部分重叠的现象,可能由于两者均可破坏血脑屏障,引发漏血,对比剂通过此处时局部磁场不均匀,影响 CBV 的测量。也有可能患者胶质瘤复发与放射性脑损伤同时存在[12]。在未来的研究中,可以进一步结合 MR 波谱成像或 PET 放射性核素显像等增强对两者的鉴别诊断效果。
综上所述,为确定患者是脑胶质瘤复发还是放射性损伤,选择fMRI检查有积极意义,可以用作临床诊断,而1H-MRS和DWI仅能起到辅助作用,不能作为诊断依据。
