HCD遗传缺陷基因对奶牛血液脂代谢指标的影响
2022-11-01李坤赵孝凤司敬方代冬梅王铭正俞英李凯扬唐韶青赵康许维柳咏雪肖炜张毅
李坤,赵孝凤,司敬方,代冬梅,王铭正,俞英,李凯扬,唐韶青,赵康,许维,柳咏雪,肖炜,张毅
(1.中国农业大学动物科技学院,北京 100193;2.北京市畜牧总站,北京 100107;3.天津嘉立荷牧业集团有限公司,天津 300404)
近几十年奶牛育种成效卓著,基因组选择技术加快了对优良基因的持续选择,使奶牛遗传性能稳步提升。但与此同时,奶牛近交程度也持续增加,遗传缺陷问题逐渐凸显[1]。遗传缺陷基因通过影响奶牛生长发育、降低繁殖效率、增加兽医成本等形式,给奶牛行业造成可观的经济损失[2]。
2015年,德国科学家在荷斯坦牛中发现一种与胆固醇缺乏相关的有害基因HCD (Holstein haplotype for cholesterol deficiency),该遗传缺陷的患病犊牛表现为慢性腹泻和生长迟缓,药物治疗无效,同时患有继发性肺炎、水肿和低胆固醇血症,通常在出生后几天到数月内死亡[3]。全基因组关联分析将该遗传缺陷定位于牛11号染色体长1.01Mb的片段上,并推测可能与载脂蛋白B(Apolipoprotein B,APOB)基因有关[4]。而后,全基因组测序揭示该遗传缺陷的致病机理是APOB基因内插入一个转座子(ERV2-1),导致APOB基因编码的载脂蛋白B被截短,从而造成了胆固醇代谢紊乱[5]。
HCD最初被认为是一种常染色体隐性遗传疾病,而研究者对不同基因型的犊牛及种公牛进行血液指标分析发现,不仅HCD纯合个体血液胆固醇浓度比野生型显著偏低,HCD携带者相较于野生型个体胆固醇浓度也低,甚至有些携带者表现了临床病症[6,7]。但到目前为止,相关研究所用样本量较少,HCD呈现的不完全隐性遗传模式还有待深入研究。国内学者最近研究证明HCD已传播进入中国荷斯坦牛群中[8,9],但其对奶牛脂代谢的影响尚未有相关报道。本研究通过对比中国荷斯坦牛群HCD携带者和野生型个体之间的脂质代谢相关血液指标,探究HCD携带者的血液脂代谢规律,验证HCD特殊的不完全隐性遗传模式,同时为我国荷斯坦牛群HCD缺陷基因的管控提出建议。
1 材料与方法
1.1 试验动物
根据对北京市两家牛场(以下简称牛场A和牛场B)牛只的遗传缺陷基因型的筛查结果[9],共挑选62头奶牛作为对照试验的样本,其中牛场A中HCD携带者和野生型各13头,牛场B中HCD携带者和野生型各18头。携带者与野生型个体之间的年龄、泌乳状态、健康状态、数量等因素都尽可能控制在相同水平。
1.2 血液指标检测
采取尾静脉采血的方式,每头牛采集5mL血液装入分离胶促凝采血管,立即颠倒混匀5次,静置后以3 000r/min离心5~8min(至分离胶将血清分离),用移液枪将上层血清吸入2个冻存管,每个管约1mL,放置于-20℃冰箱保存。血液指标检测通过全自动生化分析仪或半自动生化分析仪完成,包括葡萄糖(GLU)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)5项生化指标。
1.3 统计分析
采用Shapiro-Wilk法(R软件shapiro.test函数)进行数据正态性检验,发现5项血液指标数据均符合正态分布(P>0.05)。HCD携带者和野生型各项血液指标的差异显著性检验采用配对t检验,血液生化指标之间的相关性用皮尔逊相关系数度量。
2 结果
2.1 血液指标间的相关性分析
对所有牛只5项血液生化指标之间的相关性分析显示(图1),TC、HDL-C、LDL-C之间的相关系数可达到0.85~0.96,即两两之间呈现强正相关关系,但TG和GLU、以及TG、GLU与TC、HDL-C、LDL-C三项指标之间的相关系数在0.6以下,观察不到强的相关性。

图1 血液指标相关性分析
2.2 日龄对血液指标的影响
在牛场A样本中,奶牛血液TG和GLU浓度均随日龄的增加而降低,而TC、HDL-C和LDL-C三项血液指标与日龄呈正相关关系,且野生型个体的血液TC、HDL-C和LDL-C浓度随日龄的增加表现出的增长幅度较HCD携带者更大。牛场B的数据显示,日龄对HCD携带者和野生型5项血液指标的影响趋势与牛场A类似,但其影响程度较牛场A小(图2)。

图2 日龄对所测5项血液指标的影响
2.3 HCD携带者与野生型血液指标差异分析
检测结果(表1)显示,牛场A中13头HCD携带者的TC浓度均值为3.14±1.28mmol/L,显著低于野生型的4.32±2.07mmol/L(P<0.05);同时,其LDL-C浓度(0.18±0.14mmol/L)也较野生型(0.38±0.21mmol/L)更低,且差异达到极显著水平(P<0.01)。此外,HCD携带者的HDL-C、TG和GLU的平均浓度都比野生型更低,但差异不显著。总体而言,牛场A中HCD携带者的五项血液指标相比野生型呈现出不同程度的低水平。
牛场B的H C D携带者除了T G浓度(0.39±0.05mmol/L)接近于野生型(0.38±0.04mmol/L)外,其他四项指标也都表现出与牛场A相同的较野生型偏低的趋势,但差异均不显著(表1)。
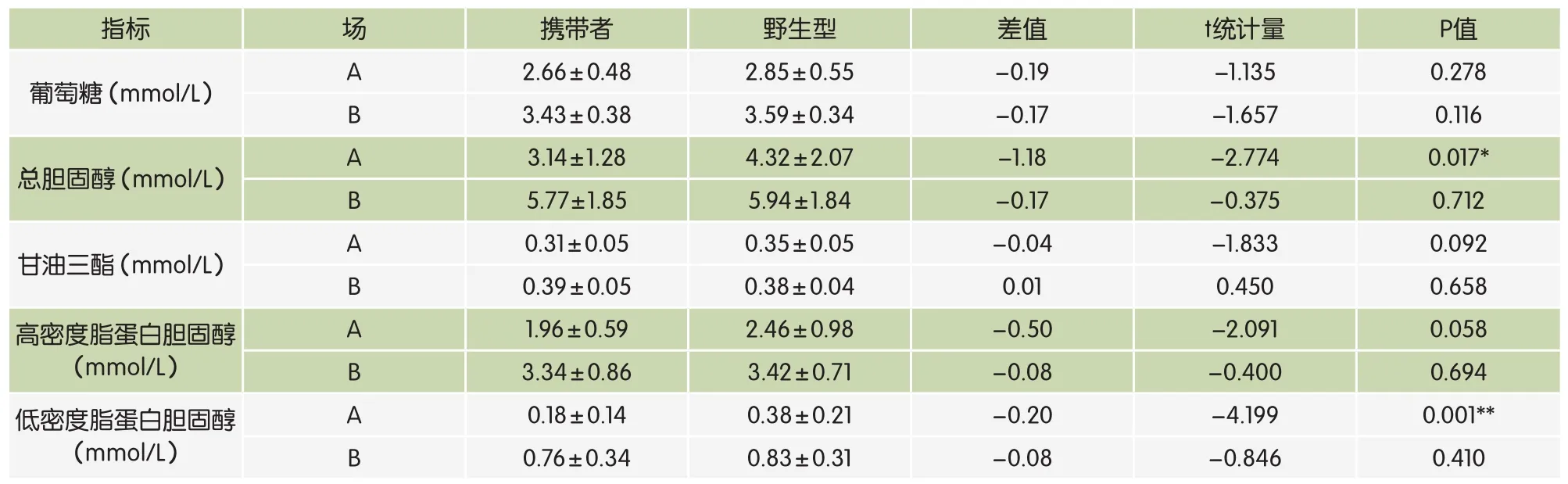
表1 HCD携带者与野生型血液生化检验结果比较(平均值±标准差)
3 讨论
此前在荷斯坦牛中鉴定出的遗传缺陷基因(例如HH1~HH5,CVM,BS,BLAD)均呈常染色体隐性遗传模式,遗传缺陷纯合子发病,但携带者的生理表现完全正常,故只要在种公牛中淘汰缺陷基因,就能完全避免缺陷基因的不利影响。然而,HCD是一个截然不同的缺陷基因,本研究中HCD携带者各项血液指标都比野生型偏低,个别指标达到显著或极显著水平。这一现象与此前国外研究结果一致[4,7],印证了HCD是一个不完全隐性的遗传缺陷基因,故携带者较野生型具有更高的脂代谢异常风险,需要针对其设计更合理的育种及管控方案。
目前认为,HCD的分子机理是APOB基因内发生转座子(ERV2-1)插入,造成APOB基因被截断,使其无法转录翻译为正常的载脂蛋白B而造成的[5]。而载脂蛋白B是低密度脂蛋白(LDL)的主要载脂蛋白,负责把胆固醇运往肝外组织;同时,LDL表面的载脂蛋白B能与细胞表面的特异性膜受体结合,介导胆固醇被细胞吸收[10],因此载脂蛋白B是胆固醇运输和被细胞吸收的关键因素。HCD遗传缺陷导致无法合成正常功能的载脂蛋白B,阻碍了胆固醇的代谢[11]。本研究中HCD携带者母牛的血液指标LDL-C和TC水平都显著低于野生型(P<0.01),说明HCD携带者的胆固醇代谢能力减弱,但其分子机制还不清楚,可能是由于携带者APOB基因仅有一个正常的等位基因,降低了载脂蛋白B的生物合成量,从而影响胆固醇的代谢能力。
本研究还探究了各项血液指标的相关性,发现TC、HDL-C、LDL-C两两之间都显示出较强的相关性。这是由于HDL-C和LDL-C都是由载脂蛋白和胆固醇结合形成的,而HDL-C和LDL-C起着运输胆固醇的作用[12,13]。此外,本研究发现HCD携带者的脂代谢指标在不同月龄都有比野生型偏低的趋势,鉴于年龄对血液指标的影响,本试验将其作为挑选配对样本的重要因素。
本研究中两个牛场的血液指标差异分析的结果存在差异,在牛场B中的统计结果并不显著,这可能是由于饲养环境和HCD作用机制等因素造成的。首先,表型是由遗传和环境效应共同作用的结果,饲养方式、饲料、环境等因素可以改善HCD携带者缺陷基因的不利影响。在血液检测结果中,牛场B的所有血液指标浓度都高于牛场A,这可能是因为牛场B的牛群营养水平较好,缩小了HCD缺陷基因造成的差异。另外,鉴于HCD表现为不完全隐性遗传模式,杂合子有不完全外显率[6],意味着其他脂代谢相关基因可能也影响血液指标变化,导致统计结果并不显著。
HCD缺陷基因已经扩散到我国的牛群中。2021年,研究人员在1 633头中国荷斯坦牛群中检测到HCD携带频率为3.62%,在9种常见的遗传缺陷中属于较高的频率[9,14]。由于HCD携带者也可能存在一些脂代谢类疾病,甚至表现出缺陷纯合的临床症状,这比一般的遗传缺陷疾病造成更大的饲养管理上的成本,所以应当采取积极的管理措施,控制其负面影响。但因为某些HCD携带者是生产性能优异的个体,将其直接剔除得不偿失,反而会造成更大的经济损失[15]。因此,合理的HCD遗传缺陷基因管理策略应是尽早对奶牛群进行HCD基因检测,彻底淘汰HCD携带者公牛,逐步淘汰HCD携带者母牛。另外,在奶牛饲养中通过精准管理,提高HCD携带者的营养水平,降低出现脂代谢异常的风险。
4 结论
通过血液指标分析发现HCD携带者相比野生型血液中总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)偏低,且这3个指标具有较强的正相关关系。建议对国内种公牛进行HCD分子检测,彻底淘汰携带者公牛。奶牛场也应对HCD缺陷基因进行风险评估,筛查并逐步淘汰HCD携带者母牛,从而有效控制HCD遗传缺陷基因的负面影响。
