肽配基仿生亲和介质的制备和抗体纯化性能研究
2022-11-01史清洪贾立霞
史清洪,贾立霞
(天津大学化工学院,天津 300350)
抗体因其高特异性和低免疫原性被广泛应用于癌症、自身免疫性疾病及类风湿性疾病等的治疗[1],市场需求日益扩大,这促进了抗体分离纯化工艺的发展.金黄色葡萄球菌蛋白A因其对抗体具有高选择性和亲和力,被广泛用作抗体亲和层析配基[2],经蛋白A亲和层析捕获,一步便可以获得纯度较高的产品,被誉为抗体分离纯化的“黄金标准”.然而其也存在着价格昂贵、洗脱条件苛刻、酶稳定性差、配基容易脱落和免疫原性高等缺点[3].以分子模拟等技术获得的仿生多肽不仅具有与蛋白A配基相似的亲和力和选择性,还能克服蛋白A配基存在的问题[4-5],可用作蛋白A的替代配基进行抗体的纯化,并且已经投放于市场[6].然而天然氨基酸组成的线性多肽容易被生物体内的酶降解[7],可通过引入非天然氨基酸提高配基对蛋白水解酶的抗性[8-9],将多肽中的氨基酸替换为其对映体形式,以便进一步提高多肽亲和介质的使用寿命.
本文以实验室筛选的仿生多肽FYWHCLDE[10-12]的对映体形式为亲和配基,将其偶联于2,2’-二硫二吡啶修饰的Sepharose 6FF上,用ÄKTA purifier蛋白纯化系统和高效液相色谱考察了亲和介质对实际体系的分离效果及其稳定性,为制备高稳定性多肽亲和介质提供借鉴.
1 实 验
1.1 材料与试剂
L/D-FYWHCLDE多肽,纯度95%,吉尔生化(上海)有限公司;Sepharose 6FF和细胞培养上清液,GE Healthcare;人血清,美国Sigma-Aldrich公司;其余试剂来源均为天津产分析纯.
1.2 实验方法
1.2.1 多肽酶稳定性评价
选取可以降解芳香族氨基酸形成的肽键的α-糜蛋白酶,考察L型和D型多肽配基的酶稳定性.将多肽溶于适量的二甲基亚砜(DMSO)中,超声15 s,然后用平衡缓冲液(20 mmol/L pH=6.0的磷酸缓冲液)进行稀释,配制成1 mg/mL的多肽溶液,取1 mL多肽液,加入20 μL 1 mg/mL的α-糜蛋白酶(多肽和酶质量比为50∶1),混合均匀后置于37℃空气摇床中振荡反应,用反相高效液相色谱法(RP-HPLC)测定反应0.5、1、2、4、6与8 h后多肽的剩余含量[13],分析多肽耐蛋白酶水解的能力.
1.2.2 仿生多肽亲和介质的制备
(1) 功能基团的引入[14].多肽亲和介质制备流程如图1所示.称取4 g经去离子水清洗并抽干后的介质,用20%、50%和70%的DMSO水溶液分别浸泡5 min后抽干,加入18 mL DMSO、12 mL ECH,0.6 g NaOH颗粒,50℃反应4 h,反应结束后用去离子水充分洗涤;取适量抽干的环氧活化的介质于25 mL锥形瓶中,向其中加入6 mL PB(0.5 mol/L, pH=6.3)缓冲液,再加入2 mol/L 的硫代硫酸钠溶液3 mL,25℃振荡反应6 h.反应结束后,用去离子水洗净介质,抽干后转移至离心管中,加入0.2 mol/L NaHCO3溶液3 mL,混合均匀后再向其中加入含有 0.5 g二硫苏糖醇的1 mmol/L EDTA二钠溶液3 mL,继续反应30 min,反应结束后用0.2 mol/L NaHCO3溶液和1 mmol/L EDTA 溶液依次进行清洗;按体积比3∶2的比例将含有1 mmol/L EDTA二钠的丙酮溶液和50 mmol/L NaHCO3溶液混合均匀,并用该混合缓冲液充分清洗巯基化后的介质,抽干后称取3 g于25 mL离心管中,加入5 mL上述混合缓冲溶液,再向其中加入0.3 mol/L 2,2’-二硫二吡啶溶液10 mL,振荡混合均匀.继续反应1 h,反应结束后用丙酮-水(体积比3∶2)混合溶液和1 mmol/L EDTA二钠溶液依次进行充分的清洗.

图1 多肽亲和介质制备流程Fig.1 Preparation scheme of peptide affinity chromatography
(2) 多肽配基偶联.用去离子水、0.1 mol/L Tris-HCl(pH=7.5,0.5 mol/L NaCl,1 mmol/L EDTA二钠)交联缓冲液依次清洗上述介质,抽干后称取1 g介质于锥形瓶中,向其中加入交联缓冲液6 mL,再加入适量的用交联缓冲液稀释的1 mg/mL的多肽液,25℃反应 1.5 h.最后,为了避免介质尚未反应的活性基团影响后续的分离,向锥形瓶中加入适量的半胱氨酸继续反应 0.5 h进行封闭.用反相色谱法(RP-HPLC)测定反应前后溶液中多肽的含量,计算得到多肽亲和介质的配基密度.
1.2.3 多肽亲和介质性能评价
静态吸附实验:将多肽亲和介质用不同pH值的浓度为20 mmol/L的缓冲液(pH=4.0和pH=5.0为柠檬酸钠缓冲液,pH=6.0和pH=7.0为磷酸缓冲液)进行活化后抽干,称取若干份10 mg介质于2 mL离心管中,加入1 mL不同浓度的蛋白溶液,反应6 h后测定上清液在280 nm处的吸光值,并利用Langmuir方程进行拟合,即

式中:qm为蛋白质饱和吸附容量,mg/mL;Kd为解离常数,mg/mL;q和c分别为达到吸附平衡时蛋白质在固相和液相上的浓度,mg/mL.
动态吸附实验:将多肽亲和介质填装于1 mL TricornTM5/50层析柱中,用pH=6.0的磷酸缓冲液为上样缓冲液,平衡缓冲液中添加0.5 mol/L NaCl为洗脱缓冲液[15-16],用浓度为1 mg/mL的抗体溶液以0.1 mL/min的流速上样至流出口浓度为原料液的10%,根据下式计算得到多肽亲和介质的动态吸附容量(DBC).

式中:cp为hIgG的初始浓度,mg/mL;Vp为出口处蛋白浓度达到初始浓度的10%时消耗的hIgG溶液体积,mL;Vb为层析柱床层体积,mL;Vh为系统死体积,mL.
稳定性评价:将多肽亲和介质填装于Ominifit 006BCC-03-05FF层析柱中,用浓度为1 mg/mL的抗体溶液以0.2 mL/min的流速上样,然后用0.1 mol/L NaOH溶液以0.5 mL/min进行原位清洗,每原位清洗2 h进行一次上样,如此循环,测定经过12 h后亲和介质吸附抗体的DBC变化.
1.2.4 多肽亲和介质对实际体系的分离效果
将亲和介质填装于1 mL TricornTM5/50层析柱中,以人血清和细胞培养上清液为原料,测定介质的分离效果,具体步骤如下.
(1) 原料预处理:取2 mL原料液加入适量的平衡缓冲液混合均匀,过膜后加入到超滤管中离心,用平衡缓冲液补满超滤管后再次离心,经过多次上述过程,将料液中的缓冲液替换为抗体容易吸附的结合缓冲液.
(2) 利用ÄKTA purifier蛋白纯化层析仪,以0.2 mL/min的流速上样2 mL.收集穿透峰、洗脱峰和再生峰,用TSKG3000层析柱进行测定,并根据下式计算得到抗体的纯度(P)和回收率(R).

式中:S1为洗脱液中抗体的峰面积;S为洗脱液中所有蛋白的峰面积之和;S0为料液中抗体的峰面积;V与V1分别为进样体积和洗脱液体积,mL.
1.2.5 多肽亲和介质的可重复利用性评价
考虑到实际的分离体系中组分复杂,影响因素更多,将多肽亲和介质填装于Ominifit 006BCC-03-05FF层析柱中,以人血清为分离体系,测定了多肽亲和介质经过40次循环后的DBC值变化.具体步骤为:以0.2 mL/min的流速上样8 mL,再以0.5 mL/min的流速洗脱8 mL和再生8 mL,然后再次用5 mL的平衡缓冲液冲洗至基线平稳,将上述流程定义为一个循环.首先,用配制的1 mg/mL的抗体溶液测定第1次的DBC值,然后用稀释的血清进行5次上述循环后,再次用配制的抗体溶液测定多肽亲和介质吸附 抗体的DBC值,如此测定了经过40次循环后的DBC值.
2 结果与讨论
2.1 多肽耐酶稳定性
为了评估L型和D型多肽配基的酶稳定性,本文选取了对含有芳香族氨基酸的蛋白有较强降解能力的α-糜蛋白酶来降解两种亲和配基,其结果如图2所示.从图中可以看出:随着孵育时间的延长,L型多肽配基迅速被酶水解,当孵育时间达到8 h时,溶液中剩余的完整的L型多肽配基的含量不足50%,而D型多肽配基被降解的速率相对较慢,当时间达到8 h时,仅不到10%的D型多肽配基被酶降解.Verdoliva等[17]合成了L型和D型四聚三肽配基PAM,在3 h内,D-PAM降解了3%左右,而L-PAM几乎完全被降解.本实验结果与之相似,说明D型多肽配基对酶降解的稳定性更好,更利于提高层析的使用寿命.

图2 多肽配基耐α-糜蛋白酶稳定性Fig.2 Resistance of peptide affinity ligands to αchymotrypsin
2.2 多肽亲和介质性能评价
制备价格低廉、选择性好又稳定性高的亲和介质是突破抗体纯化效率低下瓶颈的关键.吸附等温线是表征亲和介质对目的蛋白吸附能力的重要参数.本文合成了配基修饰密度为31 μmol/mL的两种多肽亲和介质,并测定了不同pH值缓冲液中hIgG于两种多肽亲和介质上的吸附等温线,结果如图3所示.从图中可以看出,随着pH值升高,多肽亲和介质的抗体吸附量增加并在pH=6.0下达到最大值;随着pH值进一步升高,抗体吸附量降低.这一趋势同样反映在表1中抗体吸附的qm值上.其中,抗体在D型多肽亲和介质上具有更高的吸附量qm,在pH=6.0时吸附容量达到129.8 mg/mL.该结果与文献[10]报道的结果相近,同时其明显高于商品化蛋白A色谱介质和其他多肽亲和介质的抗体吸附容量[17-19].表1的结果进一步显示,D型多肽亲和介质上抗体的解离常数更大,反映出抗体与D型多肽亲和介质的亲和性下降.此外,测定了牛血清白蛋白(BSA)在pH=6.0条件下于多肽亲和介质上的吸附等温线,发现BSA几乎不吸附(数据未显示).
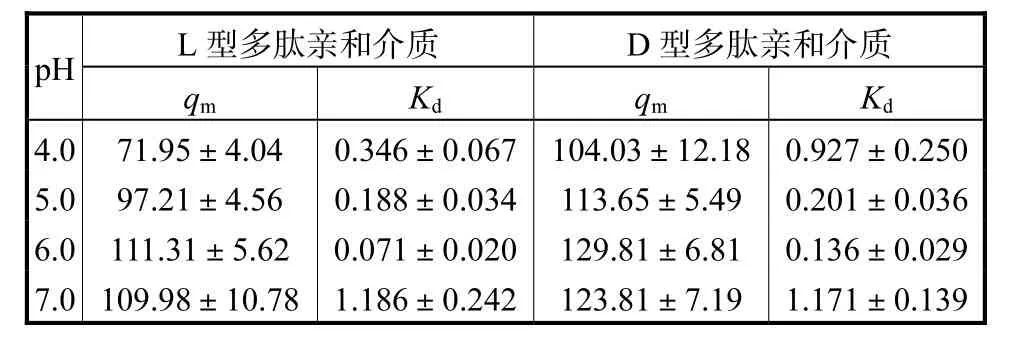
表1 不同pH值下多肽亲和介质上抗体吸附的Langmuir参数Tab.1 Langmuir parameters of antibody adsorption on peptide affinity chromatography at different pH values mg/mL
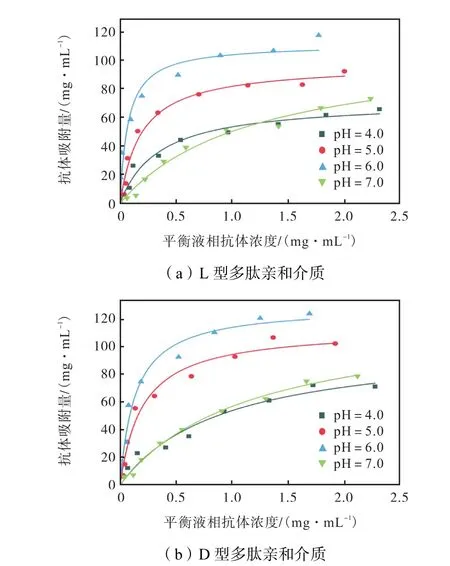
图3 不同pH值下hIgG在多肽亲和介质上的吸附等温线Fig.3 Adsorption isotherms of hIgG on peptide affinity chromatography at different pH values
进一步探究了抗体在pH=6.0条件下于两种多肽亲和介质上的色谱穿透行为,结果如表2所示.在0.1 mL/min流速(84 cm/h)下,L型与D型多肽亲和介质吸附抗体的DBC值分别达到了28.5 mg/mL和36.1 mg/mL.虽然抗体的DBC值随着流动相流速升高而逐渐降低,但即便在常规色谱操作流速(0.3~0.5 mg/mL)下D型多肽亲和介质仍展现出与商品化蛋白A色谱介质接近的动态吸附容量[20].此外,在相同流速下D型较L型亲和介质具有更高的抗体DBC值,进一步反映出D型亲和介质在抗体纯化中的优势及商业化应用潜力.

表2 不同流速下抗体在多肽亲和介质上的DBCTab.2 Dynamic binding capacities of antibody in peptide affinity chromatograp hy at different flow rates
2.3 实际体系分离效果
为了进一步验证仿生多肽亲和介质的分离效果,本文进行了从细胞培养上清液中纯化单克隆抗体(mAb)和从人血清中纯化hIgG的实验,结果如图4所示.原料的SEC-HPLC和SDS-PAGE结果反映出来源不同的人血清和细胞上清液存在着巨大的成分差异.在色谱分离的过程中,无论是人血清还是细胞上清液穿透样品的电泳条带中均未发现抗体成分,说明D型多肽亲和介质具有良好的抗体吸附能力以及选择性.基于图4的SEC-HPLC结果计算可得,mAb的纯度大于98%,回收率为94.97%,这与图4(d)电泳结果相吻合,纯化效果与文献报道的仿生多肽配基HWRGWV[18](P>94%,R>84%)和YFKFD[21](P>93%,R>86%)相当,也与蛋白A色谱纯化抗体的结果基本相当[22].从人血清中纯化hIgG的实验中, hIgG的纯度为91.37%,回收率为85%左右,这与图4(c)电泳结果中洗脱条带存在痕量杂质的情况一致.分离效果与配基FYE-ABI[23](P>93.9%,R>88.9%)相当,显著优于Reese等[24]利用Protein A和Protein G色谱介质从人血清中分离抗体的收率(68.1%和40.6%)及其他课题组的相关报道结果[25]. 说明该配基具有从复杂的生物样品中分离hIgG的潜力.比较两种体系的分离效果,不难发现,从血清中纯化hIgG的纯度和回收率都低于从细胞培养上清液中纯化的mAb的纯度和收率,从SEC-HPLC中可以进行这样的推测,在11.2 min之前出现的几个较低的峰可能是抗体的其他亚型,而该多肽亲和配基对抗体的多种亚型都具有亲和力,不能在该洗脱条件下实现各个抗体亚型之间的分离,这种现象在其他短肽和蛋白A的亲和纯化中也都存在.Liu等[26]制备了3种短肽(HWRGWV、HYFKFD和HFRRHL)亲和介质,发现其与hIgM、hIgA和hIgG都可以结合,并且通过改变洗脱缓冲液的pH值,实现了hIgG与其他两种抗体的分离.Reese等[24]利用蛋白A亲和介质完成了IgG和IgM的纯化,说明其对抗体的多种亚型都具有亲和力.

图4 D型多肽亲和介质从人血清和细胞培养上清液中分离抗体的SEC-HPLC和SDS-PAGE结果Fig.4 SEC-HPLC and SDS-PAGE results of the isolation of antibodies from human serum and cell culture supernatant with D-type peptide affinity chromatography
2.4 重复利用性
通过将两种多肽配基与α-糜蛋白酶共同孵育,证明了D型多肽配基较L型多肽配基具有更高的酶稳定性,但此实验中影响亲和配基稳定性的因素比较单一,在实际的分离体系中,体系组分复杂,可能产生影响的因素也比较多.因此,本节以人血清为原液,模拟真实体系中的分离纯化步骤,测定了经过40次循环后,多肽亲和介质吸附抗体的DBC值变化,更真实地评价了亲和介质的可重复利用性,实验结果如图5所示.从图中可以观察到,经过40次循环后,两种亲和介质的DBC都有不同程度的降低,横向比较L型和D型多肽亲和介质吸附性能的变化,在经历 了40次循环后L型多肽亲和介质的DBC下降了14.51%,而D型多肽亲和介质的DBC仅下降了5.92%,这与此前D型多肽配基具有更好的酶降解耐受性的结论一致,说明D型多肽亲和介质比L型多肽亲和介质更加稳定,在使用寿命内的价值更高.

图5 40次循环穿透实验后多肽亲和介质的DBC变化Fig.5 Changes in the DBC of the peptide affinity chromatography over 40 cycles of breakthrough experiments
在室温环境下,通过用0.1 mol/L的NaOH溶液对两种多肽亲和介质进行了12 h的原位清洗,每隔2 h测定一次介质吸附抗体的DBC值,根据DBC的变化确定其碱稳定性,实验结果如图6所示.不难发现,随着原位清洗时间的增长,两种介质吸附抗体的DBC值都呈现出逐渐降低的趋势,经过了12 h后,DBC值降低的比率均保持在一个较低的范围(<8%).此前Linhult等[27]报道了蛋白A介质在0.1 mol/L NaOH溶液中浸泡7.5 h导致其DBC值下降超过70%.葛佳等[28]以FYEILHC为亲和配基,采用0.1 mol/L NaOH为再生溶液,经过40个循环后,吸附容量未见明显变化,说明短肽类配基确实具有较好的碱稳定性.横向对比两种多肽亲和介质,L型多肽亲和介质的DBC值下降速率略高于D型多肽亲和介质,说明D型多肽亲和介质对碱的耐性更加 稳定.

图6 0.1 mol/L NaOH溶液原位清洗时间对多肽亲和介质吸附能力的影响Fig.6 Effect of in situ cleaning time of 0.1 mol/L NaOH solution on the adsorption capacity of peptide affinity chromatography
3 结论
以对映体天然氨基酸组成的短肽FYWHCLDE为配基,Sepharose 6FF为基质,制备了用于抗体分离纯化的多肽亲和介质,并对多肽配基的酶稳定性、多肽亲和介质的碱稳定性和对实际体系的分离效果进行了测定,得到了如下结论.
(1) 与α-糜蛋白酶共同孵育8 h后,L型多肽配基被降解了54.72%,而D型多肽配基仅被降解了8.5%,显示出了较高的酶稳定性.
(2) 从人血清中纯化抗体获得了91.37% 的纯度和85% 的回收率,从细胞培养上清液中纯化mAb获得了98% 的纯度和94.97% 的回收率,说明短肽亲和介质具有从复杂的体系中分离抗体的能力,但不具备分离不同亚型抗体的能力.
(3) 制备的亲和介质经0.1 mol/L NaOH原位再生12 h后,吸附抗体的DBC值降低了不到8%,以人血清为原料,经过40次循环后,吸附抗体的DBC值降低了5.92%,说明D型多肽亲和介质具有良好的碱稳定性和可重复利用性.
