42日龄如皋黄鸡体重间接遗传效应分析
2022-10-31郭军王克华韩威窦套存王星果胡玉萍马猛曲亮
郭军,王克华,韩威,窦套存,王星果,胡玉萍,马猛,曲亮
42日龄如皋黄鸡体重间接遗传效应分析
郭军,王克华,韩威,窦套存,王星果,胡玉萍,马猛,曲亮
江苏省家禽科学研究所,江苏扬州 225125
【目的】动物个体遗传物质除了调控自身表型之外,还通过资源分配或行为互动影响同伴性能表现,称之为间接遗传效应。畜禽选育时,遗传模型如果包含了间接遗传效应,不仅有利于改善个体间社会关系,还可以获得更多的遗传进展。研究以饲养于群体笼内如皋黄鸡为试材,以间接遗传模型评估体重数据,旨在为如皋黄鸡选育提供支持。【方法】体重数据采集自如皋黄鸡选育群体,试验鸡于42日龄称重,收集原始数据11 983条。数据清洗包括去除超出三倍标准差的离群值、去除翅号遗失个体、去除性别不明个体以及去除单笼养殖量少于4只的记录。系谱数据包含12 208只鸡:11 735只鸡有体重记录,473只鸡没有体重记录;10 560只鸡没有后代,1 648只鸡有后代,其中种公鸡208只,种母鸡1 440只。以SPSS软件中的单因素方差分析检验环境因素对体重的影响,确定列入固定效应的因子。应用经典动物模型、间接遗传模型分析如皋黄鸡早期体重方差组分及遗传参数,并检验间接遗传方差是否存在稀释效应。遗传模型中包括一般固定效应、固定回归项、加性遗传效应、间接遗传效应、共同环境效应以及残差。研究中,以单笼养殖量作为固定回归项,将加性遗传效应、间接遗传效应、共同环境效应列为随机项。稀释参数起始值设定为0,依次以0.1幅度递增至1.0,经AIC、BIC筛选,稀释参数宜设定为0。由于残差异质化处理没有改变遗传参数和方差组分,因此残差做同质化处理。以WOMBAT软件分析方差组分及遗传参数,计算结果达到收敛标准。【结果】影响如皋黄鸡体重的固定效应包括批次、层级、性别;42日龄如皋黄鸡体重受间接遗传效应影响,加性遗传力为0.54±0.02,总遗传力为0.66±0.06;同笼如皋黄鸡个体间以互助关系为主,加性遗传与间接遗传选择方向一致,遗传相关系数为0.41;育成期如皋黄鸡间接遗传方差不存在稀释效应;如皋黄鸡公鸡与母鸡间接遗传效应表现不同,遗传力、遗传相关系数也存在明显差异。【结论】间接遗传模型可用于蛋鸡早期体重遗传评估及选育。相比于传统动物模型,间接遗传模型可以额外获得遗传进展。
如皋黄鸡;遗传力;间接遗传效应;体重;互助行为
0 引言
【研究意义】间接遗传效应,也称社会遗传效应,是指动物个体遗传物质不仅调控自身性状表现,还通过行为互动或资源分配影响同伴的表型值[1-2]。畜禽间接遗传效应可以通过分析影像资料或传感器数据直接度量,如蛋鸡啄羽行为、猪咬尾行为以及貂争斗行为,但收集数据需要耗费大量时间和财力。除了直接测量行为性状外,还可以通过混合线性模型分析系谱数据和目标性状表型值,获得间接遗传参数,并进行遗传选育[3-4]。如皋黄鸡作为优良的兼用型鸡种,于2009年经国家畜禽遗传资源委员会鉴定,列入国家畜禽遗传资源[5]。体重是衡量畜禽群体整齐度的重要指标,也是决定饲料消耗、影响生产成本的关键因素[6]。42日龄体重是肉鸡的主选性状,兼用型鸡种、蛋鸡同样重视育成鸡选育[7-9]。笔者团队前期以绿壳蛋鸡为研究对象,分析了1—9周龄蛋鸡体重遗传力及重复力[10]。本研究以如皋黄鸡为研究对象,应用动物模型-BLUP方法定量分析间接遗传效应对体重表型方差的贡献。【前人研究进展】近年来,间接遗传效应分析成为畜禽遗传评估研究热点之一。国内外多个团队针对不同物种、不同性状应用个体动物模型开展间接遗传效应分析。HERRERA‑CÁCERES等针对西班牙杜洛克猪日增重、背膘厚以及饲料报酬进行遗传评估,发现间接遗传效应对目标性状有着重要影响,育种选育时应充分考虑间接遗传效应以及性状间遗传相关、方向[4]。ASK等对丹系长白猪日增重性状进行遗传评估,分析结果表明遗传模型考虑间接遗传效应以后可提高遗传方差占比[11]。同样针对日增重性状,PILES等以家兔为研究对象,对比分析了限饲与自由采食两种条件下加性遗传效应、间接遗传效应的变化趋势,结果表明间接遗传方差与饲养方式有关[12]。该团队还以纵向数据方式(longitudinal data)研究家兔的间接遗传效应,表明家兔断奶期间接遗传方差大于育肥期间接遗传方差[13]。遗传模型纳入间接遗传效应将提高选择反应和预测能力[4,14]。除了家畜外,育种工作者也针对家禽开展了间接遗传效应评估研究。ELLEN等以荷兰汉德克动物育种集团白来航蛋鸡为素材,针对同类相残这一福利问题,应用动物模型评估间接遗传与加性遗传的关系,结果表明间接遗传效应对总遗传方差有一定贡献,间接遗传模型应用潜力较大[15]。MUIR等选育鹌鹑时考虑了间接遗传效应,有效解决同类相残、争斗行为等动物福利问题[3]。综上所述,多个研究团队应用不同的研究手段证明间接遗传效应可用于畜禽遗传育种。【本研究切入点】然而,目前我国蛋鸡育种工作很少考虑间接遗传效应或进行相关研究。畜禽育种工作就是让动物个体产出更多更好的产品,传统的育种方式是个体选育,很少考虑动物个体之间的相互作用[16]。如前文所述,遗传分析试验表明间接遗传效应广泛存在于畜禽生产中,而且这种遗传效应常常与加性遗传效应呈负相关,育种工作如果忽视间接遗传效应将会降低选择准确率,进而影响畜禽遗传选育。为了减少养殖成本,育雏育成期蛋鸡多以群体笼饲养,是分析间接遗传效应理想模型[17]。【拟解决的关键问题】本研究以如皋黄鸡选育群体为试验材料,检验间接遗传效应对42日龄体重的影响并估计遗传力。为如皋黄鸡选育提供数据支持。
1 材料与方法
1.1 试验动物
原始数据采集自江苏省家禽科学研究所如皋黄鸡选育群,包括2017年至2019年3代6批称重记录以及系谱数据。试验鸡饲养于密闭式育雏鸡舍,育雏期第1周保持24 h光照,从第2周起以每周减少1 h的速度将光照时长调整至每天9 h。育雏期间以热风炉、电热棒升温,夏季高温期以风机、湿帘降温。育雏育成笼分为4层,每个育雏育成笼最多饲养8只雏鸡,有的个体因伤病淘汰或死亡,育雏育成笼不再补充雏鸡。雏鸡饲料来自中粮公司,自由采食,以乳头饮水器供水,以行车式喂料机供给饲料,以鸡粪传送带清粪,以电子天平称重。称重前夜中断饲料供给。
1.2 数据处理
如皋黄鸡体重原始数据共有11 983条记录,其中2017年收集3 298条,2018年收集3 472条,2019年收集5 213条。去除翅号遗失的4条个体记录,去除异常值(超出或低于体重平均值3倍标准差的56条记录)。有的育雏育成笼数据少于4条记录,或是因为称量时遗漏缺失,或是因为试验鸡已经淘汰或死亡,或是因为数据清洗时去除,这些异常记录将导致分析结果出现偏差,因而删除单笼养殖量低于3条记录(包括3条)的188条数据。经数据清洗,如皋黄鸡体重数据包括11 735条记录。以R语言环境下ggplot2软件包、gridExtra软件包绘制如皋黄鸡42日龄体重箱线图[18]。
以IBM SPSS Statistics 21软件分析批次、性别、育雏育成笼所在层效应对如皋黄鸡体重平均值的影响,确定列入动物模型固定效应的因素。应用WOMBAT软件,以随机回归模型分析方差组分,并计算遗传参数[19]。以间接遗传效应、间接遗传效应与加性遗传效应协方差结构、稀释参数为区分标准,建立3个动物模型:
模型Ⅰ:=+Za+ZP+;
模型Ⅱ:=+Za+Za+ZP+……=0,σ≠0;
模型Ⅲ:=+Za+Za+ZP+……≠0,σ≠0。
式中数学期望:()=,(a)=0,(a)=0,(P)=0,()=0。

式中方差:y是42日龄如皋黄鸡体重表型值向量。X、ZD、ZS、Zc分别是固定效应、加性遗传效应、间接遗传效应以及共同环境效应的关联矩阵,ZD、ZS亲缘关系矩阵由系谱数据获得。aD、aS、Pc、e分别是加性遗传效应、间接遗传效应、共同环境效应以及残差效应的向量。σDS是间接遗传效应与加性遗传效应协方差。是稀释参数,间接遗传方差(或选择反应)与同居伙伴数量有关,伙伴数量越多间接遗传效应越小。稀释参数是衡量遗传方差与群体大小的依存程度,表示间接遗传效应与单笼饲养只数不存在关联,表示间接遗传效应与单笼饲养只数呈负相关。
进一步地,通过上述模型可获得一系列参数。总育种值是指个体动物的总遗传效应值,可表述为:
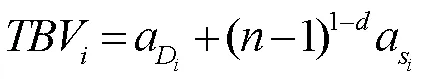
相应地,总育种值方差可表述为:
表型方差表述为:
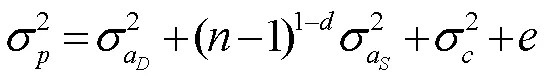
与遗传力(h2)对应的总遗传力(τ2)为:
模型选择依据两个信息准则,即赤池弘次信息准则(Akaike’s information criterion,AIC)和贝叶斯信息准则(Bayesian Information Criterion,BIC)。优先选择AIC、BIC值偏小的子模型。
2 结果
2.1 影响体重的非遗传因素
鸡的体重属于数量性状,具有正态分布特征,除遗传因素之外,环境也是影响体重表型值的重要因素。批次之间饲养管理、营养水平、温湿度条件存在差异,经SPSS单因素方差分析,各批次体重平均值存在显著差异(图1-C)。第24、25批次分别是2017年6月20日、27日出雏,第26、27批次分别是2018年7月26日、8月2日出雏,第28、29批次分别是2019年8月30日、9月12日出雏。育雏育成笼所在层影响42日龄如皋黄鸡体重表型值。如图1-B所示,体重中位数排列顺序依次为L3>L2>L4>L1,L1层位于最上层,受纵向通风影响较大,L4层位于最底层,光照强度较弱、湿度大且与粪便距离近。相对而言,最上层、最底层养殖环境较差因此养殖于L1、L4层的试验鸡体重平均值较小。如图1-A所示,性别影响体重平均值。性别不同,内分泌激素种类与表达量存在不同,因而影响肌肉、骨骼以及脂肪生长发育。综合考虑,如皋黄鸡体重遗传评估时将批次、层级以及性别因素列入固定效应。
2.2 稀释参数
稀释参数具有性状特异性和物种特异性,针对如皋黄鸡间接遗传效应稀释参数,以线性混合模型进行遗传评估。由表1可知,如皋黄鸡选育群体单笼饲养只数存在差异,然而线性回归分析其与42日龄体重的关系,所得2接近于0,表明两者呈现随机状态,也就是体重与单笼饲养只数不存在线性关系。由表2可知,不同稀释参数对应的遗传子模型信息准则,包括赤池弘次信息准则(Akaike Information Criterion,AIC)和贝叶斯信息准则(Bayesian Information Criterion,BIC),相差较小。由表3可知,不同稀释参数对应遗传子模型解析的狭义遗传力、加性遗传方差以及总遗传力相差不大。鉴于以上3点,遗传评估模型宜忽略单笼饲养只数对遗传效应的影响,即稀释参数设定为0。

图1 42日龄如皋黄鸡体重
Fig.1 Body weight at 42 day-olds of Rugao Yellow Chickens
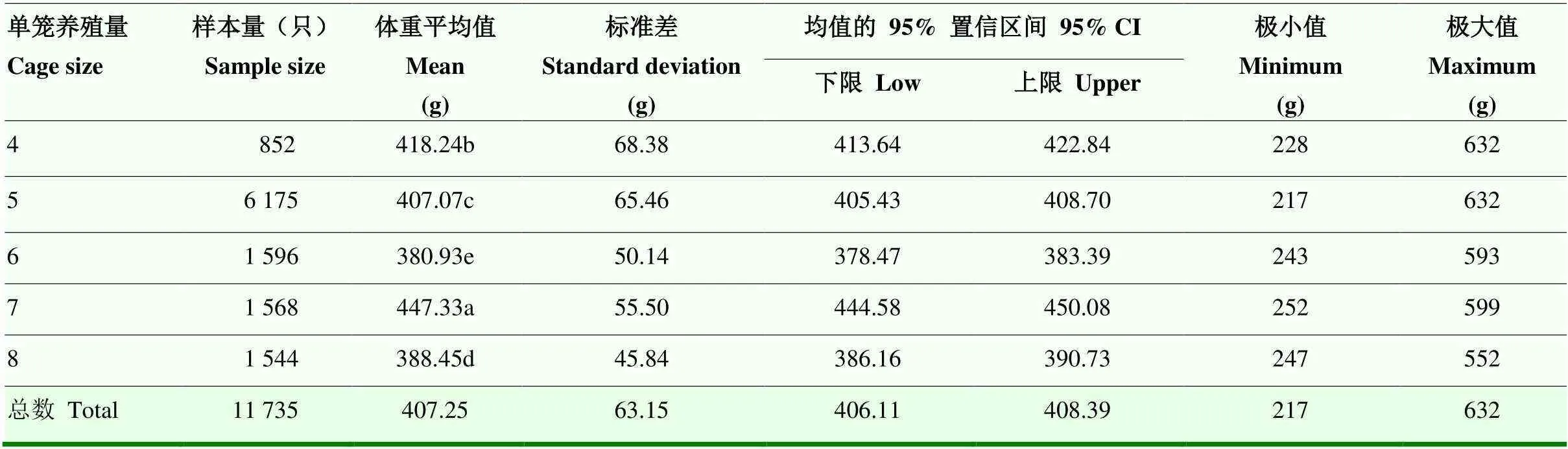
表1 以单笼养殖量统计42日龄如皋黄鸡体重
2.3 性别对遗传参数的影响
以性别作为固定效应,经典模型与间接遗传效应模型解析的狭义遗传力相差不大,然而后者剖分出间接遗传方差,且以同伴数累加的方式归并到总育种值方差,因而间接遗传模型获得更多的总遗传力(表3)。加性-间接遗传效应遗传存在中等相关,表明同笼个体间以互助关系为主。将公鸡体重与母鸡体重作为两个性状进行间接遗传效应分析,两者遗传力、遗传方差存在不同,且母鸡加性-间接遗传相关程度更紧密(表3)。
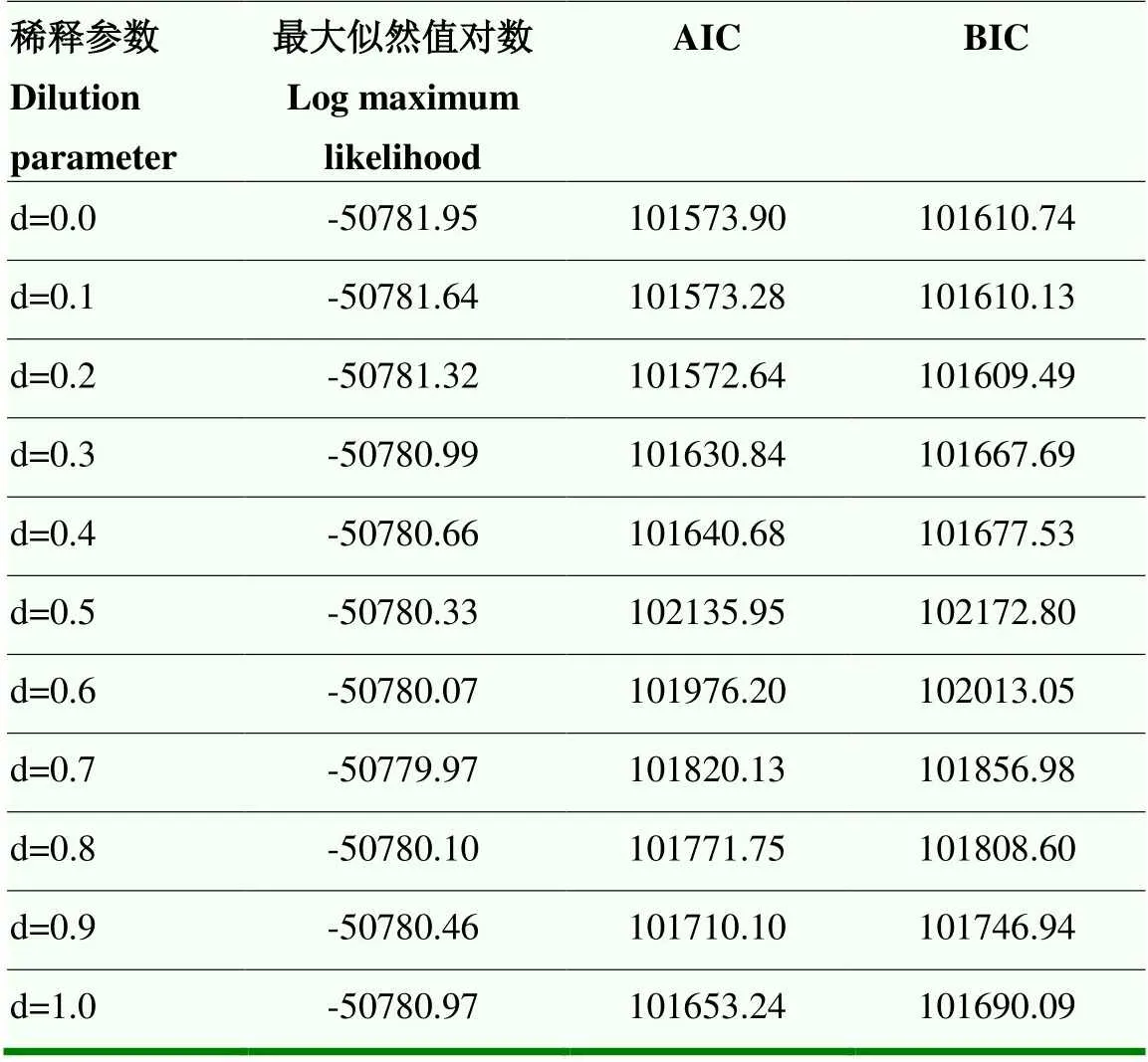
表2 间接遗传效应亚模型信息准则参数
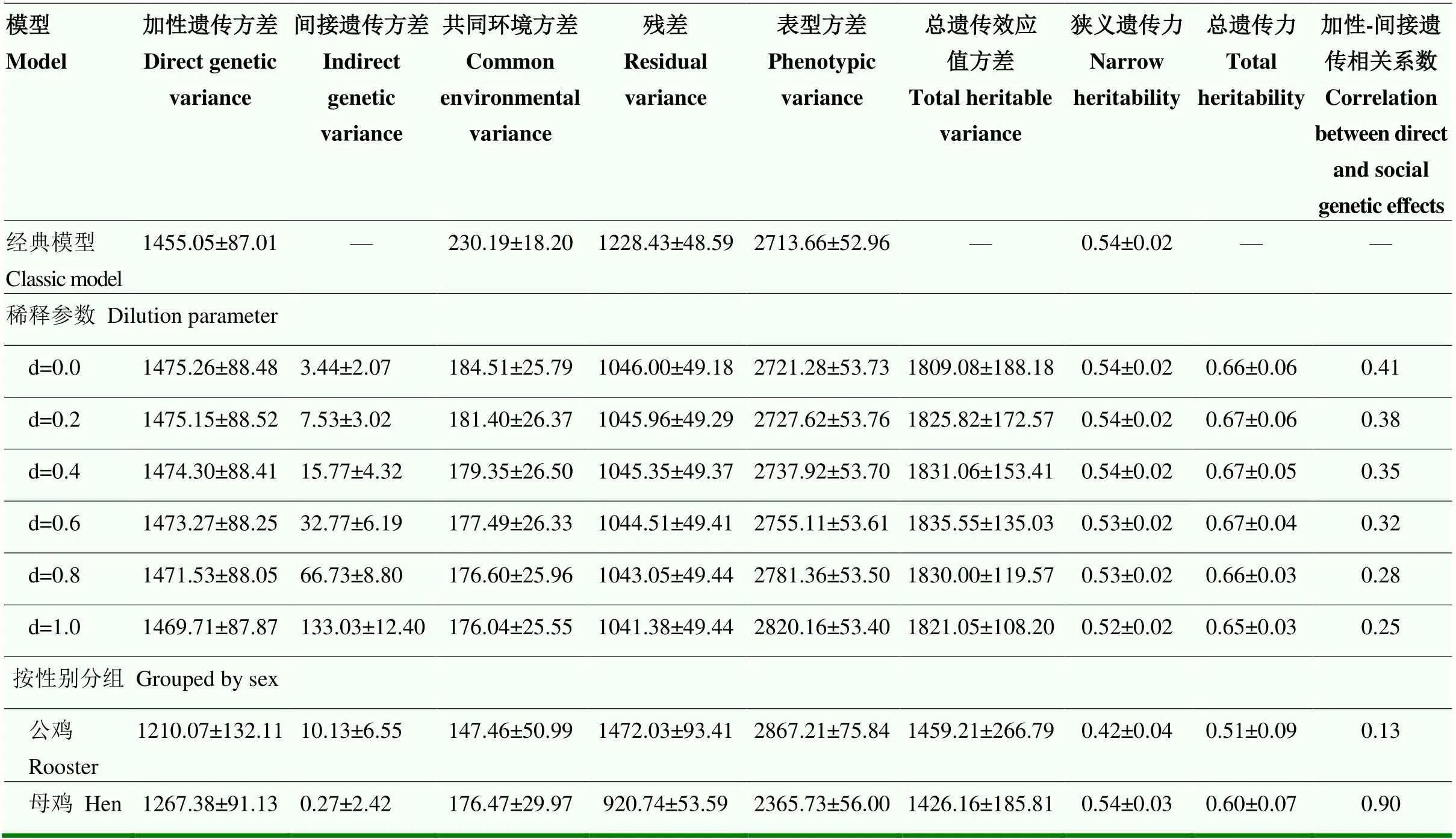
表3 42日龄如皋黄鸡体重方差组分和遗传参数
3 讨论
商品蛋鸡生产中,育雏鸡和产蛋鸡大多养殖在群体笼内。当蛋鸡以群体方式进行笼养时,涉及到等级划分、资源分配问题,还涉及到同伴间的竞争与合作,然而蛋鸡育种实践中往往忽略间接遗传效应。在蛋鸡遗传评估中引入间接遗传模型,可以获得两组育种值,一组为加性遗传效应对应的传统育种值,另一组为间接遗传效应对应的新育种值,两者经过选择指数整合为综合育种值,从而淘汰不利于同伴生长的个体,达到提高群体笼整体生产水平的目的。从总遗传力高于狭义遗传力22%可知,应用间接遗传模型将使遗传进展进一步提高[20-21]。
3.1 遗传相关系数
本研究以42日龄如皋黄鸡体重为目标性状,在自由采食条件下获得遗传参数。加性遗传方差与间接遗传方差呈正相关,表明同笼个体间以可遗传的互助行为为主[22]。因为饲料、饮水等资源供应充足,同伴间竞争关系未表现出来,反而相互间识别互助、抱团取暖[23]。与之相反,在限制饲料供给条件下,家猪之间互相争斗,争夺社会地位和资源,加性遗传效应与间接遗传效应为负遗传相关[11,24]。同样在资源限制条件下,中国对虾表现为竞争关系,加性遗传效应与间接遗传效应相关系数为-0.495±0.184[25]。遗传分析人工养殖的贻贝生长性状,表明个体间存在可遗传的竞争关系[26]。年龄也是影响加性-间接遗传相关系数的重要因素,随着年龄的增加,蛋鸡个体间争斗、啄羽行为频次逐渐增加。对产蛋期白来航鸡存活率进行遗传评估,结果表明加性遗传效应与间接遗传效应呈负遗传相关[15]。除资源、年龄影响加性-间接遗传效应相关系数外,物种也应列入影响因素之列。同样针对动物福利性状的间接遗传效应分析,与蛋鸡间互相伤害相反,人工养殖条件下的貂个体间表现为互相帮助,加性-间接遗传相关系数高达0.80[27]。总之,加性-间接遗传相关系数是反映社会交互行为强弱、方向的重要指标。单从蛋鸡体重选育角度考虑,42日龄如皋黄鸡体重加性遗传与间接遗传选择方向一致。针对间接遗传效应做出选择有利于取得更多的遗传进展,同时也有利于改善动物福利。
3.2 性别对间接遗传效应的影响
传统畜禽育种工作常常忽略间接遗传效应,仅关注遗传和环境对动物自身生产性能的影响。如皋黄鸡体重遗传评估结果表明,间接遗传效应对总遗传方差做出重要贡献。公鸡与母鸡间接遗传方差、总遗传力以及遗传相关系数均存在不同,主要归因于社会交互行为方面的不同。母鸡往往表现出胆小懦弱,公鸡表现为自信刚强,两者在觅食、栖居、恐惧应激等行为表现存在显著差异[28-29]。当鸡群进入性成熟期,公鸡将为建立社会秩序而争斗,加性-间接遗传关系的方向及幅度将发生改变。因而未来有必要针对性成熟如皋黄鸡开展间接遗传效应评估。ALEMU等以混合线性模型分析了笼养貂的间接遗传效应,发现公貂与母貂间接遗传参数存在不同[27]。此外,家猪上的研究也证明间接遗传效应存在性别差异[24]。以上研究结果对改良地方鸡种的启示是遗传评估应依据性别分别解析间接遗传效应。
3.3 稀释参数
本研究还评估了如皋黄鸡间接遗传方差是否存在稀释效应。有研究表明间接遗传方差保持相对稳定,当同伴数量由少增多时,个体分摊的间接遗传方差将减少,也就是间接遗传方差被稀释[17]。CANARIO等研究了瑞典大白猪日增重,发现模型配置稀释参数可提高的拟合度[30]。同样以猪日增重为遗传评估对象,NIELSEN等没有发现间接遗传方差被同伴数量稀释[31]。POULSEN等评估了丹系长白猪生长速率,未发现间接遗传方差的稀释效应[32]。在本研究中,当遗传模型嵌入稀释参数没有提高拟合度,遗传力、遗传方差等参数几乎没有改变。由此得出,42日龄如皋黄鸡体重间接遗传方差不受稀释效应影响。探究其原因,归纳为两点:1)物种差异影响稀释效应的表现。如果同伴之间互相竞争资源或空间,例如家猪和一些水产物种,间接遗传方差存在稀释效应。对育成鸡而言,同伴间多表现为互相帮助。例如,即便以单笼饲养育成鸡,只要有一只鸡开始采食,周围笼的鸡只往往跟着进食[23]。这种进食方式不会随着同笼伙伴数量变化而变化,即信号不会被稀释。2)研究中,单笼饲养量只有4—8只,变异幅度较小,或许未达到检出稀释效应的标准。育成期家猪单圈养殖量在2—15头,水产生物养殖密度高、单群养殖量变异幅度大,因而可以检测到稀释效应。为确定蛋鸡体重间接遗传方差是否存在稀释效应,今后可重新设计试验,增加单笼养殖量变异幅度,也可将自由采食改变为限制饲料供给。
4 结论
BLUP理论在改良畜禽生产性能方面取得重要进展,其应用层面不断向新性状、新模型、新算法拓展。间接遗传模型是新近涌现的遗传评估方法,该模型着眼于群体生产性能,利用动物个体可遗传变异改变同伴表型值。本研究应用间接遗传模型评估如皋黄鸡体重,结果表明:1)42日龄如皋黄鸡体重受间接遗传效应影响,相比于经典动物模型,间接遗传模型可以额外获得遗传进展;2)同笼如皋黄鸡个体间以互助关系为主,加性遗传与间接遗传选择方向一致,遗传相关系数为0.41;3)育成期如皋黄鸡间接遗传方差不存在稀释效应;4)如皋黄鸡公鸡与母鸡间接遗传效应表现不同,遗传力、遗传相关系数也存在明显差异。后续研究可将评估对象从育成鸡延伸到成年鸡,分析年龄变化对遗传参数的影响;也可将评估对象拓展到不同的地方鸡种,以利于挖掘我国地方鸡种优异资源;还可针对新性状解析间接遗传方差及遗传参数。
[1] BIJMA P, MUIR W M, VAN ARENDONK J A M. Multilevel selection 1: Quantitative genetics of inheritance and response to selection. Genetics, 2007, 175(1): 277-288. doi:10.1534/genetics.106. 062711.
[2] MUIR W, SCHINCKEL A. Incorporation of competitive effects in breeding programs to improve productivity and animal well being//7th World Congress on Genetics Applied to Livestock Production. Montpellier, France, 2002: 14-07.
[3] MUIR W M, BIJMA P, SCHINCKEL A. Multilevel selection with kin and non-kin groups, experimental results with Japanese quail (coturnix japonica). Evolution, 2013, 67(6): 1598-1606. doi:10.1111/ evo.12062.
[4] HERRERA-CÁCERES W, SÁNCHEZ J P. Selection for feed efficiency using the social effects animal model in growing Duroc pigs: Evaluation by simulation. Genetics, Selection, Evolution: GSE, 2020, 52(1): 53. doi:10.1186/s12711-020-00572-4.
[5] 国家畜禽遗传资源委员会组. 中国畜禽遗传资源志-家禽志. 北京: 中国农业出版社, 2011.
National Livestock and Poultry Genetic Resources Committee. Animal Genetic Resources in China. Beijing: Chinese Agriculture Press, 2011. (in Chinese)
[6] SCHMIDT-NIELSEN K S. Scaling: Why is Animal Size So Important? New York: Cambridge University Press, 1984.
[7] THIRUVENKADAN A K, PRABAKARAN R, PANNEERSELVAM S. Broiler breeding strategies over the decades: An overview. World’s Poultry Science Journal, 2011, 67(2): 309-336. doi:10.1017/ S0043933911000328.
[8] MUIR W M, AGGREY S E. Poultry Genetics, Breeding and Biotechnology. Wallingford: CABI, 2003. doi:10.1079/9780851996608. 0000.
[9] 党李苹, 周雯馨, 刘瑞芳, 白云, 王哲鹏. 略阳乌鸡体重和产蛋数性状遗传参数估计. 中国农业科学, 2020, 53(17): 3620-3628. doi:10.3864/j.issn.0578-1752.2020.17.018.
DANG L P, ZHOU W X, LIU R F, BAI Y, WANG Z P. Estimation of genetic parameters of body weight and egg number traits of Lueyang black-boned chicken. Scientia Agricultura Sinica, 2020, 53(17): 3620-3628. doi:10.3864/j.issn.0578-1752.2020.17.018. (in Chinese)
[10] 郭军, 曲亮, 窦套存, 王星果, 沈曼曼, 胡玉萍, 王克华. 应用随机回归模型估计蛋鸡体重遗传参数. 中国农业科学, 2020, 53(11): 2297-2304. doi:10.3864/j.issn.0578-1752.2020.11.015.
GUO J, QU L, DOU T C, WANG X G, SHEN M M, HU Y P, WANG K H. Using random regression models to estimate genetic parameters on body weights in layers. Scientia Agricultura Sinica, 2020, 53(11): 2297-2304. doi:10.3864/j.issn.0578-1752.2020.11.015. (in Chinese)
[11] ASK B, CHRISTENSEN O F, HEIDARITABAR M, MADSEN P, NIELSEN H M. The predictive ability of indirect genetic models is reduced when culled animals are omitted from the data. Genetics, Selection, Evolution: GSE, 2020, 52(1): 8. doi:10.1186/s12711-020- 0527-x.
[12] PILES M, DAVID I, RAMON J, CANARIO L, RAFEL O, PASCUAL M, RAGAB M, SÁNCHEZ J P. Interaction of direct and social genetic effects with feeding regime in growing rabbits. Genetics, Selection, Evolution: GSE, 2017, 49(1): 58. doi:10.1186/s12711-017- 0333-2.
[13] DAVID I, SÁNCHEZ J P, PILES M. Longitudinal analysis of direct and indirect effects on average daily gain in rabbits using a structured antedependence model. Genetics, Selection, Evolution: GSE, 2018, 50(1): 25. doi:10.1186/s12711-018-0395-9.
[14] CHU T T, HENRYON M, JENSEN J, ASK B, CHRISTENSEN O F. Statistical model and testing designs to increase response to selection with constrained inbreeding in genomic breeding programs for pigs affected by social genetic effects. Genetics, Selection, Evolution: GSE, 2021, 53(1): 1. doi:10.1186/s12711-020-00598-8.
[15] ELLEN E D, VISSCHER J, VAN ARENDONK J A M, BIJMA P. Survival of laying hens: Genetic parameters for direct and associative effects in three purebred layer lines. Poultry Science, 2008, 87(2): 233-239. doi:10.3382/ps.2007-00374.
[16] WALSH B, LYNCH M. Evolution and Selection of Quantitative Traits. Oxford: Oxford University Press, 2018. doi:10.1093/oso/ 9780198830870.001.0001.
[17] HEIDARITABAR M, BIJMA P, JANSS L, BORTOLUZZI C, NIELSEN H M, MADSEN P, ASK B, CHRISTENSEN O F. Models with indirect genetic effects depending on group sizes: A simulation study assessing the precision of the estimates of the dilution parameter. Genetics, Selection, Evolution: GSE, 2019, 51(1): 24. doi:10.1186/ s12711-019-0466-6.
[18] VILLANUEVA R A M, CHEN Z J. ggplot2: Elegant Graphics for Data Analysis. 2nd ed. Measurement: Interdisciplinary Research and Perspectives, 2019, 17(3): 160-167. doi:10.1080/15366367.2019. 1565254.
[19] MEYER K. WOMBAT: A tool for mixed model analyses in quantitative genetics by restricted maximum likelihood (REML). Journal of Zhejiang University Science B, 2007, 8(11): 815-821. doi:10.1631/jzus.2007.B0815.
[20] BIJMA P. The quantitative genetics of indirect genetic effects: A selective review of modelling issues. Heredity, 2014, 112 (1): 61-69. doi:10.1038/hdy.2013.15.
[21] ELLEN E D, RODENBURG T B, ALBERS G A A, BOLHUIS J E, CAMERLINK I, DUIJVESTEIJN N, KNOL E F, MUIR W M, PEETERS K, REIMERT I, SELL-KUBIAK E, VAN ARENDONK J A M, VISSCHER J, BIJMA P. The prospects of selection for social genetic effects to improve welfare and productivity in livestock. Frontiers in Genetics, 2014, 5: 377. doi:10.3389/fgene.2014.00377.
[22] CHEN C Y, MISZTAL I, TSURUTA S, HERRING W O, HOLL J, CULBERTSON M. Influence of heritable social status on daily gain and feeding pattern in pigs. Journal of Animal Breeding and Genetics, 2010, 127(2): 107-112. doi:10.1111/j.1439-0388.2009.00828.x.
[23] BESTMAN M, RUIS M, HEIJMANS J, MIDDELKOOP K V. 马闯, 马海艳译. 蛋鸡的信号: 禽业养殖管理实用指南. 北京: 中国农业科学技术出版社, 2014.
BESTMAN M, RUIS M, HEIJMANS J, MIDDELKOOP K V. Layer Signals: A Practical Guide for Poultry-Oriented Management. Beijing: China Agricultural Science and Technology Press, 2014. (in Chinese)
[24] NIELSEN H M, ASK B, MADSEN P. Social genetic effects for growth in pigs differ between boars and gilts. Genetics, Selection, Evolution: GSE, 2018, 50(1): 4. doi:10.1186/s12711-018-0375-0.
[25] 仲伟鹏, 罗坤, 孟宪红, 陈宝龙, 隋娟, 孔杰, 曹宝祥, 邢群, 栾生. 限制投喂环境下中国对虾体重的间接遗传效应分析. 中国水产科学, 2018, 25(6): 1245-1251. doi:10.3724/SP.J.1118.2018.18015.
ZHONG W P, LUO K, MENG X H, CHEN B L, SUI J, KONG J, CAO B X, XING Q, LUAN S. An analysis of the indirect genetic effect on the body weight ofunder restrictive feeding conditions. Journal of Fishery Sciences of China, 2018, 25(6): 1245-1251. doi:10.3724/SP.J.1118.2018.18015. (in Chinese)
[26] BRICHETTE I, REYERO M I, GARCı́A C. A genetic analysis of intraspecific competition for growth in mussel cultures. Aquaculture, 2001, 192(2/3/4): 155-169. doi:10.1016/S0044-8486(00)00439-7.
[27] ALEMU S W, BERG P, JANSS L, BIJMA P. Estimation of indirect genetic effects in group-housed mink () should account for systematic interactions either due to kin or sex. Journal of Animal Breeding and Genetics, 2016, 133(1): 43-50. doi:10.1111/jbg.12163.
[28] NÄTT D, AGNVALL B, JENSEN P. Large sex differences in chicken behavior and brain gene expression coincide with few differences in promoter DNA-methylation. PLoS ONE, 2014, 9(4): e96376. doi:10. 1371/journal.pone.0096376.
[29] MOROI S, NISHIMURA K, IMAI N, KUNISHIGE K, SATO S, GOTO T. Rapid behavioral assay using handling test provides breed and sex differences in tameness of chickens. Brain and Behavior, 2019, 9(10): e01394. doi:10.1002/brb3.1394.
[30] CANARIO A, BIJMA P. Pig growth is affected by social genetic effects and social litter effects that depend on group size// Proceedings of the 9th World Congress on Genetic Applied to Livestock Production (WCGALP). 1-6 August 2010, Leipzig, Germany, 2010: 87-87.
[31] NIELSEN H, ASK B, CHRISTENSEN O, JANSS L, HEIDARITABAR M, MADSEN P. Social genetic effects for growth in Landrace pigs with varying group sizes//Proceedings of the 11th World Congress on Genetics Applied to Livestock Production. 2018: 11-16.
[32] POULSEN B G, ASK B, NIELSEN H M, OSTERSEN T, CHRISTENSEN O F. Prediction of genetic merit for growth rate in pigs using animal models with indirect genetic effects and genomic information. Genetics Selection Evolution, 2020, 52: 58. doi:10.1186/ s12711-020-00578-y.
Analysis of Indirect Genetic Effects on Body Weight of 42 Day-Old Rugao Yellow Chickens
GUO Jun, WANG KeHua, HAN Wei, DOU TaoCun,WANG XingGuo, HU YuPing, MA Meng, QU Liang
Jiangsu Institute of Poultry Sciences, Yangzhou 225125, Jiangsu
【Background】In addition to regulating its own phenotype, the genotype of an individual animal also affects the performance of other animals within a social group through resource allocation or behavioral interaction, and this phenomenon is called an indirect genetic effect. In the animal breeding, if the genetic model harbored the indirect genetic effects, it will not only improve the social relationship between individuals, but also obtain more genetic gains. 【Objective】In this study, Rugao Yellow Chickens raised in group cages were used as the test animals, and the indirect genetic model was used to evaluate body weight data, aiming to provide aflexiblemodelto select the Rugao Yellow Chickens.【Method】The body weight data was collected from the breeding group of Rugao Yellow Chickens. The fowls were weighed at the age of 42 days-old, and 11 983 raw data were collected. The data cleaning procedure included: i. removing outlier beyond three standard deviations either side of the mean; ii. eliminate the fowl without marker; iii. get rid of unknown sexed fowls; iv. the fowls with less than 4 records within a social group were also excluded. The pedigree data consisted of 12 208 fowls, including 11 735 chickens with body weight records and 473 chickens without records, 10 560 chickens without progeny and 1 648 with progeny, and the progeny of them included 208 male breeders and 1 440 female breeders. With SPSS software packages, ANOVA was used to test the influence of environmental factors on body weight and determine the factors included in the fixed effects. The classic animal model and indirect genetic model were used to analyze the variance components and genetic parameters of Rugao Yellow Chickens, and to test whether there was a dilution effect on the indirect genetic variance. The genetic model included the general fixed effects, fixed regression terms, additive genetic effects, indirect genetic effects, common environmental effects and residuals. In this study, the fixed regression term included cage sizes, and random terms included additive genetic effects, indirect genetic effects and common environmental effects. The initial value of the dilution parameter was set to 0, and it was step increased to 1.0 in increments of 0.1. After evaluating with AIC and BIC standard, the dilution parameter should be set to 0. Accounting for heterogeneous errors did not alter the estimates of genetic parameters and variance components. Therefore, the homogeneous error was assumed. Using WOMBAT software, estimates of variance components and genetic parameters converged for both classic and indirect genetic models (with or without dilution effect). 【Result】The fixed effects included the combination of laying batch-row-sex level. The significant indirect genetic variance for body weight of 42-day-old Rugao Yellow Chickens was found, for the additive heritability was 0.54±0.02, and the total heritable variation was 0.66±0.06. The corporation relationship between individuals presented in the same cage of Rugao Yellow Chickens. The direction of additive genetic and indirect genetic selection was the same, and the genetic correlation coefficient was 0.41. There was no dilution effect in the indirect genetic variance of Rugao Yellow Chickens. The indirect genetic variances were distinguished between sexes, and so on heritability and genetic correlation coefficient. 【Conclusion】Indirect genetic model could be used for the genetic evaluation and selection of body weight during the rearing period. Compared with those classic animal models, the indirect genetic models could achieve an additional genetic gain.
Rugao Yellow Chickens; heritability; indirect genetic effect; body weight; cooperation behavior

10.3864/j.issn.0578-1752.2022.19.014
2021-12-22;
2022-03-09
江苏省农业重大新品种创制项目(PZCZ201729)、江苏省重点研发计划(现代农业)专项(BE2021380)、国家重点研发计划重点专项(2021YFD1200302)、江苏省种业振兴揭榜挂帅项目(JBGS[2021]104)
郭军,Tel:0514-85599012;E-mail:guojun.yz@gmail.com。通信作者曲亮,E-mail:sqbreeding@126.com
(责任编辑 林鉴非)
