三株耐盐菌的筛选及蜡样芽孢杆菌对Cr(Ⅵ)的去除效应研究
2022-10-29王超徐静张前熙
王超,徐静,张前熙
(四川卫生康复职业学院,四川 自贡 643000)
四川自贡被称为“千年盐都”,地下盐卤资源丰富,尹菲[1]认为自贡地下卤水中NaCl含量高达2.22˜ 5.28 mol/L,如此高盐的极端环境,在传统意义上被认为是生命的禁区[2]。然而近年来的研究显示,在高盐的极端环境下依然生存着一些特殊的微生物类群,它们被称为嗜盐微生物(Halophiles)[3]。嗜盐微生物通常生存于海洋、盐湖、盐碱地、晒盐池等高盐环境中[4],依据其最适生长盐浓度,嗜盐微生物分类见表1。目前嗜盐微生物的研究已成为热门领域,其在环境污染治理方面表现出巨大的应用价值。

表1 嗜盐微生物的分类
李文均等[5,6]在新疆、青海的盐碱土壤样品中,分离出40株具有产生抗生素、蛋白酶、纤维素酶、淀粉酶和脂肪酶等特性的中度嗜盐放线菌菌株,为环境修复和新药物的开发提供微生物材料支持。孙晓莹等[7]筛选的耐盐菌油菜假单胞菌(Pseudomonas brassicacearum)可作为盐碱地改良微生物菌剂的优良菌源,提高产量。吴涛等[8]筛选的沙雷氏菌(Serratiasp.)BF40能有效利用原油,在含10 g/L NaCl液体培养基中原油降解率达到56.7%,能明显促进盐渍化土壤石油烃、沥青质降解。Khemili-Talbi等[9]从油田高矿化度污水中分离出的极端嗜盐古菌在NaCl浓度为25%时具有降解苯酚、芘和萘的潜力。廖焰焰等[10]筛选分离出一株毕赤酵母(Pichia caribbica),可用于高盐医药废水处理,COD去除率达到73%。曹文玲[11]筛选分离的KB-3菌株,不仅可以处理高盐抗生素废水,而且产电能力理想,使微生物燃料电池成为可能。
铬是重要的战略资源及经济资源,铬盐是化工材料制造的重要基础原料[12]。铬矿的开采和冶炼,导致大量含铬废物排放到自然环境中[13]。中国每年有20万t铬渣的排放量,已有超过300万t的铬渣堆存。铬渣中含有大量的Cr(Ⅵ),如果这些铬渣只是简单地堆积而不被有效处理,Cr(Ⅵ)会随风、雨水进入土壤和地下水,严重威胁人类生存安全和环境安全,如何处理铬污染已是一个不容小觑的问题[14]。近年来,人们探索使用微生物法修复日益严重的重金属污染问题,相较于传统的物理、化学、植物修复等方法,微生物修复操作简单、成本低、环境友好、可广泛应用,成为环境修复研究的热点。
鉴于嗜盐微生物具有极大的应用价值,且自贡的地下卤水资源丰富,冯玮等[15]的研究表明,自贡盐矿环境中确有微生物的存在,本研究从自贡市荣县长山盐矿地下卤水及周边环境土壤中分离筛选出3种可培养的耐盐微生物,探究其Cr(Ⅵ)的去除效应,以期为高盐环境中微生物处理重金属污染提供理论依据。
1 材料与方法
1.1 材料
选取自贡市荣县长山盐矿为取样点,采集盐井盐卤、土壤样品,4℃保存备用(图1)。

图1 样品采集
1.2 试验试剂
1.2.1 培养基的制备本研究选取LB培养基作为供试培养基。其配方为胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。固体培养基中加入琼脂粉15 g/L。筛选培养基为在LB培养基的基础上添加的NaCl质量分数梯度为5%、10%、15%、20%。
1.2.2 Cr(Ⅵ)标准溶液及定量检测试剂的配制Cr(Ⅵ)标准溶液(1 g/L):重铬酸钾(K2Cr2O7)在110℃下烘2 h,取2.83 g,加去离子水溶解,定容至1 L,摇匀,避光保存。其他浓度Cr(Ⅵ)溶液由此溶液稀释得到。
二苯碳酰二肼显色液(DPC):取DPC 0.2 g,加入到50 mL丙酮中,加去离子水溶解,定容至100 mL,摇匀,避光,4℃保存。
1∶1硫酸:将浓硫酸与去离子水按体积比1∶1混匀。
1∶1磷酸:将浓磷酸与去离子水按体积比1∶1混匀。
1.3 菌株的分离纯化与鉴定
土样:取样品1 g,置于20 mL去离子水中,放入摇床中30℃、200 r/min振荡30 min,静置2 h后取上清液1 mL,加入到20 mL LB液体培养基中混匀,置于摇床200 r/min振荡培养72 h。
水样:取50 mL样品,放入摇床30℃、200 r/min振荡30 min。取1 mL样品加入20 mL LB液体培养基中混匀,置于摇床200 r/min振荡培养72 h。
取菌悬液稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7,各取200 μL稀释液涂布于LB固体筛选培养基中,30℃恒温培养72 h后,挑取单菌落纯化培养,观察菌落生长状况。采用16S rDNA技术对菌株进行鉴定。
1.4 盐浓度对菌株生长的影响
分别制备NaCl浓度为5%、10%、15%和20%的LB培养基。挑取单菌落,LB培养基活化培养18 h后,用LB培养基稀释菌液OD600nm至0.8。按10%的接种量接种于上述含有不同浓度NaCl的LB液体培养基中,总体积为100 mL,30℃、120 r/min振荡培养。分别在0、12、24、36、48、60、72 h时取样,在600、540 nm波长处测定其菌体吸光值,以OD600nm-Na表征菌株耐盐程度。
1.5 Cr(Ⅵ)的去除效应
Cr(Ⅵ)的测定采用国际标准的二苯碳酰二肼(DPC)法,将液体培养基在8 000 r/min下离心5 min后取上清1 mL,用去离子水定容至50 mL后分别加入磷酸(1∶1)、硫酸(1∶1)各0.5 mL,再加入2 mL DPC显色剂,摇匀后静止10 min于540 nm测定吸光度,以去离子水作为对照。
挑取单菌落,LB培养基活化培养18 h后,用LB培养基稀释菌液OD600nm至0.8。按10%的接种量,接种到含有Cr(Ⅵ)浓度为40 mg/L、NaCl浓度为10%的LB液体培养基中,总体积为100 mL,30℃、120 r/min振荡培养。分别在0、12、24、36、48、60、72 h时取样,测定其菌体浓度OD600nm及培养基中剩余Cr(Ⅵ)的含量。对照组为含同浓度Cr(Ⅵ)的培养基(不加菌),每组3个重复。以菌液OD600nm-Cr表征菌株的生长状况,以Cr(Ⅵ)去除率表征菌株的去除能力。
2 结果与分析
2.1 菌株的分离纯化与鉴定
将样本进行分离纯化培养,根据菌落大小、形状、颜色、隆起程度、表面光泽、透明程度、边缘形状和在高盐浓度下生长情况等差别,最终分离出3株优势菌落,分别命名N1、N2、N3。提取菌株基因组DNA,经16S通用引物扩增,琼脂糖凝胶电泳发现其16S rDNA长度均在1 500 bp左右。成像结果见图2。

图2 16S rDNA PCR产物
16S测序序列经NCBI数据库比对,并构建菌株发育树,结果见图3,N1为蜡样芽孢杆菌(Bacillus cereus),N2为高地芽孢杆菌(Bacillus altitudinis),N3为希瓦氏菌(Shewanellasp.)。菌株鉴定结果见表2。
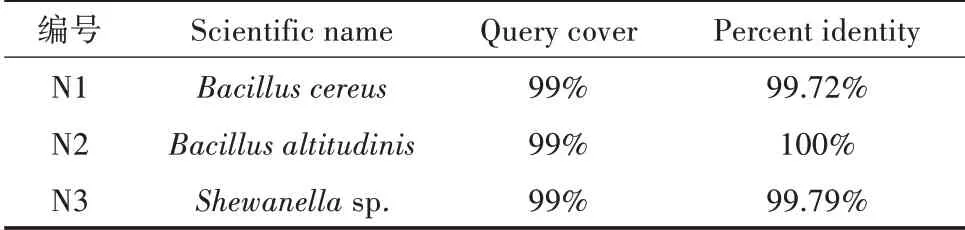
表2 N1、N2、N3菌株16S rDNA鉴定结果

图3 N1、N2、N3菌株16S rDNA序列的系统进化分析
2.2 NaCl浓度对菌株生长的影响
将N1、N2、N3菌株活化后接种于NaCl浓度为5%、10%、15%和20%的LB液体筛选培养基,30℃振荡培养,其生长曲线如图4所示。由菌株生长曲线可以看出,在NaCl浓度达10%时,N1、N2、N3菌株都能正常生长,生长的适应期(0˜12 h)、对数期(12˜ 36 h)、稳定期(36˜60 h)、衰亡期(60 h后)基本不受NaCl浓度的影响。N1、N2、N3菌株均表现出低浓度促进、高浓度抑制的特性,但每株菌对NaCl的耐受性有差异。N1菌株对NaCl的耐受性较强,在NaCl浓度达到15%时,其最大菌株浓度略高于对照组,但是当NaCl浓度达到20%时,菌体最大生长浓度仅为对照组的75.68%,菌体生长受到明显抑制。N2菌株对NaCl的耐受性优于N3菌株,在NaCl浓度达到10%时,其菌体浓度大于对照组,N3菌株生长已受到轻微抑制,其最大菌体浓度下降10%;当NaCl浓度达到15%时,N2、N3菌株菌体浓度明显下降,仅为对照组的77.14%、38.89%,菌体生长受到抑制。3株菌株耐盐能力表现为N1>N2>N3。

图4 不同NaCl浓度下N1、N2、N3菌株的生长曲线
2.3 N1菌株的Cr(Ⅵ)去除效应
研究选取对NaCl耐受性最佳的N1菌株作为供试菌株,探究耐盐微生物对Cr(Ⅵ)的去除效应。N1菌株在NaCl浓度为10%、Cr(Ⅵ)浓度为40 mg/L的LB培养基中的生长曲线及培养基Cr(Ⅵ)的剩余量曲线如图5所示。对照组Cr(Ⅵ)浓度为0 mg/L。以OD600nm为对照组,以OD540nm表征培养基中剩余Cr(Ⅵ)浓度。相对于对照组,N1菌株的最大菌体浓度有所下降,为对照组的92.68%,但N1菌株对Cr(Ⅵ)的耐受性较强,其生长未受到明显的抑制。同时培养基中Cr(Ⅵ)含量随菌体的生长逐渐降低,72 h时,Cr(Ⅵ)的剩余量为18.8%,快速去除时间为36˜ 60 h。Cr(Ⅵ)的去除与菌体浓度呈正相关,菌体生长进入稳定期后,Cr(Ⅵ)的去除速率达到峰值,培养72 h后,去除率达到81.2%。

图5 N1菌株的Cr(Ⅵ)去除效应
3 小结与讨论
本研究以四川自贡长山盐矿地下卤水及周边环境土壤为研究材料,利用LB培养基筛选出3株耐盐优势菌株,分别为N1(Bacillus cereus)、N2(Bacillus altitudinis)、N3(Shewanellasp.),在NaCl浓度为10%时,菌株均可正常生长。以N1菌株为试验材料探究Cr(Ⅵ)的去除效应,72 h后去除率达到81.2%,为高盐环境中处理Cr(Ⅵ)污染提供了理论支持。
作为一种古老的人造盐生态系统,盐井中分布着大量的嗜盐微生物,蕴藏着无法估量的微生物资源和基因资源[16]。据报道,目前可分离培养的微生物仅占环境微生物的1%˜10%,大量的微生物不能培养或现阶段难于培养。随着测序技术的发展,宏基因组测序的微生物组研究已渗透到海洋、土壤、人、动物以及环境等各领域。苑楠楠[17]利用宏基因组学方法解析不同季节酸性矿山废水中微生物群落功能的变化规律,分析了不同性质酸性矿山废水中微生物群落的变化规律以及它们与环境因子之间的关系。梁华忠等[18]利用宏基因组技术筛选自贡大公古盐井中嗜盐微生物的Na+/H+离子逆转运蛋白基因,并分析结构和编码蛋白,对探究微生物的嗜盐机理、开发利用古盐井中的基因资源、寻找新的耐盐基因具有重要意义。宏基因组技术的出现及应用,对挖掘环境中的微生物与基因资源、评估环境微生物安全具有重要意义。
极端微生物在适应极端生存条件的演化过程中,产生了有别于非环境来源的微生物的代谢特点,如可分泌一些特殊功能的酶类和(或)产生结构特异的代谢产物以应对环境对其自身生长的限制。Goto等[19]从德国西部的碱性土壤中分离得到一株具有强烈抗负离子能力的Bacillus属菌株,对化工企业生产中污染物的生物处理工艺研究具有重要的借鉴价值。Guazzaroni等[20]和Pessoa-Filho等[21]对Tinto河流样本中微生物及功能分析发现,该地区多数微生物具有与三氧化二砷等酸性物质抗性相关的功能基因,这些微生物可能具有对该类污染物的降解能力。Berlemont等[22]从南极的土壤中分离到42株嗜冷产酶菌株,可分泌嗜冷酯酶、淀粉酶、蛋白酶和纤维素酶等多种酶类,在寒带海域海洋污染物的生物治理中具有巨大的应用潜力。对极端微生物的研究不仅可以揭示生命的起源和演化,同时还为工农业生产中的生物防治、环境治理以及药物的筛选等提供重要的参考依据。
