基于DBS改性的硅基DtBuCH18C6吸附剂的制备及其对Sr(Ⅱ)的吸附性能研究
2022-10-29王乙淇郭建锋桑红吉
王乙淇,毛 聪,郭建锋,桑红吉,吴 艳,*
(1.上海交通大学 核科学与工程学院,上海 200240;2.中核四〇四有限公司,甘肃 嘉峪关 732850)
对高放废液中长寿命核素进行分离提取,不仅可提高乏燃料后处理和地质处置过程中的安全性,还可降低放射性核素对环境及公众安全的危害。90Sr的裂变产额为5.89%,作为高能量β放射源(0.546 MeV),其半衰期较长(T1/2=28.8 a),且释热量大(100.51 W/MtU),是高放废液中前100年放射性及热量的主要来源[1]。为实现放射性废物的减容、防止辐射热在核废物长期储存过程中引起基体变形[2]并保护公众的健康安全[3],在高放废液的处理处置过程设计中有必要考虑90Sr的去除。此外,纯化后的90Sr还可作为医药和工业中的辐射源和热源重复使用[4],从而实现放射性核素的循环利用。
针对高放废液中分离90Sr的方法,国内外均已进行了广泛研究,主要有沉淀法、离子交换法、溶剂萃取法、萃取色层法等[5]。由于离子交换法对90Sr的选择性较差,产品收率及净化效果有待提高,适宜在高放环境中连续且大量进行分离操作的溶剂萃取法成为分离90Sr的首选方法之一[6]。冠醚具有独特的冠腔结构,其中心腔带负电,且对特定半径的金属阳离子有较高的选择性,同时由于冠醚良好的水解稳定性与耐辐照性能,被认为是理想的90Sr选择性萃取剂[7]。其中,18冠6及其衍生物,如4′,4′(5″)-二(叔丁基环己基)-18-冠-6(DtBuCH18C6)的冠腔尺寸与90Sr离子的半径匹配良好,可通过络合作用选择性地对溶液中的90Sr进行分离提取。
近年来,萃取色层法的研究得到了科研工作者的关注。该方法具有有机试剂与固相载体相结合、核素分离效果好、有机废液的产生量相对较少和设备及操作流程简单等特点[8]。由于吸附剂对90Sr的吸附效果很大程度上受负载冠醚的基体材料性能的影响,基于不同载体材料的固体吸附剂得到了广泛研究。Ma等[9]将双环己基-18-冠-6浸渍于具有高比表面积和离子交换能力特性的钛酸盐纳米管中制成复合吸附剂,在酸性条件下可将95%以上的Sr(Ⅱ)从溶液中分离。Mu等[10]通过将4′-氨基苯并-18-冠-6嵌入到α-磷酸锆的层间结构中制备了AM-ZrP吸附剂,其对Sr(Ⅱ)的吸附速度快且选择性好。Zhang等[11]制备了硅基冠醚吸附剂,其在2 mol/L硝酸条件下的吸附容量可达317.0 cm3/g。
在前期探索过程中,本课题组研发了高性能的冠醚复合吸附剂[12],将DtBuCH18C6负载于二氧化硅与聚合物的复合粒子(SiO2-P)孔道内,研究发现,与TBP、正辛醇等对比,以正十二烷醇(Dodec)为分子改性剂所合成的吸附剂具有较好的吸附效果、机械强度、耐酸及耐辐照性能,实现了模拟高放废液中Sr(Ⅱ)的动态选择性分离。但上述材料在低酸条件下均对Sr(Ⅱ)的吸附效果差,高酸条件下的效果也期待进一步提高,限制了吸附剂的适用范围。因此,本研究拟在前期研究的基础上,利用分子改性剂十二烷基苯磺酸对DtBuCH18C6的吸附亲和力进行改善,通过将DtBuCH18C6、正十二烷醇和十二烷基苯磺酸在真空负压条件下负载至SiO2-P载体的孔隙中,合成新型的(DtBuCH18C6+DBS+Dodec)/SiO2-P吸附剂,对吸附剂的表面形态、化学稳定性、吸附机理、吸附动力学及解吸性能进行分析,以评价新型吸附剂对高放废液中90Sr分离提取的应用前景。
1 方法
1.1 主要试剂
4′,4′(5″)-二(叔丁基环己基)-18-冠-6(≥90%),十二烷基苯磺酸(90%),正十二烷醇(≥99%),硝酸锶、硝酸铯、硝酸镧等硝酸盐试剂及其对应的金属阳离子标准溶液均为市售分析纯试剂。SiO2-P,参照文献[13]制备,粒径范围为30~70 μm。SiO2-P中的P指聚苯乙烯(SDB),固定在多孔SiO2颗粒上,负载量为20%,孔隙直径约为50 nm。
1.2 (DtBuCH18C6+DBS+Dodec)/SiO2-P吸附剂合成
取适量DtBuCH18C6与正十二烷醇于圆底烧瓶中,搅拌溶解,加入SiO2-P后在室温下充分搅拌后静置。调节条件至40 ℃、负压,利用旋转蒸发仪(EYELA N-1100)将有机溶剂浸渍到二氧化硅孔隙中,在40 ℃下真空干燥1 d,得到(DtBuCH18C6+DBS+Dodec)/SiO2-P吸附剂。
1.3 材料表征
采用Sirion 200高分辨场发射扫描电子显微镜(SEM)研究吸附剂表面形态;使用Shimadzu DTG-60热重-差热(TG-DTA)分析法在空气氛围下以10 ℃/min的升温速率对吸附剂热稳定性情况进行评价;采用Nicolet 6700傅里叶变换红外光谱(FT-IR)在4 000~450 cm-1的波数范围内研究吸附剂的官能团组成;采用Kratos AXIS Ultra DLD X射线光电子能谱(XPS)分析吸附前后元素结合能的变化;采用Shimadzu VCPH总有机碳分析仪(TOC)分析浸泡液中有机物的泄漏量,评价吸附剂稳定性能。
1.4 吸附实验
采用静态吸附实验,分别考察硝酸浓度、温度、共存离子对(DtBuCH18C6+DBS+Dodec)/SiO2-P吸附性能的影响。具体方法为:将5 mmol/L金属阳离子溶液(5 mL)与50 mg吸附剂在离心管中混合,放置于恒温水浴摇床(Tokyo RIKAKIKA CO., Ltd.)中反应适当时间,金属离子由Shimadzu 7510电感耦合等离子体发射光谱仪(ICPS)及SP3880原子吸收光谱(AAS)进行测量。
分配系数(Kd)、平衡吸附容量(qe)和吸附率(R)为吸附性能评价指标,其计算公式如下:
(1)
(2)
(3)
式中:co和ce分别为溶液中金属离子的初始和平衡浓度(mmol/L);V和m分别为溶液的体积(L)和吸附材料的质量(g)。
1.5 吸附剂的重复利用
在3 mol/L硝酸条件下,使1 g吸附剂与200 mg/L Sr(Ⅱ)溶液(50 mL)进行吸附反应,得到吸附有Sr(Ⅱ)的吸附剂样品。将其分别与不同种类的洗脱剂接触不同的时间,并改变吸附剂与洗脱剂的液固比得到吸附剂的最佳洗脱条件。洗脱率(E)的计算公式如下:
(4)
式中,cd为洗脱后溶液中Sr(Ⅱ)的浓度,mmol/L。
2 结果与讨论
2.1 吸附剂表征
(DtBuCH18C6+DBS+Dodec)/SiO2-P吸附剂的SEM图像示于图1。由图1可见,吸附剂呈均匀球状体,粒径约为50 μm,结构完好,表面仅有少量的絮状有机物残留,但基本保持光滑,大部分表面有机试剂成功被负载至SiO2-P孔隙中。
张三爷有和当时大部分武人同样的经历,保过镖、护过院、当过武师,但除此以外,他还有大多数武人没有的经历,他曾当过清朝练勇局的把总,宣统年间还护送过去西藏传诏的钦差。
(DtBuCH18C6+DBS+Dodec)/SiO2-P吸附剂在30~800 ℃范围内的TG-DTA曲线如图2所示。分析图2可知,温度小于90 ℃时,由于表面水和结晶水的挥发,吸附剂存在少量的质量变化;90 ℃以上的失重主要为负载有机试剂引起的质量变化,其失重过程由95.03~200.74 ℃(阶段Ⅰ)、200.74~324.92 ℃(阶段Ⅱ)及324.92~682.59 ℃(阶段Ⅲ)三个部分组成。阶段Ⅰ中损失的质量为21.91%,与DtBuCH18C6和正十二烷醇的理论设计质量(22%)相匹配。前期研究[12]结果表明,冠醚DtBuCH18C6约在170 ℃处发生热解并吸收热量,而本文在188.05 ℃处观察到吸附剂向下的放热峰,推测是由于改性剂DBS的添加使阶段Ⅰ的热量变化发生了改变。阶段Ⅱ的质量损失为18.81%,且伴随着在305.39 ℃处向上的吸热峰,推测在此温度范围内存在分子改性剂DBS的热解;阶段Ⅲ则是由SiO2-P中的聚合物 (SDB)分解引起,质量损失为15.05%,这与前期研究[12]中SiO2-P载体的热重分析值一致。由上述结果可知,在温度由30 ℃升至800 ℃的过程中,吸附剂的总失重量为原始质量的55.45%,其中有40.40%的有机试剂被负载在SiO2-P的孔道中,同时SiO2-P载体的质量占吸附剂质量的59.60%。理论设计中,负载的有机试剂与SiO2-P载体的质量分别占总吸附剂质量的40.00%和60.00%,上述热重分析所得结果与该理论设计值基本相符。

图2 (DtBuCH18C6+DBS+Dodec)/SiO2-P的TG-DTA曲线Fig.2 TG-DTA curve for (DtBuCH18C6+DBS+Dodec)/SiO2-P


图3 (DtBuCH18C6+DBS+Dodec)/SiO2-P与SiO2-P的FT-IR谱Fig.3 FT-IR spectra for (DtBuCH18C6+DBS+Dodec)/SiO2-P and SiO2-P
(DtBuCH18C6+DBS+Dodec)/SiO2-P在3 mol/L硝酸条件下吸附Sr(Ⅱ)前后的XPS谱示于图4。由图4a可见,吸附剂的宽谱扫描检测出了O 1s、C 1s、S 2p和Si 2p的特征峰,其中C与S元素分别占总元素质量浓度的40.33%和4.71%。由图4b可见,与Sr(Ⅱ)溶液(1 200 mg/L,3 mol/L HNO3)进行相互作用后,在134.8 eV附近检测到Sr 3p特征峰,证实了吸附剂对Sr(Ⅱ)的吸附效果,且吸附剂中的O通过与Sr(Ⅱ)离子形成Sr—O键来实现对其稳定吸附。由于在DtBuCH18C6通过冠腔与Sr(Ⅱ)离子进行配对的过程中,Sr(Ⅱ)离子与冠腔中6个氧电子之间产生强静电相互作用[16],Sr 3p谱中的Sr—O键特征峰可佐证吸附剂对Sr(Ⅱ)的吸附过程存在DtBuCH18C6与Sr(Ⅱ)离子的配对。同时,对吸附剂吸附前、0.5 mol/L硝酸浓度及3 mol/L硝酸浓度条件下吸附Sr(Ⅱ)后的S 2p谱(图4c)进行分析。在0.5 mol/L硝酸浓度下吸附Sr(Ⅱ)前后磺酸基中S元素的结合能发生了明显的变化,峰值由167.31 eV增长至168.05 eV;在3 mol/L硝酸浓度下,吸附前后S元素的结合能变化相对0.5 mol/L硝酸浓度下较小,峰值由167.31 eV增长至167.60 eV。可以推测在硝酸浓度较低及较高的条件下,吸附剂对Sr(Ⅱ)的吸附过程中都有DBS的参与,硝酸浓度条件的变化对该作用存在一定的影响。

图4 (DtBuCH18C6+DBS+Dodec)/SiO2-P的XPS谱Fig.4 XPS spectra of (DtBuCH18C6+DBS+Dodec)/SiO2-P
2.2 吸附剂的化学稳定性
分别在25、50 ℃条件下,将0.1 g(DtBu-CH18C6+DBS+Dodec)/SiO2-P吸附剂与不同浓度的硝酸溶液(5 mL)作用1 d,测定浸泡液中有机成分的总有机碳(TOC),即为负载有机物的泄漏量,结果示于图5。进一步将有机试剂的泄漏量与2.1节中有机试剂的负载量进行比较得到有机物质的泄漏率,以评价吸附剂化学稳定性。在25 ℃、0.5~7 mol/L硝酸浓度下,泄漏至硝酸溶液中的有机物的TOC量稳定在49 ppm左右;当温度升高至50 ℃时,TOC量仅上升到50.63 ppm左右,有机物的泄漏量增幅仅为3.3%。考虑到负载的有机成分包括DtBuCH18C6、DBS、正十二烷醇,组成较复杂,将溶液中的有机物假设全部为DtBuCH18C6的泄漏,通过TOC值计算可知,即使在50 ℃、硝酸浓度为7 mol/L条件下,吸附剂中DtBuCH18C6的泄漏量也小于2.03%。分子修饰剂正十二烷醇的添加有效降低了DtBuCH18C6从SiO2-P载体中的泄漏,使吸附剂在不同酸度条件下都具有较好的化学稳定性。
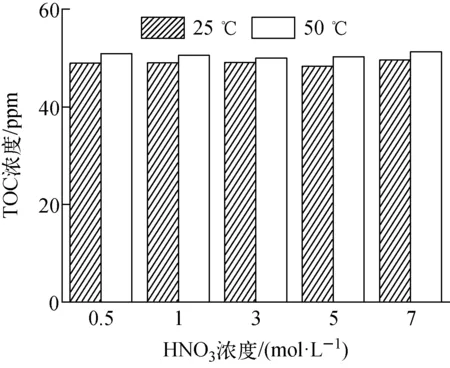
图5 (DtBuCH18C6+DBS+Dodec)/SiO2-P在硝酸溶液中的TOCFig.5 TOC of (DtBuCH18C6+DBS+Dodec)/SiO2-P in nitric acid solution
2.3 吸附分配系数
Sr(Ⅱ)浓度为5 mmol/L、液固比为0.05 L/g、温度为25 ℃、硝酸浓度为0.5~5 mol/L时,Sr(Ⅱ)的吸附分配系数示于图6。为分析分子改性剂DBS的添加对Sr(Ⅱ)吸附的促进效果,在相同条件下使用(DtBuCH18C6+Dodec)/SiO2-P进行了对比实验。由图6可见,添加DBS改性剂后,吸附剂对Sr(Ⅱ)的分配系数在0.5~1 mol/L的硝酸浓度范围内缓慢下降,硝酸浓度为0.5 mol/L时Kd值高达392.19 cm3/g;随着酸度的进一步升高,Kd在1~3 mol/L范围内逐渐上升,而硝酸浓度大于3 mol/L后有下降趋势,在3 mol/L时存在相对较大值355.02 cm3/g。与(DtBuCH18C6+Dodec)/SiO2-P相比,添加DBS改性剂后的吸附剂,在低硝酸浓度(0.5~1 mol/L)下的Kd值明显提升了2.5~10倍,而在较高硝酸浓度(3~5 mol/L)条件下,Kd值也提高至2倍左右。

图6 不同硝酸浓度下两种吸附剂对Sr(Ⅱ)的分配系数Fig.6 Kd of two different adsorbents at varying nitric acid concentration
在前期研究中,仅将正十二烷和DBS负载到SiO2-P中制备成(DBS+Dodec)/SiO2-P的实验结果表明,(DBS+Dodec)/SiO2-P在0.5~5 mol/L硝酸浓度范围内对Sr(Ⅱ)基本无吸附[17]。因此推测,添加DBS的(DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)的吸附主要存在3种反应过程:1) DBS中磺酸根基团作为配阴离子参与DtBuCH18C6与Sr(Ⅱ)的络合反应(式(5));2) 硝酸的盐析作用(式(6));3) 竞争作用(式(7))。在硝酸浓度低于1 mol/L时,吸附过程主要是DBS中的磺酸根作为配位离子与DtBuCH18C6和Sr(Ⅱ)形成离子络合性萃取物;当酸度为1~3 mol/L时,溶液中的硝酸根离子含量增加,其作为盐析剂的作用逐渐显著,并与DBS呈现出协同作用,较好地提升了冠醚对Sr(Ⅱ)的络合效果;而当酸度大于3 mol/L后,硝酸分子与DtBuCH18C6的反应会对Sr(Ⅱ)的络合产生竞争,从而导致分配系数逐渐下降。
Sr(RSO3)2·DtBuCH18C6
(5)
Sr(NO3)2·DtBuCH18C6
(6)

HNO3·DtBuCH18C6
(7)
其中,R代表DBS中的烷基。
2.4 共存离子对于吸附性能的影响

图7 (DtBuCH18C6+DBS+Dodec)/SiO2-P对各金属的分配系数Fig.7 Kd value of different metal ions on (DtBuCH18C6+DBS+Dodec)/SiO2-P
由于高放废液中核素的组分复杂,材料的吸附性能会受到多种共存离子的影响,因此配置了含Sr(Ⅱ)、Zr(Ⅳ)、Cs(Ⅰ)、Ru(Ⅲ)、Re、Pd(Ⅱ)、Mo(Ⅴ)、Gd(Ⅲ)、Sm(Ⅲ)、Nd(Ⅲ)、La(Ⅲ)多种金属阳离子混合的模拟高放废液(各金属阳离子浓度均为5 mmol/L,硝酸浓度为0.5~7 mol/L),研究(DtBuCH18C6+DBS+Dodec)/SiO2-P在多离子共存的模拟高放废液中对Sr(Ⅱ)的吸附选择性(25 ℃,液固比为0.05 L/g),结果示于图7。由图7可知,吸附剂对Sr(Ⅱ)的分配系数远大于其他离子,除Zr(Ⅳ)外,0.5~7 mol/L硝酸浓度范围内吸附剂对其他离子的分配系数均低于10 cm3/g。这是由于在低酸下,Zr(Ⅳ)易与Mo(Ⅴ)离子形成沉淀,导致其在溶液中的含量减小,但Zr(Ⅳ)的分配系数仅为59.45 cm3/g。此外,在共存离子存在下,吸附剂对Sr(Ⅱ)的分配系数与仅对Sr(Ⅱ)进行单一吸附的情况下无明显变化。冠醚因具有通过冠腔的尺寸与目标离子直径相匹配形成络合物从而实现对目标离子的吸附特性[18],使得(DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)有优越的选择吸附性能。
2.5 吸附动力学
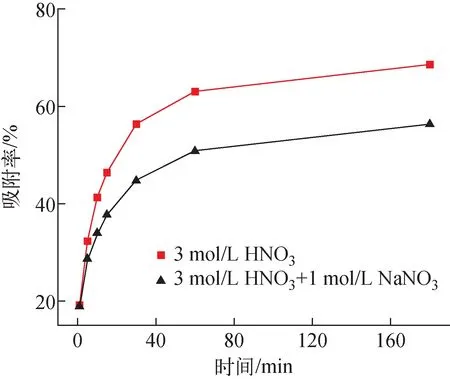
图8 接触时间对Sr(Ⅱ)吸附率的影响Fig.8 Effect of contact time on uptake rate of Sr(Ⅱ)
高放废液一般是由2~3 mol/L的硝酸溶液溶解得到的,且含有一定量的钠离子[19]。根据2.3节的实验结果,吸附剂在3 mol/L的硝酸溶液中具有较好的吸附性能,因此进一步对吸附剂在3 mol/L硝酸溶液中的动力学特性进行研究,同时研究3 mol/L硝酸与1 mol/L硝酸钠混合溶液对吸附剂吸附动力学性能的影响(5 mmol/L Sr(Ⅱ),液固比为0.05 L/g,25 ℃),结果示于图8。由图8可见,在3 mol/L硝酸溶液中,反应速度在前60 min内快速上升,吸附率达到63%,在60~180 min内,吸附反应逐渐趋向平衡。该结果表明,在反应初期,吸附剂对Sr(Ⅱ)的吸附为表面吸附,其过程快速且贡献了平衡吸附容量的主要部分,随着反应时间的延长,由于表面吸附位点减少,吸附由表面向内部扩散,过程相对缓慢。在添加1 mol/L硝酸钠的混合溶液中,Sr(Ⅱ)吸附率的变化趋势基本与3 mol/L硝酸条件下一致,而平衡吸附率下降为原来的77.7%。Na(Ⅰ)与Sr(Ⅱ)的离子半径分别为0.194 nm与0.226 nm,均可被吸附剂中负载的DtBuCH18C6的冠醚腔所捕集[20],吸附剂在吸附Sr(Ⅱ)的同时对Na(Ⅰ)也有一定的吸附[21],Na(Ⅰ)与Sr(Ⅱ)的竞争性吸附使得达到吸附平衡后吸附剂对Sr(Ⅱ)的吸附率下降。由于Sr(Ⅱ)的离子半径与冠醚腔的尺寸更吻合[22],在添加1 mol/L硝酸钠的混合溶液中,吸附剂对Sr(Ⅱ)仍有较高的吸附率。
为进一步研究(DtBuCH18C6+DBS+Dodec)/SiO2-P的吸附动力学机制,使用准一级和准二级吸附动力学模型对反应数据进行拟合。线性准一级及准二级动力学方程如下:
(8)
(9)
其中:qt为t(min)时刻的吸附量(mg/g);k1为准一级动力学方程速率常数;k2为准二级动力学方程速率常数。
采用式(8)、(9)对图8中实验数据进行拟合,拟合结果示于图9,拟合参数列于表1。由表1可见,在3 mol/L硝酸及3 mol/L硝酸混合1 mol/L硝酸钠的条件下,准一级动力学模型拟合的相关系数均低于0.85,且得到的饱和吸附容量与实验值相差较大,远大于实验值31.73 mg/g与27.48 mg/g;准二级动力学模型拟合后的相关系数均达到0.999,根据拟合数据获得吸附平衡容量与实验值基本一致,表明(DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)的吸附符合准二级动力学特性,是一个受化学吸附过程控制的速率控制过程。

图9 (DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)吸附的动力学拟合结果Fig.9 Kinetic fitting result of Sr(Ⅱ) adsorption on (DtBuCH18C6+DBS+Dodec)/SiO2-P
2.6 吸附等温线
为研究25 ℃下3 mol/L硝酸溶液中(DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)的吸附机理,采用Langmuir、Freundlich等温线模型(式(10)、(11))对不同Sr(Ⅱ)浓度的硝酸溶液的平衡吸附容量进行拟合,实验及拟合结果示于图10,拟合参数列于表2。

表1 (DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)吸附的动力学拟合参数Table 1 Kinetic parameter evaluated for Sr(Ⅱ) adsorption on (DtBuCH18C6+DBS+Dodec)/SiO2-P
Langmuir等温线模型:
(10)
Freundlich等温线模型:
(11)
其中:qm为饱和吸附容量,mg/g;KL为Langmuir参数;KF为Freundlich参数。

图10 (DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)的吸附等温线Fig.10 Non-linear isotherm plot of Sr(Ⅱ) adsorption data using (DtBuCH18C6+DBS+Dodec)/SiO2-P
由表2可见,两个模型的拟合相关系数均在0.94以上,分别为0.997和0.941,说明两个模型均都具有较好的拟合效果。由于Langmuir等温线模型的相关系数结果更接近于1,说明吸附剂对Sr(Ⅱ)的吸附过程更接近于表面均一的单层吸附,吸附剂表面的点位数量一定,且各吸附点之间没有Sr(Ⅱ)的转移运动[23]。根据Langmuir等温线模型得到的拟合结果,达到吸附平衡时Sr(Ⅱ)的最大吸附量约为42.13 mg/g,接近实验得到的最大吸附容量40.69 mg/g,Langmuir等温线模型对吸附剂的最大吸附容量的估计结果有较好的准确性。

表2 (DtBuCH18C6+DBS+Dodec)/SiO2-P对Sr(Ⅱ)的吸附等温线拟合参数Table 2 Parameter obtained from isotherm analysis of Sr(Ⅱ) adsorption data using (DtBuCH18C6+DBS+Dodec)/SiO2-P
2.7 吸附剂的重复利用性
对吸附Sr(Ⅱ)后的吸附剂进行洗脱,一方面可实现对放射性90Sr的回收,另一方面可实现吸附剂的重复利用,提升吸附剂的经济性。在25 ℃下,分别以0.5 mol/L和1 mol/L硝酸(30 mL)作为洗脱剂对吸附Sr(Ⅱ)的吸附剂(0.6 g)进行洗脱,结果示于图11。由图11可见,Sr(Ⅱ)的洗脱率均随接触时间的增加而上升,3 h左右时基本接近平衡,分别达到20.69%和39.65%。虽然在1 mol/L硝酸条件下的洗脱率更高,但与1 mol/L硝酸接触5 h后,仍只有42.81%的Sr(Ⅱ)从吸附剂中洗脱下来,远不能达到吸附剂重复利用的标准。这是由于添加的分子改性剂DBS在0.5 mol/L及1 mol/L硝酸条件下为DtBuCH18C6与Sr(Ⅱ)的络合提供了配位阴离子,使得这两种洗脱剂无法在当前条件下对吸附的Sr(Ⅱ)进行高效的洗脱。
进一步考虑改变作为洗脱剂的硝酸溶液的浓度或洗脱剂与吸附剂的液固比(V/m)来改善洗脱效果。由于提高硝酸浓度对材料的耐酸性会产生影响,且对仪器以及操作安全有更高的要求,因此本研究通过调整吸附剂与洗脱剂的液固比来提高Sr(Ⅱ)的回收效果。在25 ℃、1 mol/L硝酸、5 h接触时间的条件下进一步对洗脱剂与吸附剂的液固比对洗脱率的影响进行探讨,结果示于图12。由图12可见,将液固比由0.2 L/g提升到0.9 L/g,1 mol/L硝酸对Sr(Ⅱ)的洗脱率随着吸附剂体积的增加而上升,在液固比为0.9 L/g时,洗脱率达79%。因此,使用1 mol/L硝酸作为洗脱剂对吸附Sr(Ⅱ)后的(DtBuCH18C6+DBS+Dodec)/SiO2-P进行洗脱时,液固比设置为0.9 L/g。

图11 不同浓度洗脱液下Sr(Ⅱ)的洗脱率随接触时间的变化Fig.11 Change of Sr(Ⅱ) elution rate with contact time under different nitric acid concentrations

图12 液固比对Sr(Ⅱ)洗脱率的影响Fig.12 Effect of liquid solid ratio on elution rate of Sr(Ⅱ)
3 结论
1) 本研究采用DBS作为大环分子化合物冠醚DtBuCH18C6的分子改性剂,以旋转蒸发真空负压的方式成功合成了(DtBuCH18C6+DBS+Dodec)/SiO2-P吸附剂。
2) 通过表征手段评价了有机化合物在SiO2-P载体中的负载情况和热稳定性,并对吸附Sr(Ⅱ)前后的元素结合能变化进行了XPS分析,佐证了DtBuCH18C6及DBS对Sr(Ⅱ)吸附过程中的贡献。复合吸附剂在硝酸溶液中的泄漏率低且受温度的影响小,有良好的化学稳定性能。
3) 静态吸附实验证明,吸附剂对Sr(Ⅱ)有良好的吸附选择性,DBS的添加提供了可与DtBuCH18C6进行配位的平衡阴离子,使得在0.5 mol/L硝酸条件下的分配系数提升到392.19 cm3/g,增加了约10倍。吸附剂对Sr(Ⅱ)的吸附过程符合准二级动力学模型和Langmuir模型,表明其吸附速率受化学吸附过程控制且吸附过程更接近表面均一的单层吸附。
4) 以1 mol/L硝酸作为洗脱剂对Sr(Ⅱ)的洗脱率高达约79%,吸附剂具有较好的重复利用性。
