Li4Ti5O12材料的固相法制备及其煅烧温度*
2022-10-28龙芮涞吴显明吴秀婷尹偲硕
龙芮涞,吴显明,吴秀婷,尹偲硕
(吉首大学化学化工学院,湖南 吉首 416000)
具有尖晶石结构的钛酸锂(Li4Ti5O12)材料可用作锂离子电池的负极,具有稳定的嵌锂电位(1.55V vs. Li/Li+)[1-2],可有效避免SEI膜的形成和锂枝晶的沉积[3],大大降低了锂离子电池的使用安全隐患[4].在充放电时,锂离子在晶格中的嵌入脱出几乎不改变Li4Ti5O12的原有体积(变化率小于1%)[5],避免了材料反复收缩膨胀造成结构破坏.Li4Ti5O12在循环中表现出良好的稳定性和较高的库伦效率,是理想的“零应变”材料[6-7],有望成为取代石墨等碳材料的一种新型锂离子电池负极材料[8-9].
制备Li4Ti5O12的方法主要有固相法[10-11]、水热法[12]、溶胶—凝胶法[13-14]、微波法、模板法[15]、熔盐法等.为改善Li4Ti5O12低电子电导率和离子电导率的缺点,常采用水热法或溶胶—凝胶法对Li4Ti5O12进行结构纳米化、离子掺杂、表面修饰等[16].比如颜群轩[17]以醋酸锂和钛酸丁酯为原料,异丙醇为溶剂,采用溶胶—凝胶法制备Li4Ti5O12前驱体,再经过850 ℃热处理24 h后得到的产品粒径分布均匀,结晶度好,并表现出较好的电化学性能;Tang等[18]用水热法制备出纳米片自组装的空心Li4Ti5O12微球,由于具有较大比表面积和介孔结构,电解液能够充分接触材料表面,缩短了Li+的扩散距离.但这些方法大多原料成本高,制备过程复杂,对设备要求苛刻,均难以做到规模化生产.
高温煅烧过程是Li4Ti5O12固相合成的重要阶段,对其它合成方法也有参考作用[19-20].因此,探究合适的煅烧温度对于优化Li4Ti5O12材料的结构与电化学性能有重要意义[21].本研究采用方法简便、适用于工业化大规模量产的固相法[22],通过“预煅烧—研磨—高温煅烧”两步煅烧方式,在不同煅烧温度下合成Li4Ti5O12,并在此基础上探究碳酸锂(Li2CO3)与二氧化钛(TiO2)在不同温度下反应产物的结构、形貌以及电化学性能.
1 实验部分
1.1 主要试剂与仪器
Li2CO3、TiO2,分析纯,上海阿拉丁生化科技股份有限公司;无水乙醇,分析纯,成都金山化学试剂有限公司;乙炔黑、聚偏二氟乙烯(PVDF,Mr=5.34×105)、N-甲基吡咯烷酮、铜(Cu )箔、锂片、微孔聚丙烯膜(celgard 2400)、电解液(1 mol/L LiPF6),电池级,山西力之源电池材料有限公司.
OTF-1200X气氛管式炉、KSL-1200X 高温马弗炉,合肥科晶材料技术有限公司;D/max-3ⅢA 全自动 X 射线衍射仪,日本理学公司;S-3800N 型扫描电子显微镜,日本 Hitachi 公司;TGA2热重分析仪,梅特勒-托利多仪器上海有限公司;ZKX 型真空手套箱,米开罗那(中国)有限公司;CHI660E 型电化学工作站,上海辰华仪器有限公司;BST-5V 10mA 型电池性能测试系统,深圳市新威尔电子有限公司.
1.2 实验方法
按照n(Li)∶n(Ti) =4.4∶5的锂钛比称取适量Li2CO3和TiO2(锂源过量10%),置于玛瑙研钵中,加入适量无水乙醇作为分散剂,充分研磨成白色膏状物,装填入烧舟中置于管式炉内,在空气气氛下以5 ℃/min的升温速率升至500 ℃进行预煅烧4 h,冷却至室温后进一步研磨,再次用相同的升温速率升至750~900 ℃煅烧6 h,冷却至室温后得到白色Li4Ti5O12粉末.
1.3 电池组装
按 8∶1∶1 的质量比称取适量合成后的活性物质、导电乙炔黑、粘结剂 PVDF ,置于玛瑙研钵中充分研磨,加入适量N-甲基吡咯烷酮溶剂并搅拌均匀形成浆料,将浆料均匀涂布在 Cu箔集流体上,转移至烘箱中80 ℃下真空干燥 4 h,烘干后裁剪为直径14 mm 电极片.以金属锂片为负极,微孔聚丙烯膜为隔膜,1 mol/L LiPF6(V(碳酸乙烯酯,EC)∶V(碳酸二乙酯,DMC)=1∶1)为电解液,在充满氩气且水、氧含量低于0.01 × 10-6的手套箱内组装成 CR2032型纽扣电池.
1.4 表征
采用梅特勒-托利多TGA2热重分析仪对前驱体混合物进行热重分析;采用X射线衍射仪对所得产物的相组成和晶格参数进行表征(Cu Kα 辐射,λ= 0.154 056 nm);采用场发射扫描电子显微镜(FE-SEM)对合成样品的表面形貌及微观结构进行分析.
1.5 电化学性能测试
采用BST-5 V 10 mA电池性能测试系统对电池进行恒流充放电测试,电压范围为 1.0~2.5 V.采用CHI660E电化学工作站进行电化学阻抗测试,测试频率范围为1.0×10-2~1.0 × 105Hz,正弦波电流电压扰动信号振幅为 5 mV,循环伏安测试电压范围在1.0~2.5 V,扫描速率为 0.1 mV/s.
2 结果与讨论
2.1 TG分析
图1为Li2CO3和 TiO2混合物的热重曲线.从图1可知,在30~500 ℃之间,混合物仅有7.38%的质量损失.此温度范围以混合物表面吸附水、结晶水的脱除过程为主;而在500~700 ℃之间,原料开始急剧失重,总质量损失达到22.88%,此过程对应于Li2CO3→Li2O + CO2,CO2的挥发导致混合物总质量下降;700 ℃以后,Li2O进一步与TiO2经Li2O + TiO2→Li2TiO3和Li2TiO3+ TiO2→Li4Ti5O12两步反应生成Li4Ti5O12;温度在750 ℃以后曲线平缓,质量基本稳定,表明反应基本结束,此结果也说明Li4Ti5O12的合成温度需达到750 ℃.
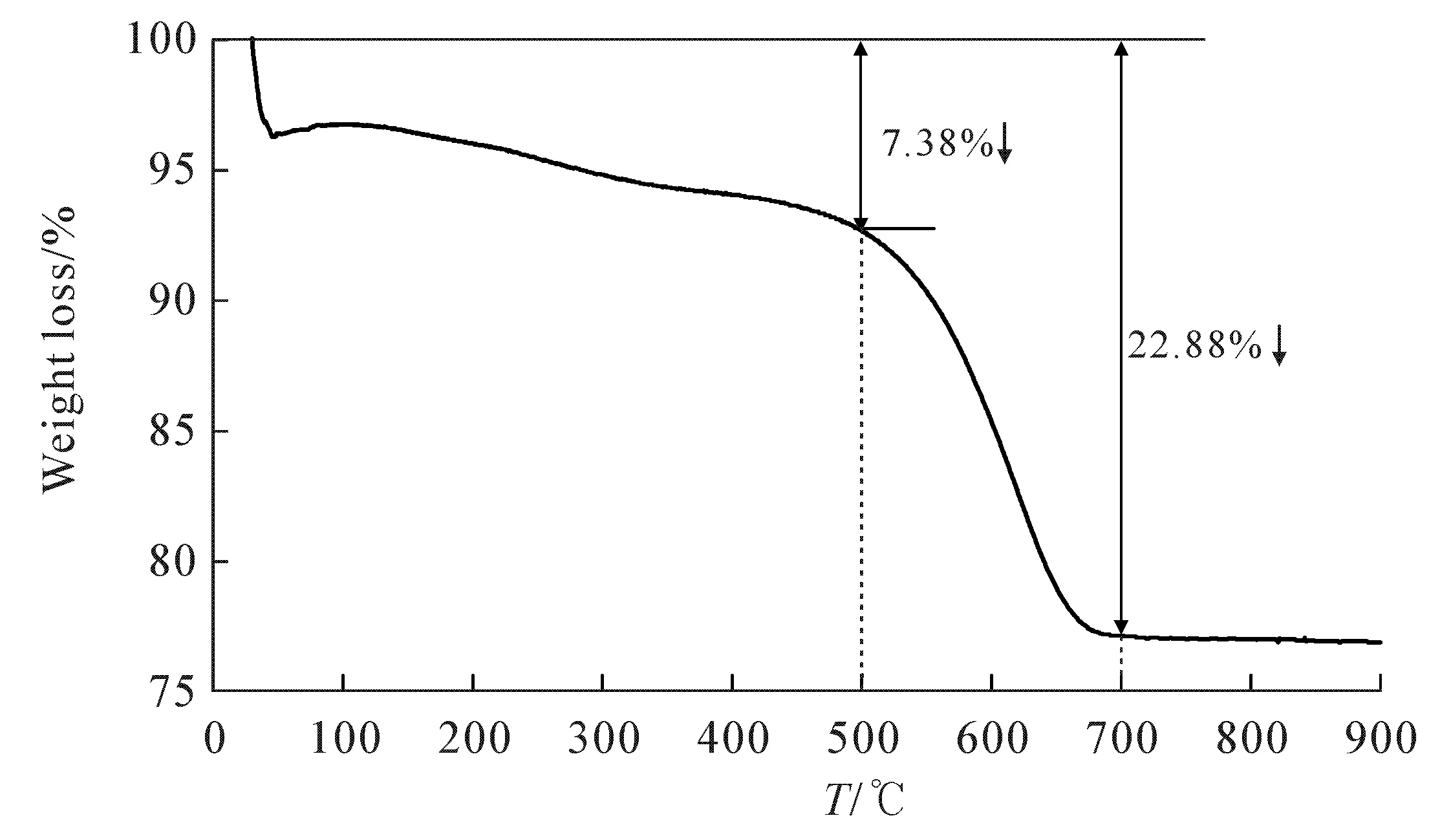
图1 Li2CO3 和 TiO2 混合物的热重曲线Fig.1 Thermogravimetric Curves of Li2CO3 and TiO2 Mixtures
2.2 XRD分析
图2为750~900 ℃下合成得到的Li4Ti5O12X射线衍射图谱.从图中各谱线对比可发现,合成温度为750 ℃时原料未能完全反应,仍有少部分TiO2存在.而温度达到800 ℃时,样品的衍射峰与标准卡片一致,TiO2的衍射峰消失,且随着温度的升高,衍射峰的强度也相应增加,峰形更为尖锐,表明要得到纯相Li4Ti5O12,合成温度需在800 ℃及以上.

图2 不同合成温度下Li4Ti5O12的XRD图谱Fig.2 XRD Patterns of Li4Ti5O12 at Different Synthesis Temperatures
2.3 SEM分析
图3是在不同温度下合成Li4Ti5O12的SEM图.

图3 750 ℃,800 ℃,850 ℃,900 ℃下合成Li4Ti5O12的SEM图Fig. 3 SEM Image of Li4Ti5O12 at 750 ℃,800 ℃,850 ℃,900 ℃
从图3可以看出,各样品表面光滑,颗粒均匀,且周围分布大量孔隙,有利于电解液的浸润和锂离子的扩散.对比图3(a)~(d)发现,随着合成温度的升高,样品的颗粒尺寸也相应增大,从200 nm左右增加到400 nm左右.样品颗粒在900 ℃下有一定团聚现象,为避免团聚对观测的影响,Li4Ti5O12的合成温度不宜过高.
2.4 电化学性能分析
图4为不同合成温度的Li4Ti5O12在 0.5C倍率下首次充放电与循环性能曲线.由图4(a)可见,800 ℃,850 ℃,900 ℃合成温度下的样品充放电曲线均在1.55 V左右有稳定的电位平台,可逆比容量分别为157.67,154.49,147.08 mA·h/g,对应的库伦效率分别为96.1%,98.2%,93.8%.由图4(b)可见,各样品的比容量在最初几次循环时,容量有较明显的下降,但经过几次循环后,比容量基本稳定.经过100次循环后,可逆比容量为155.51,150.03,142.93 mA·h/g,对应容量保持率分别为98.63%,97.11%,97.18%.800 ℃下合成的样品容量保持率最高,表明该样品循环稳定性最好.800 ℃以上合成样品的容量保持率低于800 ℃合成的样品,可能是过高的合成温度易造成颗粒尺寸不均匀,局部的团聚现象减小了颗粒与电解液的接触面积,相应增大了锂离子的扩散距离,不利于材料比容量的发挥.

图4 0.5C倍率下不同合成温度的Li4Ti5O12首次充放电与循环性能曲线Fig. 4 First Charge/Discharge and Cycling Performance Curves of Li4Ti5O12 with Different Synthesis Temperatures at 0.5C Magnification
图5为不同合成温度下的Li4Ti5O12倍率曲线.由图5可见,随着倍率的不断增大,各样品的比容量均呈阶梯式下降,其中800 ℃下合成的样品比容量下降幅度最小,表明其比容量受电流密度的影响较小,在不同倍率下均能表现出较高的比容量.

图5 不同合成温度下的Li4Ti5O12倍率曲线Fig. 5 Rate Capability of Li4Ti5O12 at Different Synthesis Temperatures
表1列出了样品在不同倍率下的首次充放电比容量数值.由表1得知,在最高倍率20C下,800 ℃下合成的样品比容量为53.48 mA·h/g,比其他样品的比容量高出约20 mA·h/g,可见800 ℃下合成的样品倍率性能及循环稳定性均优于850 ℃和900 ℃下合成的样品.

表1 不同倍率下各样品首次充放电比容量
图6为不同合成温度的Li4Ti5O12在5C倍率下的循环性能曲线.由图6可知,800 ℃,850 ℃,900 ℃下合成的样品初始比容量分别为107.0,121.3,82.4 mA·h/g,在前50次循环中比容量明显下降,1 000次循环结束后,容量保持率分别为84.1%,53.3%,69.7%.各曲线的上下波动规律基本一致,可能是由于昼夜温差导致的比容量变化.通过在大倍率电流下进行大量充放电测试,发现800 ℃下合成的样品具有较高的容量保持率及循环稳定性,若将其作为锂离子电池负极材料可显著提升电池的循环寿命.
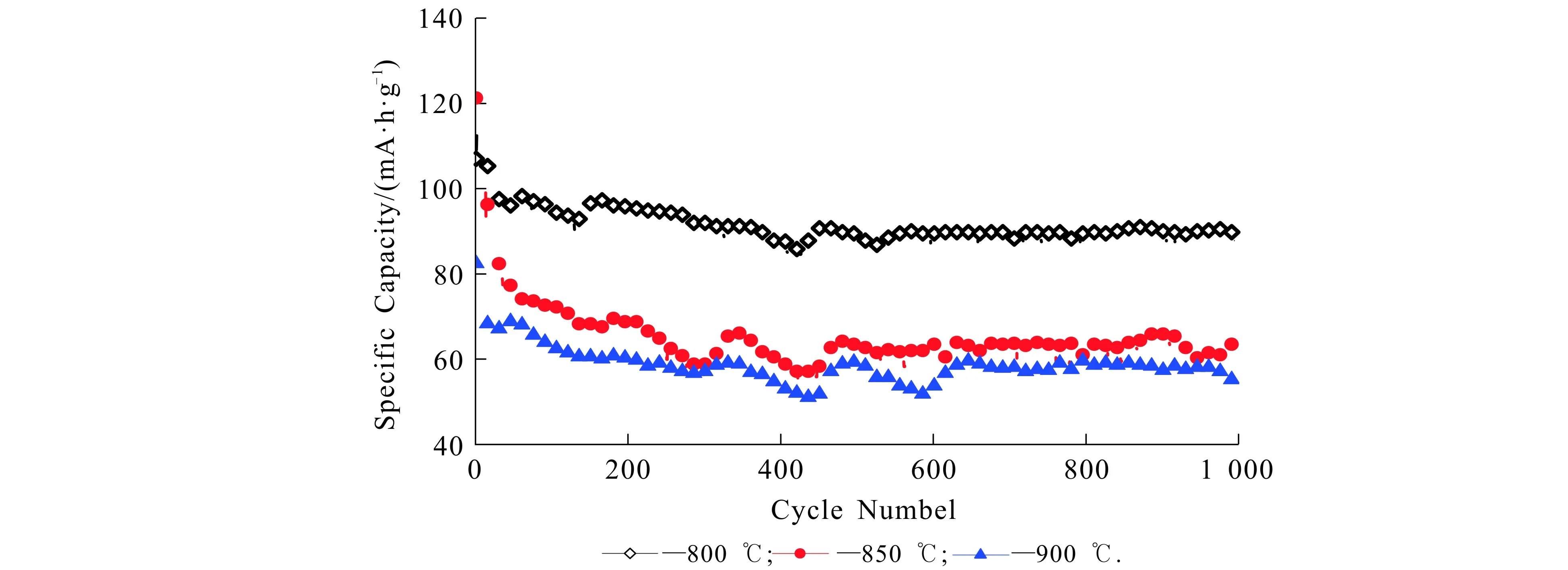
图6 不同合成温度的Li4Ti5O12在5C倍率下的循环性能曲线Fig. 6 Cycling Performance Curves of Li4Ti5O12 at Different Synthesis Temperatures with 5C Magnification
图7为不同合成温度的Li4Ti5O12交流阻抗及等效电路图.

图7 不同合成温度的Li4Ti5O12交流阻抗及等效电路图Fig. 7 AC Impedance and Equivalent Circuit of Li4Ti5O12 at Different Synthesis Temperatures
由图7可知,3条曲线均由中高频区的半圆和低频区的倾斜直线组成.中高频区的半圆对应着从活性物质表面到电解液中的电荷转移阻抗Rct,反映着法拉第反应动力学的快慢程度;低频区的斜线则对应Warburg阻抗Rw,反映着锂离子在活性物质内部的扩散能力.800 ℃,850 ℃,900 ℃下合成的样品经拟合后Rct分别为38.67,43.34,59.82 Ω,800 ℃下合成的样品拟合后的电荷转移阻抗最小,因此具有最高的电荷迁移速率,利于Li+快速嵌入脱出.
图8为不同合成温度下Li4Ti5O12的循环伏安曲线.如图8所示,3个合成样品在1.68 V和1.46 V电位附近均出现一对明显的氧化峰和还原峰,分别对应于充放电时的Li+嵌入和脱出过程.3个样品的氧化还原电位差分别为0.141,0.111,0.154 mV,三者的数值差别不大,并且还原峰电流的位置非常接近,表明极化电势稳定,充放电可逆性好.800 ℃下合成的样品氧化峰、还原峰较850 ℃,900 ℃更高更尖锐,表明Li+在其中嵌入脱出更快,扩散系数更大.

图8 不同合成温度下Li4Ti5O12的循环伏安曲线Fig. 8 CV Curves of Li4Ti5O12 at Different Synthesis Temperatures
3 结论
采用高温固相和两步合成法制备合成纯相无杂质Li4Ti5O12,粉末颗粒均匀,尺寸在200~400 nm,分散性较好.800 ℃下合成的样品在0.5C下首次可逆比容量为157.67 mA·h/g,库伦效率为96.1%,循环100次后容量保持率为98.63%;在5C下首次可逆比容量为107.0 mA·h/g,循环1 000次后容量保持率为84.1%.相比于850 ℃,900 ℃下合成的样品,800 ℃下合成的样品具有更低的电荷转移阻抗Rct以及更高更尖锐的氧化峰、还原峰,电化学性能更为优良.
